S-adenosylmethionine does not reduce ischaemia-reperfusion injury to a marginal liver graft in an in-vivo experiment
Tomáš Pantoflíček Orcid.org , Eva Koblihová Orcid.org 1, Miroslav Ryska2
+ Affiliation
Summary
SUMMARY
Pantoflíček T, Koblihová E, Ryska M. S-adenosylmethionine does not reduce ischaemia-reperfusion injury to a marginal liver graft in an in-vivo experiment
The aim of the study. The aim of our study was to determine whether the use of S-adenosylmethionine reduces ischaemia-reperfusion injury in hepatic grafts with a high degree of steatosis during liver transplantation in rats.
Materials and methods. we used healthy Lewis rats and rats with liver steatosis in our experiment. Rats were divided into four groups of seven animals: Ia: steatotic liver grafts were transplanted into seven healthy rats; S-adenosylmethionine was added to the perfusion solution used during removal of the liver grafts prior to transplantation; Ib: steatotic liver grafts were transplanted into seven healthy rats; S-adenosylmethionine was not used; IIa: normal liver grafts were transplanted into seven healthy rats; S-adenosylmethionine was added to the perfusion solution; IIb: normal liver grafts were transplanted into seven healthy rats; no S-adenosylmethionine was added to the perfusion solution. Blood samples were taken after transplantation at days 1, 3 and 14. The following markers of ischaemia-reperfusion injury were examined: ALT, AST and GSH.
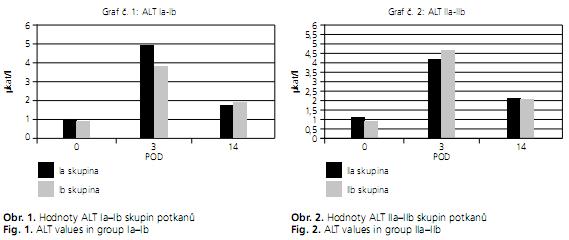
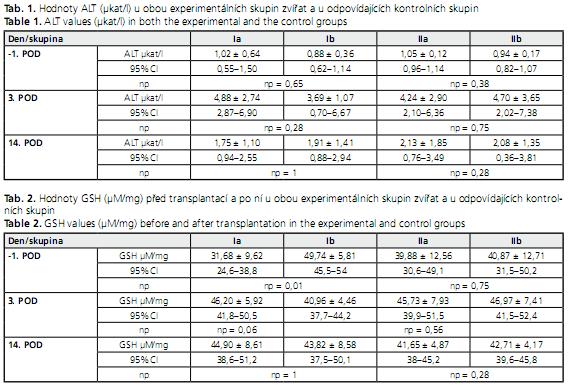
Results. The following ALT values were determined after transplantation at day 14: 1.75 ± 1.10 μkat/l (in group Ia), 1.91 ± 1.41 μkat/l (in group Ib), 2.13 ± 1.85 μkat/l (in group IIa) and 2.08 ± 1.35 μkat/l (in group IIb). There were no significant differences between these values. GSH values at day 14 post-transplantation were: 44.90 ± 8.61 μM/mg (in group Ia), 43.82 ± 8.58 μM/mg (in group Ib), 41.65 ± 4.87 μM/mg (in group IIa) and 42.71 ± 4.17 μM/mg (in control group IIb).
Conclusion. Laboratory markers of ischaemia-reperfusion injury proved the liability of steatotic liver graft to ischaemia-reperfusion injury but no significant differences were demonstrated between groups using S-adenosylmethionine and the control group. Our study didn’t demonstrated the positive effect of S-adenosylmethionine on ischaemia-reperfusion injury during liver transplantation in rats.
Key words: experimental liver transplantation, liver steatosis, ischaemia-reperfusion injury, S-adenosylmethionine.
ÚVOD
Transplantace jater je nejefektivnější způsob léčby terminálních stadií chronických onemocnění jater. Limitovaný počet vhodných kadaverózních dárců jater však zvyšuje pravděpodobnost úmrtí pacienta na čekací listině. Jednou z možností, jak tuto nepříznivou situaci zčásti řešit, je použít k transplantaci tzv. marginální jaterní štěpy z kadaverózních dárců(1,2).
Marginální jaterní štěp lze charakterizovat tím, že se kvalitou nachází na pomezí tzv. akceptabilního a neakceptabilního kadaverózního dárce. Tyto jaterní štěpy (většinou se jedná o játra s vysokým procentem steatózy) se pro vysoké riziko primární non-funkce, či těžké dysfunkce, k účelům transplantace obvykle nepoužívají.
Cílem naší práce bylo v experimentu prokázat, zda použití S-adenosylmethioninu (SAMe) vede ke snížení ischemicko-reperfuzního poškození u jaterních štěpů s vysokým procentem steatózy.
SAMe se podílí na reakcích vedoucích mimo jiné k udržování fluidity membrán, hlavně metylací membránových fosfolipidů. Podílí se také na tvorbě glutathionu, buněčného antioxidantu. Je známa zvýšená spotřeba SAMe při oxidativním stresu, který se podílí na patogenezi jaterního selhání. Snížením SAMe dochází k poruše transmetylací a k alteraci membránové fluidity. SAMe též zabraňuje zvýšení permeability vnitřní mitochondriální membrány a poklesu mitochondriálního membránového potenciálu(3-5). Všechny tyto procesy hrají důležitou roli ve snížení ischemicko-reperfuzního poškození.
MATERIÁL A METODIKA
Vyvolání steatózy jater
K pokusu jsme použili zdravé potkany typu Lewis a potkany s vyvinutou steatózou jater mužského pohlaví: potkany typu Lewis s počáteční váhou 180-190 gramů jsme krmili po dobu 7 týdnů cholin- methionin deficitní dietou (CMDD: koncentrace cholinu a methioninu menší než 0,03 %, složení: kasein - 6,0 %, kukuřičný škrob - 70,0 %, sacharóza - 10,0 %, celulóza - 4,0 %, kukuřičný olej - 1,0 %, vepřové sádlo - 4,0 %, USP vitaminy bez cholinu - 1,0 % a USP - 17 mineralů - 4,0 %) dle metodiky autorů Nakano et al.(3,6). Po vyživení potkani dosahovali váhy 300-350 gramů. Před zahájením odběru jater byl u všech potkanů mikroskopicky vyšetřen stupeň steatózy jaterní tkáně: minimální stupeň steatózy dosahoval 54 %. Změny ve smyslu steatohepatitidy nebyly významně vyjádřeny.
Zdravé i steatotické potkany jsme chovali ve stejných podmínkách s tím, že k potkanům - dárcům s jaterní steatózou byli vybráni potkani - dárci jaterního štěpu bez steatózy podobné hmotnosti.
Technika odběru jater
Po provedení střední laparotomie s oboustranným subkostálním řezem jsme ligovali a přerušili v. diaphragmatica sin., v. gastroduodenalis a v. lienalis. Zavedli jsme stent do žlučovodu a následně žlučovod přerušili. Poté jsme přerušili a. hepatica propria, zasvorkovali v. portae a v. cava inferior infrahepatalis. Po provedení kontinuální perfuze jater jsme provedli hepatektomii. Perfuzi jsme prováděli roztokem Custodiol firmy Kohler (HTK - Histidin - Tryptofan - Ketoglutarate) v množství 80 ml, s tlakem 10 cm H2O.
Technika jaterní transplantace
Hepatektomie nativních jater je totožná s odběrem, ale bez přerušení v. lienalis. Po nasazení svorek na v. cava inferior infrahepatalis, v. portae a v. cava inferior suprahepatalis jsme játra vyňali z břišní dutiny potkana.
Transplantaci jater jsme prováděli metodou podle Engemanna(7) bez anastomózy hepatické artérie. Suprahepatickou anastomózu jsme šili end-to-end Prolenem 7/0, anastomózu v. portae Nylonem 9/0 a infrahepatickou anastomózu Prolenem 7/0. Anastomózu žlučovodu jsme provedli za použití stentu zavedeného při odběru transplantovaných jater(8).
Odběr i následnou transplantaci jsme prováděli v celkové anestezii narkothanovou inhalační narkózou (Narkothan, Zentiva a.s.). Dobu studené ischemie jsme stanovili na 4 hodiny.
Přípravek
V experimentu byl použit přípravek Transmetil (Abbott Gmbh, Wiesbaden), který obsahuje léčivou látku S-adenosylmethionin. Ta je principiálním metylovým donorem pro nukleární acidy, proteiny, fosfolipidy, biologické aminy, je prekurzor aminopropilové skupiny a glutathionu v játrech, regulátorem aktivace enzymů(9).
Rozdělení skupin
Příjemce jaterního štěpu - byli vybráni zdraví potkani Lewis váhy cca 350-400 gramů, které jsme rozdělili na dvě skupiny (I. a II. skupina) se dvěma podskupinami (Ia, b, IIa, b). U I. skupiny jsme použili k transplantaci kadaverózní štěp s minimálním stupněm steatózy 54 %. U II. skupiny jsme u zdravých potkanům Lewis váhy cca 350-400 mg výše popsanou technikou provedli transplantaci jater zdravého potkana Lewis váhy 300-350 gramů (váhově adekvátní k steatotickému potkanu).
Ia skupina: U sedmi potkanů při odběru jaterního štěpu byl do perfuzního roztoku přidán Transmetil v množství 0,8 mg na 100 g hmotnosti - dle doporučení výrobce.
Ib. skupina - kontrolní k Ia: U sedmi potkanů jsme provedli identický operační výkon s použitím steatotického štěpu. Perfuzi jsme provedli roztokem Custodiol bez aplikace Transmetilu.
IIa. skupina: U sedmi zdravých potkanů jsme perfuzi jaterního štěpu prováděli roztokem Custodiol, do kterého jsme přidali Transmetil ve stejné dávce jako v první skupině.
IIb. skupina - kontrolní k IIa: U sedmi zvířat jsme provedli identický operační výkon s perfuzí jaterního štěpu Custodiolem bez použití Transmetilu.
U všech skupin byla dodržena délka studené ischemie 4 hodiny. Po transplantaci jater byla zvířata uložena do chovných boxů. První pooperační den měla volný přístup k vodě, v následujících dnech normální dietu. Odběry krve byly prováděny den před operací (POD -1) a 3. a 14. pooperační den (POD 3, 14). Sledovány byly markery ischemickoreperfuzního poškození (ALT, AST, GSH - glutathion). Všechna zvířata se dožila 14. POD, kdy byla utracena.
Statistika
Výsledky jsou uvedeny ve formě jednotlivých hodnot, průměru a směrodatné odchylce. Ke statistickým výpočtům byl použit Studentův t-test, test extrémních hodnot a z důvodu velkého rozptylu hodnot neparametrický - Wilcoxonův test.
Studie byla provedena za dodržování pravidel dle platných zákonu Evropské unie a České republiky (č. 246/1992 Sb. na ochranu zvířat proti týrání, novelizovaný Zákonem ČNR č. 162/1993 Sb.).
VÝSLEDKY

Celkově jsme do naší experimentální studie zařadili 28 potkanů, sedm zvířat v každé skupině. Všech 28 zvířat se dožilo 14. POD, kdy byla utracena. Porovnávány byly laboratorní hodnoty mezi skupinamy s přidaným SAMe a bez jeho použití. Hodnoty ALT v obou srovnávaných skupinách Ia oproti Ib a IIa oproti IIb se 3. a 14. POD signifikantně nelišila (tab. 1).
Koncentrace GSH se u skupiny Ia oproti Ib a IIa oproti IIb 3. a 14. POD signifikantně nelišily (tab. 2).
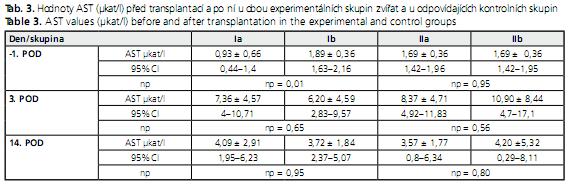
Hodnoty AST u všech skupin zvířat se signifikantně nelišily (tab. 3).
DISKUSE
Ischemicko-reperfuzní poškození je častým problémem při transplantaci jater(10). K poškození dochází při ischemii sníženým přísunem energie, která je potřebná pro udržování iontového gradientu a homeostázy a je příčinou funkčního a strukturního poškození jaterních buněk. Reperfuze zhoršuje poškození aktivací zánětlivých reakcí. Poškození mikrocirkulace, zejména postkapilárních venul se vyznačuje edémem endoteliálních buněk, ztrátou bariérové funkce, zvýšenou membránovou propustnosti a intersticiálním edémem(2, 11-13).
Ischemicko-reperfuzní poškození má multifaktoriální příčiny a k jeho snížení může docházet zásahy na různých úrovních(14), což se projeví na zlepšení funkčnosti štěpu. K základním možnostem patří ovlivnění délky teplé a studené ischemie, kvality jaterního štěpu a ovlivnění složení perfuzního roztoku.
V naší studii jsme použili jako model marginálního štěpu steatotická játra. Jedná se o postižení jater dlouhodobého charakteru. Metoda je dobře reprodukovatelná a dobře aplikovatelné v humánní medicíně v reálné situaci(3,6, 15).
Pozitivní vliv SAMe na normální i steatotické hepatocyty in vitro již bylo prokázán(4,16). Kucera et al.(4) prokázali pozitivní vliv SAMe na hepatocyty poškozené D-galaktosaminem v primokultuře. Zaznamenali signifikantní snížení uvolňování laktát dehydrogenázy. V testované skupině nedocházelo oproti kontrolní ke změně v uvolňování urey a albuminu.
Taktéž byl prokázán vliv SAMe na "rat liver perfusion" modelu, kdy se sledovaly známky poškození jaterních buněk při kontinuální perfuzi játry. Dunne et al.(17) popsali pozitivní vliv SAMe ve vyrovnání a normalizaci krevního průtoku, produkce žluče a Oxygen extraction ratio (OER). Neprokázali však oproti kontrolním skupinám adekvátní pozitivní změny v hladinách jaterních enzymů a purin-nucleosid fosforylázy.
Nakano et al.(15) popsali snížení ischemicko-reperfuzního poškození u steatotických jaterních potkaních buněk. Na "rat liver perfusion" modelu prokázali pozitivní vliv N-acetylcysteinu u steatotických jater na produkci žluče a oproti autorům Dunne et al.(17) i na vliv jaterních enzymů a GSH. Všechny tyto modely se omezují na prokázání pozitivního vlivu SAMe in vitro nebo na již zmíněném "rat liver perfusion" modelu.
Cílem naší studie bylo zhodnotit vliv SAMe při steatóze jater na modelu transplantace jater u potkana. Jedná se tedy o prokázání jeho vlivu in vivo. Výsledky naší práce ukázaly ve shodě s dalšími autory(15,17), že průměrné hodnoty ALT byly ve skupině zvířat s použitým steatotickým štěpem vyšší než u zvířat s použitým normálním štěpem, tj. bez známek steatózy. Neprokázali jsme ale snížení rizika ischemicko-reperfuzního poškození při použití SAMe. Laboratorní známky ischemicko-reperfuzního poškození se v případě použití této látky signifikantně nelišily od skupiny bez jeho použití.
ZÁVĚR
Laboratorní známky ischemicko-reperfuzního poškození při transplantaci steatotického jaterního štěpu, který je více náchylný k ischemicko-reperfuznímu poškození, se v případě použití S-adenosylmethioninu signifikantně nelišil od skupiny bez jeho použití. Naše studie neprokázala vliv S-adenosylmethioninu na působení oxidačního stresu in vivo a neprokázala jeho pozitivní vliv na snížení ischemicko-reperfuzního poškození při experimentální transplantaci jater na malém laboratorním zvířeti.
Práce byla uskutečněna s podporou výzkumného centra LN00A065 - Centrum buněčné terapie a tkáňových náhrad, a s podporou rozvoje a výzkumu S-8120.
LITERATURA
- 1. Urena MA, Moreno Gonzalez E, Romero CJ, Ruiz- Delgado FC, Moreno Sanz C. An approach to the rational use of steatotic donor livers in liver transplantation. Hepatogastroenterology 1999; 46: 1164- 1173.
- 2. Kočík M, Ryska M, Bělina F. Současné možnosti perfuze jater a její význam pro jaterní přenosy. Bull HPB 2001; 9: 65-69.
- 3. Nakano H, Nagasaki H, Yoshida K, Kigawa G, Fujiwara Y, Kitamura N, et al. N-acetylcysteine and anti-ICAM-1 monoclonal antibody reduce ischemiareperfusion injury of the steatotic rat liver. Transplant Proc 1998; 30: 3763.
- 4. Kucera O, Cervinkova Z, Lotkova H, Krivakova P, Rousar T, Muzakova V, et al. Protective effect of S-adenosylmethionine against galactosamine-induced injury of rat hepatocytes in primary culture. Physiol Res 2006; 55: 551-560.
- 5. Lotková H, Červinková Z, Kučera O. S-adenosylmethionin a játra. Folia Gastroenterol Hepatol 2006; 4: 150-156.
- 6. Kaneshiro Y, Nakano H, Kumada K, Boudjema K, Kitamura N, Shimura H, et al. Augmentation of mitochondrial reduced glutathione by S-adenosyl-Lmethionine administration in ischemia-reperfusion injury of the rat steatotic liver induced by cholinemethionine- deficient diet. Eur Surg Res 1998; 30: 34-42.
- 7. Engemann R. Orthotopic liver transplantation in the rat. Langenbecks Arch Chir 1993; 378: 66-67.
- 8. Ryska M, Pantoflíček T, Lipár K, Poledne, R. Transplantace jater pro hypercholesterolémii v experimentu. Čes a Slov Gastroent a Hepatol 2002; 56: 100- 103.
- 9. Lieber CS, Packer L. S-Adenosylmethionine: molecular, biological, and clinical aspects - an introduction. Am J Clin Nutr 2002; 76: 1148S-1150S.
- 10. Torras J, Cruzado JM, Grinyo JM. Ischemia and reperfusion injury in transplantation. Transplant Proc 1999; 31: 2217-2218.
- 11. Kurokawa T, Takagi H. Mechanism and prevention of ischemia-reperfusion injury. Transplant Proc 1999; 31: 1775-1776.
- 12. Nishimura T, Yoshida Y, Watanabe F, Koseki M, Nishida T, Tagawa K, et al. Blood level of mitochondrial aspartate aminotransferase as an indicator of the extent of ischemic necrosis of the rat liver. Hepatology 1986; 6: 701-707.
- 13. Ortiz P, Moreno J, Puerta JL, Mato JM. S-adenosylL- methionine and the liver. Ital J Gastroenterol 1993; 25: 135-137.
- 14. Selzner M, Rudiger HA, Sindram D, Madden J, Clavien PA. Mechanisms of ischemic injury are different in the steatotic and normal rat liver. Hepatology 2000; 32: 1280-1288.
- 15. Nakano H, Nagasaki H, Barama A, Boudjema K, Jaeck D, Kumada K, et al. The effects of N-acetylcysteine and anti-intercellular adhesion molecule-1 monoclonal antibody against ischemia-reperfusion injury of the rat steatotic liver produced by a choline-methionine- deficient diet. Hepatology 1997; 26: 670-678.
- 16. Caro AA, Cederbaum AI. Inhibition of CYP2E1 catalytic activity in vitro by S-adenosyl-L-methionine. Biochem Pharmacol 2005; 69: 1081-1093.
- 17. Dunne JB, Davenport M, Williams R, Tredger JM. Evidence that S-adenosylmethionine and N-acetylcysteine reduce injury from sequential cold and warm ischemia in the isolated perfused rat liver. Transplantation 1994; 57: 1161-1168.
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users