Anticancer effect of statins on experimental model of human pancreatic adenocarcinoma
Helena Gbelcová1, Martin Leníček Orcid.org , Jaroslav Zelenka, Zdeněk Knejzlík, Gabriela Dvořáková, Marie Zadinová, Pavla Poučková Orcid.org , Tomáš Ruml, Libor Vítek Orcid.org , Tomáš Krechler Orcid.org
+ Affiliation
Summary
SUMMARY
Gbelcová H, Leníček M, Zelenka J, Krechler T, Knejzlík Z, Dvořáková G, Zadinová M, Poučková P, Ruml T, Vítek L. Anticancer effect of statins on experimental model of human pancreatic adenocarcinoma
The aim of the study: HMG-CoA reductase inhibitors (statins) are widely used for treatment of hypercholesterolemia. However, their inhibitory action on HMG-CoA reductase results also in depletion of intermediates contributing importantly to the cell proliferation. The aim of the present study was to compare the effects of individual statins on experimental pancreatic cancer.
Material and methods: The effects of seven individual statins on proliferation of three human pancreatic cancer cell lines were evaluated in vitro. The in vivo studies were performed on nude mice xenotransplanted with CAPAN-2 human pancreatic cancer cells. The mice received oral treatment either with placebo, or statins mentioned above in a daily dose corresponding to hypocholesterolemic dose in humans. The primary endpoints were a survival rate and tumor size.
Results: Substantial antiproliferative effects of all statins were detected both in vitro and in vivo. Simvastatin and cerivastatin were the most efficient compounds in vitro and these effects were also paralleled in vivo as confirmed by Kaplan-Meier survival analysis (p = 0.0006 for both statins). Similarly potent in vivo antiproliferative effects were observed also for rosuvastatin (p = 0.0006) and fluvastatin (p = 0.0008).
Conclusion: This study demonstrates substantial inhibitory effects of various statins on progression of experimental pancreatic adenocarcinoma. These results support great potential of statins for chemo-adjuvant treatment of pancreatic cancer.
Key words: farnesylation - HMG-CoA reductase -cholesterol- K-ras oncogene - pancreatic cancer -mevalonate - proliferation - statins.
ÚVOD
Inhibitory hydroxymetylglutaryl koenzym A (HMG-CoA) reduktázy (statiny) se běžně používají pro léčbu hypercholesterolémie. Účinky statinů na lidský organizmus jsou však pleiotropní a zahrnují inhibiční působení na tvorbu aterogenního plátu, agregaci krevních destiček, nebo zlepšení funkce endotelu a fibrinolytické aktivity, či dokonce přímé protektivní účinky statinů na mortalitu u akutního infarktu myokardu(1,2) . Inhibice HMG-CoA reduktázy vede navíc k depleci několika důležitých meziproduktů, jako jsou farnesylpyrofosfát (FPP) a geranylgeranylpyrofosfát (GGPP), které modifikují některé intracelulární proteiny (3) uplatňující se v mnoha mitogenních signálně transdukčních drahách (4) . Z těchto důvodů se jeví inhibice farnesylace/geranylgeranylace jako možný přístup pro léčbu některých nádorových onemocnění. Antiproliferační účinky statinů byly v posledních letech popsány v řadě in vitro i in vivo studií s buněčnými liniemi hepatocelulárního karcinomu (5) , karcinomu plic (6) , kolorektálního (7) nebo pankreatického karcinomu (8-13) . Z tohoto pohledu je karcinom pankreatu obzvláště zajímavý, protože více než 90 % těchto nádorů nese aktivační mutace v K-ras protoonkogenu (14) , ústící v nekontrolovanou fosforylaci mitogenních intracelulárních proteinů. Pro funkci produktu K-ras protoonkogenu je nezbytná farnesylace, což je posttranslační modifikace ukotvující tento protein v buněčné membráně. Inhibice farnesylace, například statiny, se tedy jeví jako možný terapeutický přístup pro tyto nádory.
Protinádorové účinky statinů byly prokázány i v humánních studiích zaměřených primárně na posouzení potenciálních antiproliferačních účinků statinů (15,16) , stejně tak jako v několika dalších epidemiologických studiích primárně zaměřených na prevenci kardiovaskulárních chorob a jejich komplikací (17-19) .
Antiproliferační účinky byly popsány pro všechny statiny, nicméně některé práce naznačují, že jednotlivé statiny mají odlišný protinádorový potenciál. Wong et al. (20) popsali ve studii s buňkami akutní myeloidní leukémie významně vyšší inhibiční účinky cerivastatinu ve srovnání s lovastatinem, atorvastatinem a fluvastatinem. V jiné in vitro studii na leukemických buněčných liniích byl simvastatin nejúčinnějším statinem, zatímco pravastatin měl účinek nejslabší (21) . Podobné výsledky byly demonstrovány také u osteosarkomových buněčných linií léčených simvastatinem nebo pravastatinem (22) . Odlišné antiproliferační účinky statinů mohou být způsobeny rozdíly v jejich struktuře, farmakokinetice i stupni biotransformace (23) .
Přestože statiny byly intenzivně studovány jako možná chemoterapeutika, komplexní data týkající se rozdílů v jejich protinádorových účincích neexistují. Cílem naší studie proto bylo na in vitro a in vivo experimentálních modelech porovnat účinky různých statinů na růst a proliferaci karcinomu pankreatu.
MATERIÁL A METODIKA
Materiál
Pro in vitro studie byly použity chemicky čisté formy následujících statinů: pravastatin, atorvastatin, lovastatin, fluvastatin, rosuvastatin, cerivastatin (Alexis, USA) a simvastatin (MSD, USA). Mevalonát, FPP, a GGPP byly získány od společnosti Sigma (USA). Pro in vivo studie byly použity komerčně dostupné terapeutické preparáty těchto statinů: pravastatin (0,5 mg/kg/d, Lipostat, Bristol-Myers Squibb, USA), atorvastatin (0,5 mg/kg/d, Sortis, Pfizer, USA), lovastatin (1 mg/kg/d, Mevacor, MSD, USA), simvastatin (0,5 mg/kg/d, Zocor, MSD, USA), cerivastatin (0,25 mg/kg/d, Cholstat, Laboratories Fournier, Francie) a fluvastatin (0,5 mg/kg/d, Lescol, Novartis, Švýcarsko).
Tkáňové kultury
Pro in vitro studie byly použity následující buněčné kultury lidského adenokarcinomu pankreatu: CAPAN-2 (dobře diferencovaný adenokarcinom, ATCC, USA), Mia PaCa-2 (špatně diferencovaný adenokarcinom, ATCC), obě linie s aktivačními mutacemi v kodónu 12 K-ras protoonkogenu (10) , a BxPC-3 (středně diferencovaný adenokarcinom bez aktivační mutace v K-ras protoonkogenu, ATCC) (24) . Buněčné linie byly kultivovány v humidifikované atmosféře obsahující 5% C02 při teplotě 37 °C v následujících médiích suplementovaných 10% fetálním hovězím sérem: MiaPaCa-2 v DMEM, BxPC-3 v RPMI1640 médiu a CAPAN-2 v McCoy's 5A médiu s L-glutaminem (l,5 mM ) a bikarbonátem sodným (1,5 g/l).
Pro inokulaci byla použita suspenze zhruba 3x104 buněk ve 2 ml média. O 24 hodin později byly přidány statiny ze zásobních roztoků v metanolu (20 μl na jamku) ve finálních koncentracích 0,5; 1; 5; 20 a 50 mg/l. Pro negativní kontroly bylo použito 20 μl metanolu. Destičky byly inkubovány po dobu 3 dnů. Po 24, 48 a 72 hodinách inkubace se statiny byly buňky promyty PBS, uvolněny 0,25% trypsinem, sklizeny a posléze resuspendovány. Růst buněk a jejich viabilita byly posuzovány počítáním buněk exkludujících 0,4% trypanovou modř. Všechny experimenty byly provedeny v tripletu.
Animální studie
In vivo studie byly provedeny na athymických myších (n = 6 v každé léčené skupině) (kmen CD-1, Charles River WIGA, Německo) xenotransplantovaných subkutánně buňkami lidského adenokarcinomu pankreatu CAPAN-2 (107 buněk). Po přihojení a iniciaci nádorového růstu (7-10 dnů po xenotransplanci, velikost nádoru na začátku léčby 0,27±0,04 cm3) byla zahájena léčba placebem (fyziologický roztok), nebo statiny používanými v humánní medicíně uvedenými výše v denní dávce přibližně odpovídající hypocholesterolemické dávce u člověka. Statiny byly podávány jedenkrát denně žaludeční sondou ve formě vodné suspenze. Primárním parametrem byla doba přežívání zvířat, současně byla analyzována progrese nádorů měřením jejich velikosti ve dvou největších, na sebe kolmých průměrech každý třetí den (25) .
Studie na zvířatech byly schváleny Komisí pro práci se zvířaty 1. LF UK v Praze.
Statistická analýza
Data jsou prezentována jako medián a 25-75% rozmezí. Účinek statinů na přežívání zvířat byl hodnocen standardní neparametrickou analýzou (Mann-Whitney Rank Sum test) i Kaplanovou-Meierovou analýzou přežívání s Holm-Sidak post-hoc testováním. Rozdíly v průměrné velikosti nádorů byly hodnoceny variační analýzou s opakovanými měřeními (RM ANOVA) s Holm-Sidak post-hoc testováním. V případě potřeby (požadavek na normalitu a stejnou variaci dat) byla pro srovnání provedena logaritmická transformace dat. Rozdíly byly považovány za statisticky významné při p < 0,05.
VÝSLEDKY
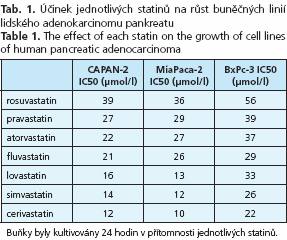
Inhibiční účinky jednotlivých statinů na růst buněčných linií adenokarcinomu pankreatu
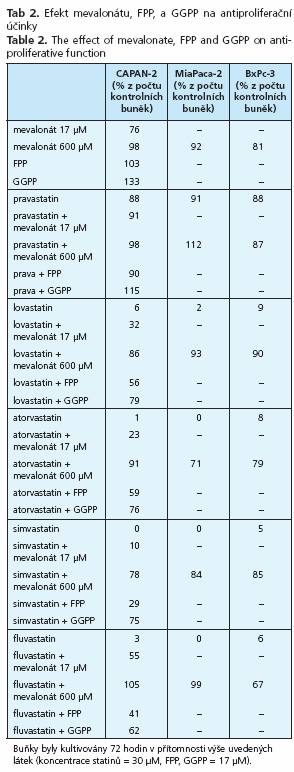
Protinádorové účinky jednotlivých statinů byly analyzovány v in vitro experimentech na třech buněčných liniích lidského adenokarcinomu pankreatu. Nejsilnější inhibiční účinky byly prokázány pro cerivastatin a simvastatin, zatímco nejslabší účinky byly pozorovány pro pravastatin a rosuvastatin (tab. 1 a 2). Přítomnost mevalonátu, stejně tak jako FPP či GGPP významně oslabila protinádorový účinek všech statinů (tab. 2). Po přidání mevalonátu v koncentraci daleko přesahující koncentrace statinů byl jejich antiproliferační účinek zcela eliminován, zatímco ekvimolární koncentrace mevalonátu měly efekt pouze částečný (tab. 2).
Účinky jednotlivých statinů na růst a proliferaci buněk lidského adenokarcinomu CAPAN-2 xenotransplantovaných atymickým myším
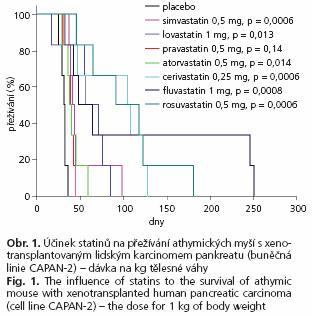
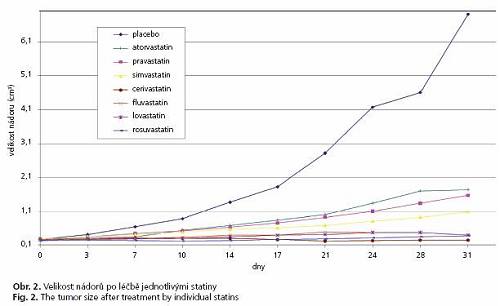
Všechny použité statiny signifikantně prodloužily přežívání myší s xenotranplantovaným lidským karcinomem pankreatu. Zatímco medián přežívání zvířat léčených placebem byl 31,5 (25-75 %; 29-32) dnů, myši léčené pravastatinem přežívaly 39,5 (36-42) dnů (p = 0,01) ve srovnání s 39 (36-45) (p = 0,04) a 42 (39-44) dny (p = 0,002) ve skupinách léčených atorvastatinem a simvastatinem. Nejdelší přežívání bylo pozorováno u myší léčených cerivastatinem (106,5 (47-122) dnů, p = 0,002) a rosuvastatinem (104,5 (65-122) dnů, p = 0,002). Významné protinádorové účinky byly zaznamenány také u skupiny léčené fluvastatinem (56 (42-246) dnů, p = 0,009), kde ve dvou případech došlo dokonce ke kompletní remisi nádorového onemocnění. Parciální regrese nádorů byly pozorovány také u několika myší léčených cerivastatinem a rosuvastatinem. Také Kaplanova-Meierova analýza přežívání prokázala nejdelší přežívání u zvířat léčených rosuvastatinem, cerivastatinem, fluvastatinem a simvastatinem (obr. 1). I mezi těmito nejúčinnějšími statiny byly pozorovány značné rozdíly v přežívání. Stupeň přežívání velmi dobře koreloval s progresí nádorů během prvních 31 dnů po zahájení léčby která byla zřetelně snížena u statiny léčených zvířat (obr. 2). Detailní analýza velikosti nádorů prokázala, podobně jako u výsledků přežívání, signifikantní rozdíly mezi jednotlivými statiny s nejlepšími výsledky ve skupinách léčených fluvastatinem a cerivastatinem (obr. 2). Léčba cerivastatinem, rosuvastatinem a fluvastatinem zastavila progresi nádoru, zatímco ve všech dalších léčených skupinách byla progrese nádorů pouze zpomalena.
DISKUZE
Statiny jsou intenzivně studovanými léky, zejména pro jejich hypocholesterolemické účinky. Jejich působení je však pleiotropní a zahrnuje potenciálně vysoké a klinicky relevantní protinádorové účinky. Antiproliferační účinky statinů byly skutečně popsány u celé řady experimentálních nádorů včetně karcinomu pankreatu (8-13,26-29) . První studie týkající se účinku statinů na karcinom pankreatu byla publikována již v roce 1992 japonskými autory (8) , kteří popsali významné antiproliferační účinky lovastatinu na špatně i dobře diferencované buněčné linie karcinomu pankreatu za podmínek in vitro i in vivo. V animální studii však byly použity extrémně vysoké koncentrace lovastatinu (60 mg/kg tělesné váhy) (8) . Podobné účinky lovastatinu na karcinom pankreatu byly popsány také ve studii Mikulského a kolegů (9) a také v dalších dvou in vitro studiích, kde bylo prokázáno, že lovastatin inhibuje proliferaci karcinomu pankreatu dokonce i při absenci aktivačních mutací v K-ras protoonkogenu (10,11) .
Popisovaná studie je první studií srovnávající rozdíly v účincích jednotlivých komerčně dostupných statinů na růst a proliferaci lidského karcinomu pankreatu za podmínek in vitro i in vivo. Všechny použité statiny významně inhibovaly růst všech třech buněčných linií karcinomu pankreatu in vitro. Jejich účinnost však byla jednoznačně závislá na typu použitého statinů se značnými rozdíly mezi jednotlivými léky. Tyto inhibiční účinky byly částečně eliminovány současným podáváním mevalonátu, FPP a GGPP, což potvrzuje přímou souvislost vlivu statinů s proliferací karcinomu pankreatu v důsledku inhibice farnesylace onkogenů. Nejúčinnějšími statiny za podmínek in vitro byly cerivastatin a simvastatin. Za podmínek in vivo byly podobně silné antiproliferační účinky zjištěny také pro fluvastatin a rosuvastatin (obr. 1). Tento výsledek je velmi zajímavý jelikož fluvastatin je považován za statin s nejnižším hypocholesterolemickým účinkem (30) . Značné rozdíly v antiproliferačním účinku mezi jednotlivými statiny mohou být způsobeny mnoha faktory, jako jsou například odchylky v chemické struktuře vedoucí ke změnám ve farmakokinetice afarmakodynamice těchto sloučenin (23) . Všechny statiny s výjimkou pravastatinu a rosuvastatinu jsou kupříkladu lipofilními látkami, což samozřejmě výrazně ovlivňuje jejich bio-dostupnost. Není bez zajímavosti, že oba hydrofilní statiny uvedené výše měly za podmínek in vitro nejhorší antiproliferační účinky. Dále je známo, že lipofilní statiny lovastatin a simvastatin inhibují HMG-CoA reduktázu také v periferních buňkách, zatímco hydrofilní pravastatin vykazuje tento účinek pouze v hepatocytech (31) . Oproti tomu rosuvastatin, druhý hydrofilní statin, je schopen inhibovat HMG-CoA reduktázu v nehepatálních buňkách s o dva řády vyšší účinností (32) , což může mimo jiné vysvětlovat velmi dobré antiproliferační účinky tohoto statinu za podmínek in vivo. Navíc je také známo, že lipofilní atorvastatin, fluvastatin, lovastatin a simvastatin mají přímé proapoptotické účinky (33,34) , zatímco pravastatin tyto účinky postrádá (34) . Rozdíly v biologickém chování statinů jsou dále podporovány skutečností, že pravastatin má o dva řády nižší antioxidační účinky než například fluvastatin (35) . Mezi další faktory, které se mohou podílet na pozorovaných rozdílech v účinnosti jednotlivých statinů, patří jistě i rozdíly ve vazbě na plazmatické bílkoviny, stejně tak jako v biologickém poločasu (23) . Naše výsledky jsou také podporovány in vitro studií na buňkách karcinomu prsu, kde byly také popsány rozdíly v antiproliferačních účincích různých statinů. Zajímavé je, že i v této studii byly nejúčinnějšími statiny fluvastatin a simvastatin, zatímco pravastatin neměl inhibiční účinek až do koncentrace 50 μM (36) .
ZÁVĚR
Na základě našich výsledků stejně tako dosud publikovaných dat jiných autorů se inhibitory HMG-CoA reduktázy jeví jako potenciální látky pro chemoadjuvantní léčbu karcinomu pankreatu. Tyto závěry jsou podporovány také velmi slibnými výsledky rozsáhlé, dosud nepublikované studie vlivu statinů na výskyt karcinomu pankreatu na populaci téměř půl milionu amerických válečných veteránů (37) .
Podpořeno grantem IGA MZ ČR NR8132-3.
Literatura
- 1. Bellosta S, Ferri N, Bernini F, et al. Non-lipid-related effects of statins. Ann Med 2000; 32: 164-176.
- 2. Vítek L, Leníček M. Cytoprotective and antiproliferative effects of HMG-CoA reductase inhibitors. Curr Enz Inhib 2006; 2: 261-280.
- 3. Elson CE, Peffley DM, Hentosh P, Mo H. Isoprenoid-mediated inhibition of mevalonate synthesis: potential application to cancer. Proč Soc Exp Biol Med 1999; 221:294-311.
- 4. Prone GJ, Bos JL. The role of p21ras in receptor tyrosine kinase signalling. Biochim Biphys Actal994; 1198: 131-147.
- 5. Kawata S, Nagase T, Yamasaki E, et al. Modulation of the mevalonate pathway and cell growth by pravastatin and d-limonene in a human hepatoma cell line (Hep G2). Br J Cancer 1994; 69: 1015-1020.
- 6. Hawk MA, Cesen KT, Siglin JC, et al. Inhibition of lung tumor cell growth in vitro and mouse lung tumor formation by lovastatin. Cancer Lett 1996; 109: 217-222.
- 7. Feleszko W, Jakobisiak M. Lovastatin augments apoptosis induced by chemotherapeutic agents in colon cancer cells. Clin Cancer Res 2000; 6: 1198-1199.
- 8. Sumi S, Beauchamp RD, Townsend CM, et al. Inhibition of pancreatic adenocarcinoma cell growth by lovastatin. Gastroenterology 1992; 103: 982-89.
- 9. Mikulski SM, Viera A, Darzynkiewicz Z, Shogen K. Synergism between a novel amphibian oocyte ribonuclease and lovastatin in inducing cytostatic and cytotoxic effects in human lung and pancreatic carcinoma cell lines. Br J Cancer 1992; 66: 304-310.
- 10. Sumi S, Beauchamp RD, Townsend CM Jr, et al. Lovastatin inhibits pancreatic cancer growth regardless of RAS mutation. Pancreas 1994; 9: 657-661.
- 11. Kusama T, Mukai M, Iwasaki T, et al. Inhibition of epidermal growth factor-induced RhoA translocation and invasion of human pancreatic cancer cells by 3-hydroxy-3-methylglutarylcoenzyme a reductase inhibitors. Cancer Res 2001; 61: 4885-4891.
- 12. Kusama T, Mukai M, Iwasaki T, et al. 3-hydroxyl-3-methylglutarylcoenzyme a reductase inhibitors reduce human pancreatic cancer cell invasion and metastasis. Gastroenterology 2002; 122: 308-317.
- 13. Kaminski R, Kozar K, Kopec M, et al. Discussion on 3-hydroxy-3-methylglutarylcoenzyme a reductase inhibitors reduce human pancreatic cancer cell invasion and metastasis. Gastroenterology 2002; 123: 1747.
- 14. Almoguera C, Shibata D, Forrester K, et al. Most human carcinomas of the exocrine pancreas contain mutant c-K-ras genes. Cell 1988; 53: 549-554.
- 15. Kawata S, Yamasaki E, Nagase T, et al. Effect of pravastatin on survival in patients with advanced hepatocellular carcinoma. A randomized controlled trial. Br J Cancer 2001; 84: 886-891.
- 16. Minden MD, Dimitroulakos J, Nohynek D, Penn LZ. Lovastatin induced control of blast cell growth in an elderly patient with acute myeloblastic leukemia. Leuk Lymphoma 2001; 40: 659-662.
- 17. Pedersen TR, Wilhelmsen L, Faergeman O, et al. Follow-up study of patients randomized in the Scandinavian simvastatin survival study (4S) of cholesterol lowering. Am J Cardiol 2000; 86: 257-262.
- 18. Blais L, Desgagne A, LeLorier J. 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors and the risk of cancer: a nested case-control study. Arch Intern Med 2000; 160: 2363-2368.
- 19. Lovastatin Study Groups I through IV. Lovastatin 5-year safety and efficacy study. Arch Intern Med 1993; 153: 1079-1087.
- 20. Wong WW, Tan MM, Xia Z, et al. Cerivastatin triggers tumor-specific apoptosis with higher efficacy than lovastatin. Clin Cancer Res 2001; 7: 2067-2075.
- 21. Newman A, Clutterbuck RD, Powles RL, et al. A comparison of the effect of the 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase inhibitors simvastatin, lovastatin and pravastatin on leukaemic and normal bone marrow progenitors. Leuk Lymphoma 1997; 24: 533-537.
- 22. Sugiyama M, Kodama T, Konishi K, et al. Compactin and simvastatin, but not pravastatin, induce bone morphogenetic protein-2 in human osteosarcoma cells. Biochem Biophys Res Commun 2000; 271: 688-692.
- 23. Schachter M. Chemical, pharmacokinetic and pharmacodynamic properties of statins: an update. Fundam Clin Pharmacol 2005; 19: 117-125.
- 24. Kita K, Saito S, Morioka CY, Watanabe A. Growth inhibition of human pancreatic cancer cell lines by anti-sense oligonucleotides specific to mutated K-ras genes. Int J Cancer 1999; 80: 553-558.
- 25. McKeage MJ, Kelland LR, Boxall FE, et al. Schedule dependency of orally administered bisacetatoammine-dichlorocyclohexylamine-platinum (IV) (JM216) in vivo. Cane Res 1994; 54: 4118-4122.
- 26. Muller C, Bockhorn AG, Klusmeier S, et al. Lovastatin inhibits proliferation of pancreatic cancer cell lines with mutant as well as with wild-type K-ras oncogene but has different effects on protein phosphorylation and induction of apoptosis. Int J Oncol 1998; 12: 717-723.
- 27. Ura H, Obara T, Nishino N, et al. Cytotoxicity of simvastatin to pancreatic adenocarcinoma cells containing mutant ras gene. Jpn J Cancer Res 1994; 85: 633-638.
- 28. Bocci G, Fioravanti A, Orlandi P, et al. Fluvastatin synergistically enhances the antiproliferative effect of gemcitabine in human pancreatic cancer MiaPaCa-2 cells. Br J Cancer 2005; 93: 319-330.
- 29. Yao CJ, Lai GM. Chan CF, et al. Dramatic synergistic anticancer effect of clinically achievable doses of lovastatin and troglitazone. Int J Cancer 2006; 118: 773-779.
- 30. Chong PH, Seeger JD, Franklin C. Clinically relevant differences between the statins: implications for therapeutic selection. Am J Med2001; 111: 390-400.
- 31. van Vliet AK, van Thiel GC, Huisman RH, et al. Different effects of 3-hydroxyl-3-methylglut-aryl-coenzyme A reductase inhibitors on sterol synthesis in various human cell types. Biochim Biophys Acta 1995; 1254: 105-111.
- 32. Shitara Y, Sugiyama Y. Pharma-cokinetic andpharmacodynamic alterations of 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase inhibitors: Drug-drug interactions andinterindividual differences in transporter and metabolic enzyme functions. Pharmacol Ther 2006; 112:71-105.
- 33. Buemi M, Allegra A, Senátore M, et al. Pro-apoptotic effect of fluvastatin on human smooth muscle cells. Eur J Pharmacol 1999; 370: 201-203.
- 34. Guijarro C, Blanco-Colio LM, Ortego M, et al. 3-Hydroxy-3-methylglutaryl coenzyme a reductase andisoprenylation inhibitors induce apoptosis of vascular smooth muscle cells in culture. Circ Res 1998; 83: 490-500.
- 35. Yamamoto A, Ichihara K, Hoshi K. Antioxidative effect of fluvastatin, an inhibitor of 3-hydroxy-3-methylglutaryl coenzyme A reductase, on peroxidation of phospholipidliposomes. J Pharmacy Pharmacol 2001; 53: 227-232.
- 36. Mueck AO, Seeger H, Wallwiener D. Effect of statins combined with estradiol on the proliferation of human receptor-positive and receptor-negative breast cancer cells. Menopause 2003; 10: 332-336.
- 37. Khurana V, Sheth A, Caldito G, Barkin JS. Statins reduce the risk of pancreatic cancer in humans: a case-control study of half a million veterans. Pancreas 2007; 34: 260-265.
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users