Polymorphisms in interleukin-1 gene cluster are associated with increased risk of alcoholic liver cirrhosis
Jan Petrášek Orcid.org , Soňa Režnáková1, Jaroslav Hubáček Orcid.org , Jan Šperl Orcid.org 2, Pavel Trunečka3, Julius Špičák Orcid.org 2, Milan Jirsa Orcid.org 4
+ Affiliation
Summary
SUMMARY
Petrášek J, Režnáková S, Hubáček J, Šperl J, Trunečka P, Špičák J, Jirsa M. Polymorphisms in interleukin-1 gene cluster are associatedwith increased risk of alcoholic liver cirrhosis
The aim of the study: Tumor necrosis factor alpha (TNF-ct) and interleukin 1-beta (IL-1(3) are important pro-inflammatory cytokines. Promoter polymorphisms TNF-A -863C/A, TNF-A -238G/A, haplotype [-511C; -31T] of the IL-1B promoter and penta-allelic 86-bp tandem repeat in intron 2 of IL-1 receptor antagonist (IL-1RN) increase expression of TNF-A and IL-1B, respectively. We tested whether these polymorphisms are associated with susceptibility to alcoholic liver cirrhosis (ALC).
Material and methods: Allelic frequencies of the polymorphisms were determined in 100 heavy drinkers with alcoholic cirrhosis and 180 non-abstaining age and sex matched healthy controls.
Results: No association with ALC was found for individual alleles TNF-A -863A, TNF-A -238A, IL1-RN*2 and haplotype (-511C; -31T) of the IL-1B promoter. However, homozygotes for the IL-1RN*2 allele with simultaneous presence oiIL-lB -31T al-lele had increased risk of ALC (odds ratio 8,3, 95% confidence interval 1,7-40,7). Conclusion: Our observation is in line with previous studies indicating that synergistic action of the IL-1B -3IT and IL-1RN*2 alleles is responsible for IL-1β high secretory phenotype. Such phenotype attracts polymorphonuclear lymphocytes to the liver, promotes fibrosis and explains the molecular background of the increased risk of progression of ALC in homozygotes for the IL-1RN*2 allele that are at least heterozygous for the IL-1B -3IT allele.
Key words: alcoholic liver cirrhosis - genetic polymorphism - interleukin-1 beta - neutrophilic gran-ulocyte - tumor necrosis factor-alpha.
ÚVOD
Alkoholická jaterní cirhóza (ALC) představuje více než 50% chronických onemocnění jater a v rozvinutých zemích je příčinou kolem 50 000 úmrtí ročně (1,2) . Studie na dvojčatech prokázaly, že individuální citlivost jater vůči alkoholu je dědičně podmíněna (3,4) , avšak genetické faktory ovlivňující riziko rozvoje jaterní cirhózy u alkoholiků nebyly identifikovány (2) .
V patogenezi ALC se kromě přímého působení etanolu uplatňuje i zánětlivá odpověď jater na bakteriální endotoxiny (lipopolysacharid, LPS). Etanol zvyšuje střevní permeabilitu pro LPS, který je transportován do jater, kde aktivuje Kupfferovy buňky (KC) (5) produkující tumor necrosis factor a (TNF-a) a interleukin 1β (IL-1β). Tumor necrosis factor a indukuje cestou TNF-a receptoru I. typu apoptózu hepatocytů u akutní alkoholické steato-hepatitidy a jeho koncentrace v krvi koreluje s krátkodobou mortalitou (6,7) . Interleukin 1β, jehož receptor intracelulární apoptotickou doménu nemá, je hlavním cytokinen iniciujícím infiltraci jater polymorfonukleárními leukocyty (PMN), které převažují v zánětlivém infiltrátu alkoholické nemoci jater (8,9) . Kontinuální expozice jaterního parenchymu lyzosomálním enzymům z rozpadlých granulocytů vede ke chronickému poškozování hepatocytů, aktivaci hvězdicových buněk a k rozvoji fibrózy (10,11) . Oba cytokiny přispívají k aktivaci jaterní fibrogeneze také tím, že inhibují matrixovou metaloproteinázu-9 a aktivují tkáňový inhibitor matrixových metaloproteináz I. typu (12) .
V genech pro TNF-a a IL-1β byly popsány polymorfismy ovlivňující jejich expresi in vitro. Jednonukleotidové polymorfismy (SNP) v pozici -863 a -238 promotoru TNF-A nezávisle zvyšují transkripci tohoto genu (13,14) . Genový cluster interleukinu 1 na chromosomu 2 obsahuje geny IL-1B a IL1-RN kódující IL-1β a receptorového antagonistu IL- Ira (15) . Haplotyp [-511C; -31T] promotoru IL-1B zvyšuje transkripci genu (16) . Druhý intron IL1-RN obsahuje variabilní počet tandemových repetic (VNTR) délky 86-bp. Alela 2 (IL-1RN*2) zvyšuje koncentraci IL-1β in vitro (17) .
Nosiči alely TNF-A -238A s hepatitidou C mají vyšší riziko rozvoje cirhózy (18) , avšak výsledky studií asociace této alely s ALC jsou kontroverzní (19,20) . Alela IL-1B -31T zvyšuje riziko karcinomu žaludku a u pacientů s hepatitidou C zvyšuje riziko hepatocelulárního karcinomu (21,22) . V souvislosti s ALC dosud nebyla studována. Alela IL-1B -511C zvyšuje riziko ALC (23) v asijské populaci. Asociace alely TNF-A -863A s ALC nebyla studována.
Cílem studie bylo ověřit hypotézu, zda výše uvedené polymorfismy v klíčových genech endotoxinové dráhy patogeneze ALC ovlivní riziko rozvoje ALC.
MATERIÁL A METODIKA
Pacienti a kontroly
Do studie jsme zařadili 100 pacientů kavkazského původu s ALC postupně hospitalizovaných na Klinice hepatogastroenterologie IKEM od března 2004 do prosince 2005. Práh konzumace etanolu byl 40 gramů denně pro ženy a 60 gramů denně pro muže po dobu 10 let. Kontrolní skupinu tvořilo 180 neabstinujících dobrovolníků bez jaterního onemocnění, kteří dříve participovali v epidemiologické studii MONICA (24) . Studie byla schválena etickou komisí a všichni pacienti podepsali informovaný souhlas se zařazením do studie.
Jaterní cirhóza byla diagnostikována na základě klinického vyšetření, které zahrnovalo nález fyzikální, laboratorní, sonografický a nález při gastroskopii. Diagnóza byla stanovena na základě laboratorního průkazu jaterní dysfunkce v kombinaci s klinickými, sonografickými a gastroskopickými známkami portální hypertenze (tj. ascites, ikterus, jaterní encefalopatie, jícnové varixy či portální gastropatie). U 11 pacientů byla diagnóza stanovena teprve na základě výsledku necílené jaterní biopsie, která u všech 11 nemocných prokázala cirhózu s polymorfonukleárním zánětlivým infiltrátem a Malloryho hyalinem. Pacienti s nádorem jater nebo s pozitivitou markerů hepatitidy B nebo C, antinukleárních nebo antimitochondriálních protilátek nebyli do studie zařazeni.
Medián věku pacientů s ALC (N = 100) byl 52,6 (26-72) let, 72 pacienti byli muži. Medián denního příjmu etanolu byl 100 (interkvartilový rozptyl 75-174) gramů. Medián věku kontrol (N = 180) byl 47,9 (24-73) let, 142 kontroly byli muži, medián denní konzumace etanolu činil 21,5 (interkvartilový rozptyl, 14-40) gramů. Mezi skupinami nebyly kromě onemocnění jater klinicky významné rozdíly.
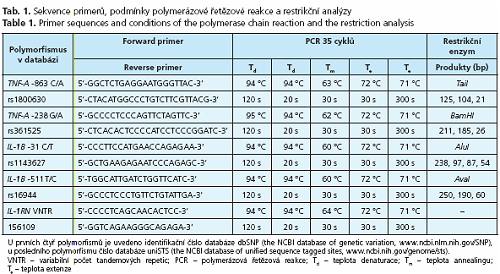
Genotypizace
Genotypizace byla provedena metodou polymerázové řetězové reakce - polymorfismů délky restrikčních fragmentů (PCR-RFLP) (tab. 1). Polymorfismus IL-1RN VNTR byl genotypován metodou PCR-FLR Produkty PCR byly separovány polyakrylamidovou elektroforézou a barveny etidiumbromidem. Restrikční enzymy byly zakoupeny od firmy Fermentas UAB (Vilnius, Litva).
Statistické metody
Velikost souboru byla stanovena výpočtem síly testu při pravděpodobnosti chyby I. druhu 0,05 a chyby II. druhu 0,2, což umožňuje detekci zvýšení relativního rizika (odds ratio, OR) pro ALC více než 1,55 při frekvenci rizikové alely přesahující 0,413 nebo detekci OR > 3 při frekvenci rizikové alely přesahující 0,024. Nezávislá distribuce alel v souboru byla ověřena testem Hardy-Weinbergovy rovnováhy (HWE). Fáze alel v haplotypech byla určena algoritmem maximálně věrohodného odhadu (expectation-maximization, EM). Vazebné dysequilibrium (linkage disequilibrium, LD) mezi polymorfismy na stejném chromosomu (syntenní polymorfismy) bylo charakterizováno koeficienty D' a r2, které nabývají hodnot intervalu <0,1&glt; a určují sílu LD. Hodnota D' = 1 udává kompletní LD při absenci jednoho haplotypu a hodnota r2 = 1 udává absolutní LD při absenci dvou haplotypu ze čtyř možných v případě dialelických SNR Asociační analýza polymorfismů byla provedena x2 testem. Asociace haplotypu s ALC byla analyzována logistickou regresí v programu SPSS, verze 14.0 (SPSS Inc., Chicago, IL, USA). Hladina signifikance pro asociaci byla P < 0,05. Populační atributabilní riziko (PAR) polymorfismů asociovaných s ALC bylo vypočteno dle rovnice:
PAR(%) =((fp - fk) / fp) x 100
kde je PAR populační atributabilní riziko, fp frekvence polymorfismu ve skupině pacientů a fk frekvence polymorfismu ve skupině kontrol.
VÝSLEDKY
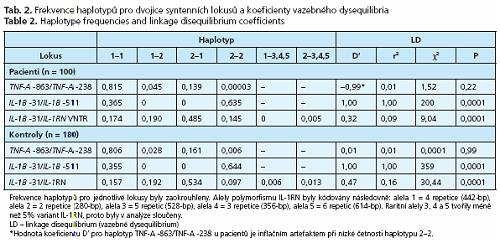
Alely pro jednotlivé lokusy v kontrolní populaci byly v HWE. Lokus TNF-A -863 jako jediný vybočoval z rovnováhy v důsledku nadměrného počtu homozygotů při nízké frekvenci rizikové alely -863A a z asociační analýzy musel být vyřazen. LD mezi lokusy IL-1B -511a IL-1B -31 bylo absolutní (D' = 1, r2 = 1) s výlučnou přítomností haplotypů T-C nebo C-T (tab. 2). Mezi lokusy IL-1B -31 a IL-1RN bylo LD slabé (D' < 0,5). Alely v lokusech TNF-A -863 a TNF-A -238 segregovaly nezávisle.
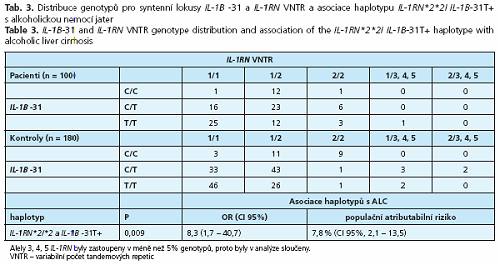
Žádná z alel TNF-A -863A, TNF-A -238A, IL-1B -511C, IL-1B -31T aILl-RN *2 nebyla samostatně asociována s ALC. Haplotyp zahrnující homozygotní stav pro alelu IL-1RN*2 (IL-1RN*2*2) a současně nosičství alespoň jedné alely IL-1B -31T (IL-1B -31T+), zastoupený u 9 % pacientů a u 1 % kontrol, byl asociován s vyšším rizikem ALC (P = 0,009) (tab. 3). Populační atributabilní riziko (PAR) haplotypů IL-1RN *2*2I IL-1B -31T+ určující, do jaké míry determinuje haplotyp ve studované populaci fenotyp, bylo 7,8 %.
DISKUZE
Polymorfismus IL-1B -31C/T se nachází v TATA boxu promotoru. Záměna cytosinu za thymin zvyšuje transkripční aktivitu genu in vitro pětkrát (16) . Lokus IL-1B -31 kosegreguje s lokusem -511 z více než 98% (98,5% El Omar et al. (16) , 100% naše data a databáze HapMap). Jelikož ke kosegregaci dochází ve 100% i v japonské populaci (databáze Hap-Map), lze asociaci mezi rizikovou alelou IL-1B -511 a ALC popsanou ve studii Takamatsu et al. (23) vysvětlit kosegregaci s funkčně relevantní alelou IL-1B -3 IT. V rozporu s výsledkem této studie jsme v našem souboru asociaci alely IL-1B -511C resp. IL-1B -31T s ALC nenalezli. Vysvětlení spočívá v tom, že hodnota PAR pro alelu IL-1 -511C ve studii Takamatsu et al. (23) pro polygenní chorobu vyšla neobvykle vysoká (vyšší než 32%), což je dáno výběrem kontrolní skupiny zdravých dobrovolníků s prokázaným abúzem alkoholu. Při srovnání frekvence rizikové alely IL-1B -511C u nemocných s ALD a v reprezentativním vzorku japonské populace nebyla asociace potvrzena.
Lokus IL-1B -31 je v LD i s alelou IL-1RN*2, u které Santtila et al.(17) prokázal, že zvyšuje produkci IL-1β in vitro, přičemž alela IL-1RN*2 zvyšuje produkci IL-1β více než alela IL-1B -31T Přítomnost LD s IL-1B -31 dokazuje paralelně se studií (25) podíl obou lokusů na sekreci IL-1β. Nízká síla LD (tj. neúplná kosegregace obou lokusů) umožňuje aditivitu vlivu alel na sekreci IL-1β.
Obratem ve studiích genového clusteru IL-1 byla práce El Omar et al. (16) , který zjistil asociaci alel IL-1B -31T a IL-1RN*2 s karcinomem žaludku. Riziko rozvoje onemocnění zvýšila každá alela samostatně, významněji však v haplotypů IL-1RN*2*2I IL-1B -31T+. Haplotypizační analýza našeho souboru logicky navazující na citovanou studii El Omara et al. ukázala, že zmíněný haplotyp se podílí i na dědičné dispozici k rozvoji ALC.
Asociaci alely TNF-A -238A s ALC jsme v naší studii neprokázali. Výsledek je v souladu s negativním nálezem Ladero et al.(20), avšak v rozporu se studiemi Grove et al. (19) a Pastor et al. (26) , které asociaci prokázaly. K pozitivní asociaci popsané v posledně jmenovaných studiích zřejmě významnou měrou přispěl nedostatečný počet pacientů (27) .
Výsledky naší studie ukazují na pravděpodobnou úlohu IL-1β v rozvoji alkoholické cirhózy jater, v jejíž patogenezi hraje významnou úlohu chronická infiltrace polymorfonukleárními lymfocyty vyvolaná působením IL-1β (9) . Trvá-li tato infiltrace léta a je-li doprovázena kontinuálním rozpadem velkého množství granulocytů, přispívá k chronickému postižení jater i expozice jaterního parenchymu lyzosomálním enzymům z rozpadlých granulocytů (10,11) . Tento mechanizmus je patrně odlišný od mechanizmu akutní alkoholické hepatitidy kde hraje klíčovou úlohu apoptóza vyvolaná TNF-ct, na které se IL-1β podstatně nepodílí.
Význam genových polymorfismů v predispozici k ALC je ovlivněn nejen funkcí, ale i frekvencí. Zatímco frekvence rizikových alel IL-1B -31T a IL-1RN*2 činí 0,6 a 0,2, byla často studovaná ale-la TNF-A -238A s frekvencí 0,03 z genofondu téměř eliminována. Přes prokázaný funkční význam polymorfismů TNF-A -238G/A in vitro se v predispozici k ALC více uplatní podstatně častější rizikový haplotyp v genovém clusteru interleukinu 1, zatímco ovlivnění rizika ALC alelou TNF-A -238A nelze v populačních studiích běžného rozsahu dokázat.
ZÁVĚR
Naše výsledky prokazují osminásobné zvýšené rizika rozvoje ALC u homozygotů pro alelu IL-1RN*2, kteří jsou alespoň heterozygoty pro alelu IL-1B -31T Haplotyp IL-1RN*2*2IIL-1B -31T+ představuje 7,8 % dědičné dispozice k rozvoji ALC. Synergický účinek alel IL-1B -3 IT a IL-1RN*2 zvyšuje produkci IL-1β, což potencuje zánětlivou aktivitu a progresi fibrózy v játrech a vysvětluje biologickou podstatu zvýšeného rizika ALC u nosičů tohoto haplotypu.
Literatura
- 1. Corrao G, et al. Trends of liver cirrhosis mortality in Europe, 1970-1989: ageperiodcohort analysis and changing alcohol consumption. Int J Epidemiol 1997; 26: 100-109.
- 2. Stickel F, Osterreicher CH. The role of genetic polymorphisms in alcoholic liver disease. Alcohol Alcohol 2006; 41: 209-224.
- 3. Hrubec Z, Omenn GS. Evidence of genetic predisposition to alcoholic cirrhosis and psychosis: twin concordances for alcoholism and its biological end points by zygosity among male veterans. Alcohol Clin Exp Res 1981; 5: 207-215.
- 4. Reed T, et al. Genetic predisposition to organspecific endpoints of alcoholism. Alcohol Clin Exp Res 1996; 20: 1528-1533.
- 5. McClain CJ, et al. Cytokines in alcoholic liver disease. Semin Liver Dis 1999; 19: 205-219.
- 6. Natori S, et al. Hepatocyte apoptosis is a pathologic feature of human alcoholic hepatitis. J Hepatol 2001; 34: 248-253.
- 7. Felver ME, et al. Plasma tumor necrosis factor alpha predicts decreased long-term survival in severe alcoholic hepatitis. Alcohol Clin Exp Res 1990; 14: 255-259.
- 8. Kanzler S, Galle PR. Apoptosis and the liver. Semin Cancer Biol 2000; 10: 173-184.
- 9. Bautista AP. Neutrophilic infiltration in alcoholic hepatitis. Alcohol 2002; 27: 17-21.
- 10. Sauer A, et al. Endotoxin-induciblegranulocyte-mediated hepatocytotoxicity requires adhesion and serine protease release. J Leukoc Biol 1996; 60: 633-643.
- 11. Colombat M, et al. Portal lymphocytic infiltrate in alcoholic liver disease. Hum Pathol 2002; 33: 1170-1174.
- 12. Roderfeld M, et al. Cytokine blockade inhibits hepatic tissue inhibitor of metalloproteinase-1 expression and up-regulates matrix metalloproteinase-9 in toxic liver injury. Liver Int 2006; 26: 579-586.
- 13. Udalova IA, et al. Functional consequences of a polymorphism affecting NF-kappaB p50-p50 binding to the TNF promoter region. Mol Cell Biol 2000; 20: 9113-9119.
- 14. Bayley JP, et al. Functional analysis of linker-scan mutants spanning the -376, -308, -244, and -238 polymorphic sites of the TNF-alpha promoter. Cytokine 2001; 14: 316-323.
- 15. Dinarello CA. Biologic basis for interleukin-1 in disease. Blood 1996; 87: 2095-2147.
- 16. El Omar EM, et al. Interleukin-1 polymorphisms associated with increased risk of gastric cancer. Nature 2000; 404: 398-402.
- 17. Santtila S, Savinainen K, Hurme M. Presence of the IL-1RA allele 2 (IL1RN*2) is associated with enhanced IL-lbeta production in vitro. Scand J Immunol 1998; 47: 195-198.
- 18. Yee LJ, et al. Tumor necrosis factor gene polymorphisms in patients with cirrhosis from chronic hepatitis C virus infection. Genes Immun 2000; 1: 386-390.
- 19. Grove J, et al. Association of a tumor necrosis factor promoter polymorphism with susceptibility to alcoholic steatohepatitis. Hepatology 1997; 26: 143-146.
- 20. Ladero JM, et al. Single nucleotide polymorphisms and micro-satellite alleles of tumor necrosis factor alpha and interleukin-10 genes and the risk of advanced chronic alcoholic liver disease. Liver 2002; 22: 245-251.
- 21. El Omar EM, et al. Increased risk of noncardia gastric cancer associated with proinflammatory cytokine gene polymorphisms. Gastroenterology 2003; 124: 1193-1201.
- 22. Wang Y, et al. Interleukin-lbeta gene polymorphisms associated with hepatocellular carcinoma in hepatitis C virus infection. Hepatology 2003; 37: 65-71.
- 23. Takamatsu M, et al. Genetic polymorphisms of interleukin-lbeta in association with the development of alcoholic liver disease in Japanese patients. Am J Gastroenterol 2000; 95: 1305-1311.
- 24. Multinational Monitoring of Trends and Determinants in Cardiovascular Diseases: „MONICA Project." Manual of operations, WHO/MNC 82.2.
- 25. Hirsch E, et al. Functions of interleukin 1 receptor antagonist in gene knockout and overproducing mice. Proc Natl Acad Sci USA 1996; 93: 11008-11013.
- 26. Pastor IJ, et al. -238 G>A polymorphism of tumor necrosis factor alpha gene (TNFA) is associated with alcoholic liver cirrhosis in alcoholic Spanish men. Alcohol Clin Exp Res 2005; 29: 1928-1931.
- 27. Wilhelmsen KC. Does tumor necrosis factor play a role in alcoholic steatohepatitis? The potential pitfalls of a case-controlled allelic association analysis. Hepatology 1997; 26: 232-233.
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users