Granullar cell tumour of the oesophagus – a case report and review
Ľudovít Lukáč Orcid.org 1, Pavol Janega Orcid.org 2, Ľuboš Žitňan Orcid.org 3, Peter Sabaka1
+ Affiliation
Summary
Granulárnobunkové tumory (GCT – granular cell tumour) sú v pažeráku veľmi zriedkavým nálezom. Jedná sa o prevažne benígne tumory, no približne 2–4 % GCT je malígnych. Zväčša sú malé, asymptomatické a sú identifikované len ako vedľajší nález pri endoskopickom vyšetrení z iných príčin. GCT nad 10 mm však môžu vyvolávať dysfágiu, bolesti na hrudníku, prípadne pyrózu. Popisujeme kazuistiku GCT u 49-ročného pacienta s cirhózou pečene, Barretovým pažerákom a dextrokardiou. Tumor bol nájdený pri endoskopickom skríningu pažerákových varixov. Endoskopicky sa prezentoval ako 8mm polipoidný útvar, žltkavej farby lokalizovaný asi 2 cm nad kardiou. Endosonograficky ako dobre ohraničený intramurálny oválny homogénny hypoechogénny útvar. Tkanivo na histologické vyšetrenie bolo získané biopsiou pri endoskopickom vyšetrení. Histologický obraz bol typický pre benígny GCT. Vzhľadom na vysoké riziko krvácania u pacienta nebola indikovaná endoskopická mukozálna resekcia a pacienta sme len endoskopicky kontrolovali.
Keywords
oesophagus, granular cell tumour, case reportÚvod
Granulárnobunkové tumory (GCT – granular cell tumour) pažeráka predstavujú veľmi zriedkavú formu pažerákových lézií. GCT, známe aj ako „Abrikossoffov tumor” alebo aj granulárnobunkový myoblastóm, sú typicky benígne tumory mäkkých tkanív, hoci 2–4 % resekovaných a histologizovaných GCT pažeráka je popisovaných ako malígne. Lokalizované sú zväčša v submukóze v distálnej tretine pažeráka [1–4]. Prvý krát boli opísané v roku 1920 v dutine ústnej, môžu sa však vyskytovať v ktoromkoľvek úseku gastrointestinálneho traktu [5,6]. Menšie tumory sú zväčša asymptomatické a sú zpravidla identifikované len ako vedlajší nález pri endoskopickom vyšetrení z inej príčiny. Väčšie GCT môžu byť príčinou dysfágie alebo spôsobovať iné menej špecifické symptómy ako je pyróza, bolesti na hrudníku alebo dyspepsia [5]. Endoskopicky ani endosonograficky sa GCT nedajú odlíšiť od iných benígnych submukóznych tumorov pažeráka a diagnózu spravidla určí až ich histologizácia [7–10]. Táto práca uvádza kazuistiku asymptomatického GCT u pacienta s Barretovým pažerákom a alkoholovou cirhózou pečene a prináša prehľad súčasných znalostí o tomto raritnom type tumoru pažeráka.
Popis prípadu
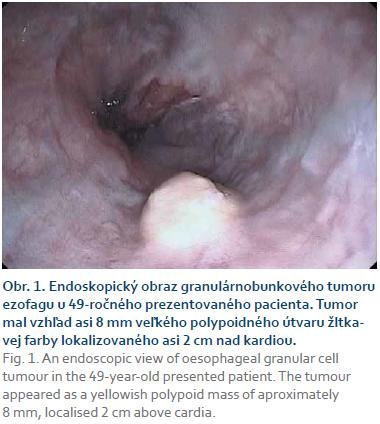
Pacient, 49 rokov, bol prijatý na I. internú kliniku LF UK a UN Bratislava pre novovzniknutý ikterus. Pacient bol diabetik 2. typu liečený perorálnymi antidiabetikami a mal dlhoročnú anamnézu abúzu alkoholu. Pacient nemal dysfágiu alebo iné symptómy poukazujúce na ochorenie pažeráka. Ikterus bol počas hospitalizácie pripísaný cirhóze pečene pri alkoholovej chorobe pečene a za účelom skríningu ezofageálnych varixov bola pacientovi realizovaná ezofago-gastro-duodenoskopia. Pri tomto vyšetrení bol nájdený obraz portálnej hypertenznej gastropatie, v pažeráku dva menšie varixy, Barretov pažerák a nakoniec prisadlý asi 8mm polypoidný útvar žltkavej farby lokalizovaný asi 2 cm nad kardiou (obr. 1).
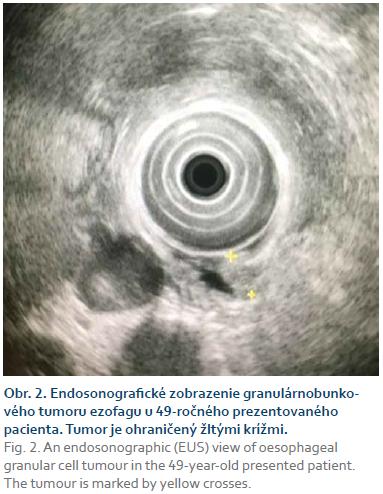
Z tohto útvaru bola realizovaná biop-sia bioptickými kliešťami. Pacientovi bolo následne urobené endosonografické vyšetrenie s nálezom dobre ohraničenej intramurálnej oválnej hypoechogénnej homogénnej lézie priemeru 8 mm. Endosonograficky sa lézia javila ako vyrastajúca z lamina muscularis propria (obr. 2). Na základe endosonografického nálezu bol predpokladaný leiomyóm.
CT hrudníka s kontrastom nenašlo známky šírenia tumoru mimo lumen pažeráka.
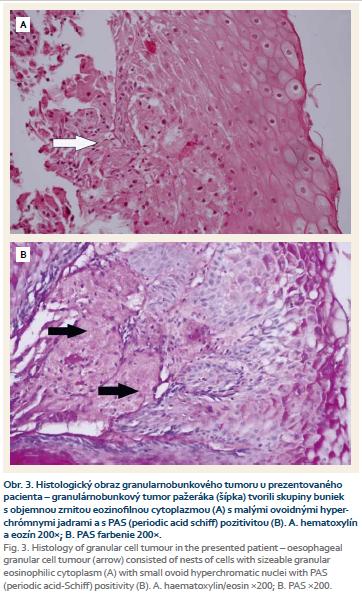
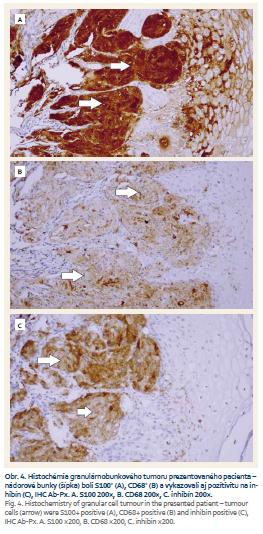
Biopsiou bolo získaných šesť útržkov sliznice a submukózneho tkaniva ezofagu, ktoré boli štandardne spracované a zafarbené hematoxylínom a eozínom. Realizované bolo taktiež špeciálne farbenie podľa Giemsa, PAS farbenie (Periodic acid-Schiff) a farbenie alkalickou modrou (obr. 3). Mikroskopicky boli vzorky tvorené miestami hyperplastickým nerohovatejúcim dlaždicovým epitelom, bez dysplastických zmien. V štyroch vzorkách sa v podslizničnom väzive nachádzali skupiny buniek s objemnou zrnitou eozinofilnou a PAS pozitívnou cytoplazmou s malými ovoidnými hyperchrómnymi jadrami bez nápadných jadierok a bez mitóz. V imunohistochemickom farbení bola nájdená pozitivita S100, CD68 a inhibínu. Takýto nález je typický pre GCT (obr. 4).
Vzhľadom na vysoké riziko krvácania pri varixoch pažeráka a cirhóze pečene s trombocytopéniou a hypokoagulačným stavom sme neuvažovali o endoskopickej resekcii a pacient je endoskopicky sledovaný. Po 6 mesiacoch nebola zaznamenaná veľkostná progresia tumoru.
Diskusia
GCT sú submukózne, zväčša benígne tumory mäkkých tkanív. Prvýkrát boli opísané v roku 1920 Abrikossoffom, ktorý ho identifikoval v resekáte tumorózneho útvaru jazyka [6]. Pravdepodobne vychádzajú zo Schwannových buniek nervových plexov v submukóze a podobne ako leiomyómy sa zaradujú medzi stromálne tumory [1,2]. Jedná sa o veľmi zriedkavé tumory. Tvoria asi len 0,02–0,03 % všetkých ročne identifikovaných tumorov. Postihujú najmä mäkké tkanivá hlavy a krku a len 3–11 % z nich sa vyskytuje v tráviacej trubici [9]. V pažeráku sa objavujú veľmi zriedkavo [1,2]. Ich záchyt v posledných desaťročiach vzrástol, najmä zvyšujúcou sa dostupnosťou endoskopie [3].
Naša kazuistika pojednáva o náleze GCT u 49-ročného u pacienta s Barretovým pažerákom a alkoholovou cirhózou pečene a dextrokardiou. Hoci sa GCT pažeráka dajú nájsť vo všetkých vekových skupinách, najčastejšie sa vyskytujú medzi 40. a 60. rokom života [8]. V prípade nášho pacienta bol GCT objavený ako vedľajší nález pri endoskopii realizovanej v rámci skríningu ezofageálnych varixov. V literature je väčšina nájdených GCT pažeráka taktiež popisovaných ako vedľajšie nálezy pri endoskopických vyšetreniach uskutočnených z iných príčin. Väčšina GCT je totiž relatívne malých (do 10 mm) a nespôsobujú žiadne subjektívne problémy. Väčšie GCT môžu sposobovať dysfágiu, prípadne aj iné príznaky, ako bolesti na hrudníku či pyrózu. Endoskopicky sa HCT u nami prezentovaného pacienta javil ako asi 8 mm polypoidný útvar žltkavej farby lokalizovaný asi 2 cm nad kardiou [5–9]. GCT sa zväčša vyskytujú v dolnej tretine pažeráka. Len 15–20 % GCT bolo identifikovaných v hornej a strednej tretine pažeráka. Sú zväčša solitárne, no asi u 11 % pacientov sa objavuje aj viacero tumorov [5].
Endoskopicky nejavia GCT žiadne charakteristické črty. Nedajú sa preto odlíšiť od iných submukóznych tumorov, napr. leiomyómu, ktorý sa vyskytuje podstatne častejšie. Rovnako endosonografické vyšetrenie (EUS – endoscopic ultrasound) nedokáže tieto dva typy benígnych lézií pažeráka odlíšiť. Endosonograficky sa GCT javil u nášho pacienta ako dobre ohraničený intramurálny oválny homogénny hypoechogénny útvar. Pripomínal leiomyóm. Takýto nález je pre GCT obvyklý. Vzhľadom na absenciu charakteristických makroskopických a klinických čŕt diagnózu zväčša môžeme určiť až na základe biopsie [5–9]. Lu et al odporúčajú ako optimálnu metódu odberu materiálu na cytologické vyšetrenie aspiračnú biopsiu pod EUS kontrolou [8]. Materiál na histologické vyšetrenie je však možné získať aj bioptickými kliešťami počas endoskopie tak, ako to bolo v našom prípade [1–3]. Tumorové bunky boli v obraze svetelnej mikroskopie veľké, polygonálne, cytoplazma bola eozinofilná, granulárna a vykazovali pozitivitu v PAS farbení. Bunkové jadrá boli malé a ovoidného tvaru. Takýto obraz je pre GCT typický [7]. Imunohistochemické vyšetrenie u nášho pacienta preukázalo pozitivitu S100, inhibínu a CD68, ktoré sú typické pre tento pôvod nádoru [5].
Endosonograficky bol tumor dobre ohraničený, homogénny a nejavil žiadne známky šírenia do okolia. Rovnako CT hrudníka neodhalilo infiltráciu okolí alebo patologickú lymfadenopatiu. Nakoniec aj histologicky sa tumor u nášho pacienta javil ako benígny. GCT sú prevažne benígne tumory, no majú aj istý malígny potenciál. Celkom 2–4 % resekovaných GCT pažeráka je histologicky popisovaných ako malígne [5]. Tie sú zväčša väčšie ako 10 mm, vyznačujú sa vyšším počtom mitóz pri histologickom vyšetrení a rýchlo rastú. Malígne formy GCT sa správajú pomerne agresívne. Celkom 32–41 % malígnych GCT vykazuje lokálnu recidívu a v 63 % sú prítomné vzdialené metastázy [10]. Špeciálnou kategóriou je koexistencia benígneho GCT so squamocelulárnym karcinómom alebo adenokarcinómom pažeráka, ktoré boli v nám známej literatúre opísané v troch prípadoch. Vzťah GCT a squamocelulárneho karcinómu alebo adenokarcinómu pažeráka nie je zatiaľ podrobnejšie prebádaný [11–13].
Vzhľadom na vysoké riziko krvácania (ezofageálne varixy, hypokoagulačný stav, trombocytopénia), ako aj fakt, že tumor nesposoboval príznaky sme sa rozhodli tumor u pacienta len endoskopicky a endosonograficky sledovať. Po 6 mesiacoch sme nezaznamenali veľkostnú progresiu. Asymptomatické benígne GCT menšie ako 10 mm väčšina autorov odporúča len sledovať raz ročne endoskopicky alebo pomocou EUS [9–14]. Chirurgické riešenie benígnych symptomatických GCT je spojené s vysokým rizikom a predstavuje veľkú záťaž pre pacienta [15]. Preto v sú v súčasnosti preferované endoskopické metódy. Najčastejšie realizovaným zákrokom je endoskopická mukozálna resekcia, ktoré je relatívne bezpečná a zväčša umožňuje totálnu resekciu tumorového tkaniva [9–16].
Záver
GCT pažeráka sú zriedkavým nálezom pri endoskopickom vyšetrení pažeráka, či už sa jedná o vyšetrenie indikované z iných príčin alebo pre dysfágiu, ktorej môže byť tento typ tumoru zriedkavou príčinou. Endoskopický ani endosonografický nález nie je typický a definitívnu diagnózu môže priniesť len biopsia. Veľká väčšina týchto tumorov je benígnych, no 2–4 % GCT je malígnych. Preto je nevyhnutná ich hystologizácia a endosonografické vyšetrenie na posúdenie ohraničenia prípadne vylúčenia invázie do okolia. Malé GCT stačí sledovať, väčšie symptomatické GCT môžu byť bezpečne odstránené endoskopickou mukozálnou resekciou.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 24. 4. 2017
Přijato/Accepted: 11. 5. 2017
MUDr. Peter Sabaka, PhD.
I. interná klinika
LF UK a UN Bratislava
Nemocnica Staré Mesto
Mickiewiczova 13
813 69 Bratislava
Slovenská republika
petersabaka@gmail.com
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users
Literature
1. Lucendo AJ, De Rezende L, Martín-Plaza J et al. Esophageal granular cell tumor and eosinophilic esophagitis: two interesting entities identified in the same patient. Case Rep Gastroenterol 2008; 2 (1): 33–39. doi: 10.1159/000113220.
2. Choong CK, Meyers BF. Benign esophageal tumors: introduction, incidence, classification, and clinical features. Semin Thorac Cardiovasc Surg 2003; 15 (1): 3–8.
3. Voskuil JH, van Dijk MM, Wagenaar SS et al. Occurrence of esophageal granular cell tumors in The Netherlands between 1988 and 1994. Dig Dis Sci 2001; 46 (8): 1610–1614.
4. Loo CK, Santos LD, Killingsworth MC. Malignant oesophageal granular cell tumour: a case report. Pathology 2004; 36 (5): 506–508.
5. Wang HQ, Liu AJ. Esophageal granular cell tumors: case report and literature review. World J Gastrointest Oncol 2015; 7 (8): 123–127. doi: 10.4251/wjgo.v7.i8.123.
6. Abrikossoff A. Über Myome ausgehend von der quergestreiften Willkürlichen muskulatur. Virchows Arch Pathol Anat 1926; 206: 215–233.
7. Orlowska J, Pachlewski J, Gugulski A et al. A conservative approach to granular cell tumors of the esophagus: four case reports and literature review. Am J Gastroenterol 1993; 88 (2): 311–315.
8. Lu W, Xu MD, Zhou PH et al. Endoscopic submucosal dissection of esophageal granular cell tumor. World J Surg Oncol 2014; 12: 221. doi: 10.1186/1477-7819-12-221.
9. Shikuwa S, Matsunaga K, Osabe M et al. Esophageal granular cell tumor treated by endoscopic mucosal resection using a ligating device. Gastrointest Endosc 1998, 47 (6): 529–532.
10. Alkhoury F, Martin JT, Fiedler P et al. Esophageal granular cell tumor colliding with intramucosal adenocarcinoma: a case report. Cases J 2009; 2: 8093. doi: 10.4076/1757-1626-2-8093.
11. Szumilo J, Dabrowski A, Skomra D et al. Coexistence of esophageal granular cell tumor and squamous cell carcinoma: a case report. Dis Esophagus 2002; 15 (1): 88–92.
12. Perego P, Bovo G, Brenna A et al. Association of a granular-cell tumor with an epidermoid carcinoma of the esophagus. Pathologica 1995; 87 (5): 551–553.
13. Sakamoto Y, Inamori M, Iida H et al. Esophageal granular cell tumor treated by endoscopic mucosal resection. Digestion 2009; 80 (4): 258–259. doi: 10.1159/000 236031.
14. Thumallapally N, Ibrahim U, Kesavan M et al. Esophageal granular cell tumor: a case report and review of literature. Cureus 2016; 8 (9): e782.
15. Battaglia G, Rampado S, Bocus P et al. Single-band mucosectomy for granular cell tumor of the esophagus: safe and easy technique. Surg Endosc 2006; 20 (8): 1296–1298.