Detection of somatic mutations of K-ras oncogene and allelic losses on chromosome 9p and 18q increase diagnostic significance of EUS-navigated fine needle biopsy in patients with focal pancreatic mass
Cyril Šálek Orcid.org , Miroslav Zavoral Orcid.org 1, Vladimír Nosek Orcid.org 2, Lucie Mináriková Orcid.org , Lucie Kašperová, Miroslav Ryska3, Robin Strnad Orcid.org , Eva Traboulsi Orcid.org , Marek Minárik Orcid.org 4,1
+ Affiliation
Summary
SUMMARY
Šálek C, Zavoral M, Nosek V, Benešová L, Kašperová L, Ryska M, Strnad R, Traboulsi E, Minárik M. Detection of somatic mutations of K-ras oncogene and allelic losses on chromosome 9p and 18q increase diagnostic significance of EUS-navigated fine needle biopsy in patients with focal pancreatic mass
The aim of the study: Genetic methods enable more precious diagnosis of focal malignant pancreatic lesions. Many oncogenes and tumour supressor genes whose mutations are sequentially accumulated in the process of pancreatic oncogenesis were described. The aim of the study is to optimalise the genetic test using DNA extracted from material from EUS-navigated fine needle biopsy (FNA).
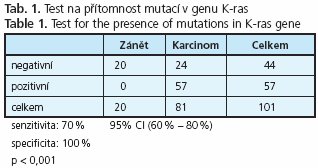
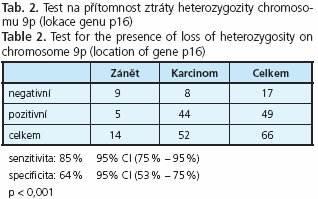
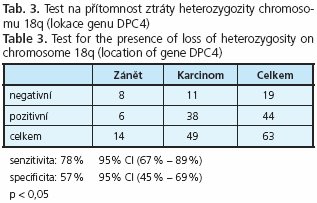
Material and methods: 81 patients suffering from pancreatic carcinoma and 20 patients with chronic pancreatitis were investigated by EUS-FNA. The quality of FNA material was assessed by on-site cytologist during the investigation. DNA was extracted directly from cytology smears after laser micro-dissection of suspected cells. Genetic analysis was directed to the mutations in K-ras and loss of heterozygosity on chromosome 9p and 18q where tumour supressor genes p16 nad DPC4 are located.
Results: The test for presence of activating K-ras mutations revealed sensitivity and specificity 70 % and 100 %. Detection of loss of heterozygosity revealed sensitivity and specificity 85 % and 64 % for locus 9p (p16), and 78 % and 57 % for locus 18q (DPC4) respectively. Combination of the tests for K-ras and allelic losses on locus 9p revealed sensitivity 92 % and specificity 64 %.
Conclusion: The highest sensitivity reveals genetic test which combines detection of point mutations in K-ras gene and loss of heterozygosity on locus 9p. This test is useful as a complementary test for malignancy in patients with focal pancreatic mass particularly when EUS-FNA was not able to distinguish between malignant and benign lesion (26 % of our material).
Key words: pancreatic carcinoma - EUS-navigated FNA - genetic testing - K-ras - p16 - DPC4 - mutation - loss of heterozygosity.
ÚVOD
Přes významný pokrok v diagnostických technologiích a v terapeutických metodách zůstává prognóza pacientů s karcinomem pankreatu za poslední půl století téměř nezměněna (1). Jeho incidence se prakticky rovná mortalitě, což je především důsledkem pozdní diagnózy onemocnění. Jelikož karcinom pankreatu je dnes považován za genetické onemocnění(2), jsou naděje na včasnou diagnózu i racionální volbu terapeutických modalit vkládány do genetického testování a výzkumu.
Časnou a nejčastěji popisovanou genetickou změnou v karcinomu pankreatu jsou aktivující mutace onkogenu K-ras. Byly popsány ve více než 80 % pokročilých karcinomů(3). V onkogenezi karcinomu pankreatu se v časové posloupnosti za mutacemi K-ras objevují inaktivující variace v řadě tumor supresorových genů: p16 (také znám jako CDKN2 nebo INK4A), lokalizovaném na chromosomu 9p; DPC4 (deleted in pancreatic carcinoma, popisovaný také jako SMAD4), přítomném na chromosomu 18q. Jsou inaktivovány v 90 % (p16) a 55 % (DPC4) karcinomech pankreatu, a představují tak potenciální molekulární markery malignity slinivky břišní(4,5). Mutace v tumor supresorovém genu p53 jsou popisovány v 50 % případů(6). Zvýšená exprese onkogenu Her-2/neu je důsledkem zvýšené transkripce, nikoliv genové amplifikace(7). Proto je mutační analýza metodou nevhodnou k posuzování funkčního stavu tohoto genu.
Výše popsané genové změny zásadním způsobem ovlivňují kontrolu buněčného cyklu. Jejich mutace umožňují defektní buněčné populaci nekontrolované se množit. Onkogen K-ras kóduje GTP-vazebný protein zodpovědný za signalizaci v MAP-kinázové kaskádě buněčné signalizace(8). Tumor supresorový gen p53 kóduje proteinový produkt, jenž reguluje transkripci dalších regulačních proteinů, jako například proteinu p21, klíčového inhibitoru komplexu cyklinu D s cyklin-dependentní kinázou 2 (CDK2) (9). Produkt dalšího tumor supresorového genu, p16, vyvažuje komplexy cyklinu D s CDK4 nebo CDK6, čímž reguluje progresi buněčného cyklu v kontrolním bodě buněčného cyklu na přechodu mezi postmitotickou a syntetickou fází (Gl) (10). Tumor supresorový gen DPC4 je členem rodiny SMAD proteinů, jejichž interakce podmiňují buněčný přenos signálu v kaskádě transformující růstový faktor beta (transforming growth factor - TGF(3)(11).
Moderní diagnostické přístupy spočívají na evaluaci morfologických změn parenchymu slinivky břišní v kombinaci s histologickým, popřípadě cytologickým vyšetřením materiálu získaného aspirací tenkou jehlou (fine needle aspiration - FNA). Tyto metody jsou do jisté míry subjektivní a značně závislé na zkušenostech vyšetřujícího subjektu. Byla publikována řada prací, které potvrdily zvýšenou validitu protokolů, které v diagnostice maligních ložiskových lézí pankreatu kombinují morfologické a genetické metody(12).
K-ras je nejčastěji studovaným genem v karcinomu pankreatu. Jeho prevalence se udává 90-95 %. Senzitivita genetických testů značně závisí na metodologii a materiálu, ze kterého je DNA izolována. Dosahuje 61-89 % v pankreatické š»ávě(13,14), 72 až 83 % v kartáčové cytologii z Wirsungova vývodu(15,16); 35 % v plazmě (17), 33 % ve žluči(18), 25 % v aspirátu z duodena(19). Testy na přítomnost mutací ve stolici dosáhly vyšší senzitivity než testy ze žluče, jsou však značně nespecifické(20). Uspokojivá specificita byla dosažena pouze v materiálu z kartáčové cytologie a pankreatické š»ávy (77-100 %).
Pro vysokou záchytnost K-ras mutací v pankreatické š»ávě byly v tomto materiálu studovány také variace v jiných genech. Senzitivita a specificita genetických testů v pankreatické š»ávě je 61-89 % a 33-96 % pro K-ras, 11-43 % a 70-100 % pro p16, 14-47 % a 88-100 % pro p53, 36-70 % a 39-100 % pro DPC4(21).
Dosud bylo publikováno jen malé množství prací studujících frekvenci genových variací v materiálu EUS-asistované FNA. Zatím nejrozsáhlejší je japonská studie publikovaná v roce 2005, která sledovala pouze přítomnost mutací K-ras a na skupině 62 pacientů dosáhla 74% senzitivity a 100% specificity(22).
Cílem studie je optimalizovat senzitivní genetický test využívající DNA extrahovanou z materiálu EUS-navigované tenkojehlové biopsie, jenž by byl využitelný v diagnostice maligních ložiskových lézí pankreatu, zejména tam, kde endoskopická ultrasonografie (EUS) a cytologie samy nejsou schopny rozlišit mezi benigní a maligní diagnózou.
MATERIÁL A METODIKA
Do studie bylo zařazeno 106 konsekutivních pacientů s ložiskovým procesem pankreatu, kteří od ledna 2003 do dubna 2006 podstoupili endosonograficky navigovanou tenkojehlovou biopsii. Definitivní diagnóza byla stanovena na základě histologického hodnocení chirurgického resekátu nebo dlouhodobého ambulantního sledování u neoperovaných pacientů. Po vyřazení pěti pacientů z důvodu zjištění jiné diagnózy nebo maligní duplicity čítal statistický soubor 101 osob (63 mužů a 38 žen, střední věk 60 ± 12 let, rozpětí 32 - 84 let), z nichž u 81 byl diagnostikován karcinom pankreatu a u 20 chronická pankreatitida. V 18 případech byly hodnoceny jak vzorky získané při EUS-asistované FNA, tak peroperační biopsie. Všichni pacienti podepsali informovaný souhlas s účastí ve studii a s genetickou analýzou jejich biologického materiálu.
EUS vyšetření bylo prováděno jedním zkušeným endosonografistou za použití radiálních a lineárních sond (Olympus GF-UM 20 a GF-UCT 140). Kvalita tenkojehlového aspirátu byla po obarvení rychlou hematoxylinovou-eosinovou řadou okamžitě ověřena on-site cytologem. Definitivní evaluaci cytologických nátěrů provedl zkušený patolog po obarvení zbylých nátěrů metodou dle Giemsy Tytéž nátěry byly následně podstoupeny ke genetické analýze.
DNA byla izolována z cytologických nátěrů po laserové mikrodisekci nádorově, popřípadě zánětlivě změněných duktálních epitelií. Mutační analýza byla zaměřena na kodony 12 a 13 v exonu 1 onkogenu K-ras. Příslušné úseky extrahované DNA byly amplifikovány metodou polymerázové řetězové reakce (polymerase chain reaction - PCR) za použití fluorescenčně značených primerů. Přítomnost mutací byla detekována velmi citlivou metodou separace heteroduplexů s využitím kapilární elektroforézy v cyklujícím teplotním gradientu(23).
Alelické delece byly monitorovány metodou detekce ztráty heterozygozity (loss of heterozygosity - LOH) sady mikrosatelitních markerů na krátkém raménku 9. chromosomu (lokace genu p16) a na dlouhém raménku 18. chromosomu (lokace genu DPC4). Pro vyhodnocení byl porovnáván signál amplifikátů DNA nádorové tkáně se signálem získaným z DNA leukocytů téhož pacienta.
Statistická analýza byla provedena metodou dvou- a vícerozměrných kontingenčních tabulek za použití softwaru BMDP PC90 a MedCalc. K výpočtu hodnot senzitivity a specificity byly zvoleny 95% intervaly spolehlivosti relativních četností.
VÝSLEDKY
Endosonografické vyšetření umožnilo jednoznačně hodnotit 89 % ložiskových lézí pankreatu. Bylo dosaženo 94% senzitivity a 77% specificity, 5 % případů bylo falešně negativních, 4 % falešně pozitivní. Ve zbylých 11 % případů nebyl endoskopista schopen na základě endosonografického obrazu diferencovat mezi maligním a benigním charakterem ložiska.
Hodnocení cytologických nátěrů získaných EUS-asistovanou FNA bylo podkladem pro stanovení cytopatologické diagnózy v 74 % případů. V této skupině dosáhlo 100% senzitivity i specificity. Zbylých 26 % vzorků však patolog hodnotil jako nekonkluzivní; nebyl tedy schopen rozlišit mezi karcinomem pankreatu a chronickou pankreatitidou.
Histologické hodnocení chirurgického resekátu vykazovalo 95% senzitivitu a 100% specificitu. Tři procenta resekátu byla pro karcinom pankreatu falešně negativní.
Aktivující mutace v onkogenu K-ras byly nalezeny v 57 karcinomech a v FNA žádné chronické pankreatitidy (tab. 1). Senzitivita testu dosáhla 70%, specificita 100 %. Dvacet čtyři (30 %) případů bylo falešně negativních.
Delece krátkého raménka 9. chromosomu v místě lokalizace genu p16 byly detekovány metodou ztrát heterozygozity (LOH). Bylo dosaženo senzitivity 85 % a specificity 64 % (tab. 2).
Pro detekci inaktivace tumor supresorového genu DPC4 byla zvolena metoda LOH se zaměřením na genový lokus 18q. Senzitivita metody dosáhla 78 %, specificita 57 % (tab. 3). Jeden pacient byl homozygotní pro všechny ze tří vybraných markerů pro sledování fenoménu LOH v oblasti 18q, tudíž nebyl touto metodou vyšetřitelný.
DISKUZE
Výsledky potvrdily ústřední postavení EUS v diagnostice, diferenciální diagnostice a eventuálně stagingu ložiskových lézí pankreatu(24). Senzitivita a specificita cytologického vyšetření FNA vzorků dosáhla 100 %. Tento fakt odráží vysokou efektivitu vyšetřovacího protokolu, kdy EUS-FNA je prováděna ve specializovaném centru s evaluací tenkojehlového aspirátu on-site a definitivním hodnocením patologem zkušeným v pankreatické cytodiagnostice.
Výsledky screeningu mutací v onkogenu K-ras detekovaných v materiálu FNA jsou srovnatelné s dříve publikovanými výsledky v pankreatické š»ávě(25,26). Studie potvrdila 100% specificitu detekce mutací K-ras pro karcinom pankreatu(22).
Sledování alelických ztrát na chromosomech 9p a 18q přineslo velmi slibné výsledky. Aplikace této metody na materiál FNA nebyl dosud v odborné literatuře publikován.
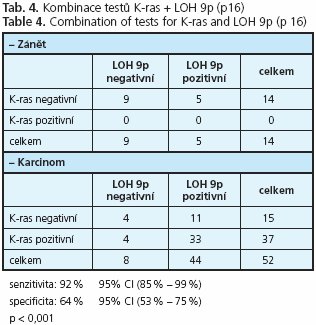
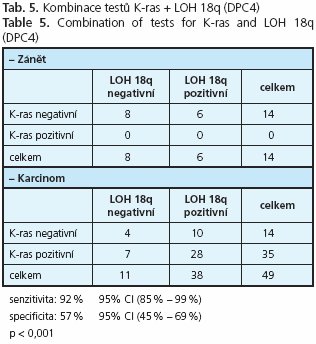
Z dosavadního stavu znalostí genetických procesů v karcinomu pankreatu je zřejmé, že k diagnostickým účelům není samostatně dostačující žádný ze známých genů a že je třeba typizovat vhodnou kombinaci genových testů, která by měla uspokojivou senzitivitu i specificitu(27). Ve studii byly nejlepší výsledky získány pro kombinaci K-ras a LOH 9p, kde senzitivita dosáhla 92 % a specificita 64 % (tab. 4). Těsně následovala kombinace K-ras a LOH 18q se senzitivitou 92% a specificitou 57% (tab. 5).
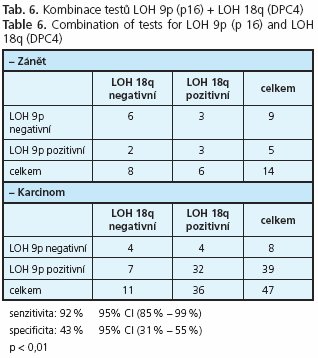
Kombinace LOH v obou sledovaných chromosomových lokusech dosáhla senzitivity 92 % a specificity 43 % (tab. 6).
Senzitivita této kombinace je srovnatelná s kombinací K-ras a jakéhokoliv ze dvou LOH lokusů, specificita je však výrazně nižší.
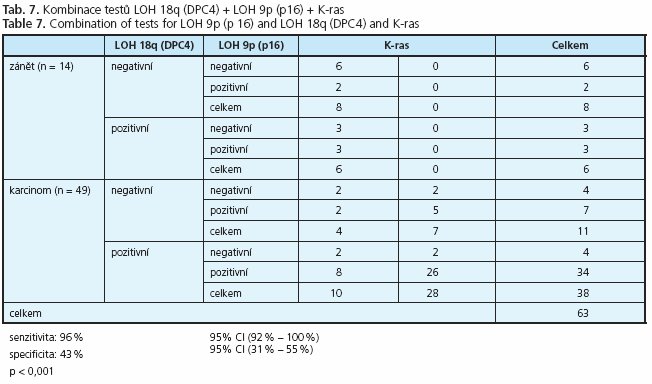
Trojkombinace mutační analýzy onkogenu K-ras s monitorací alelických ztrát v lokusech 9p a 18q vykazuje senzitivitu 96 % a specificitu 43 % (tab. 7). Rozšířením kombinačního testu K-ras + LOH 9p o monitoraci LOH 18q dojde k navýšení senzitivity z 92 % na 96 %, tento zisk je však významně kompromitován významným poklesem specificity z 64 % na 43 %.
U 18 pacientů byly hodnoceny genetické změny v materiálu FNA i peroperační biopsii. Míra detekce mutací K-ras v obou typech vzorků nevykazovala statisticky významný rozdíl (p < 0,001). Vyšší senzitivita pro testy LOH v materiálu FNA dosáhla hranice statistické významnosti (p < 0,001 pro 9p, p < 0,10 pro 18q). Tato skutečnost může být podmíněna faktem, že peroperační bioptické vzorky byly podstoupeny ke genetické analýze bez předchozího mikroskopického vyhodnocení, a skutečností, že DNA byla extrahována z celého tkáňového materiálu poskytnutého chirurgem bez výběru nádorových buněk, například metodou laserové mikrodisekce.
ZÁVĚR
Nejvyšší senzitivitu pro karcinom pankreatu v EUS-asistovaném FNA materiálu vykazuje genetický test kombinující detekci bodových mutací K-ras a ztrátu heterozygozity v lokusu 9p.
Uspokojivá senzitivita s relativně nižší specificitou činí výše uvedené kombinace genetických testů vhodné pro detekci malignit u pacientů s ložiskovým postižením pankreatu. Racionálně je lze doporučit tam, kde EUS-navigovaná FNA ložiska skončila nekonkluzivním závěrem. Zařazení genetických testů do vyšetřovacího algoritmu může selektovat adepty pro radikální resekční výkon, omezit procento neindikovaných resekcí, stejně jako opakovaných operací u pacientů, jimž byla původně chybně stanovena diagnóza fokálního zánětu. Lze předpokládat uplatnění výše popsaných genetických testů ve vyhledávání premaligních lézí a časného karcinomu pankreatu v populaci vysoce rizikových osob, zhodnocení jejich efektu v tomto procesu však vyžaduje další výzkum.
Detailní popis sledování všech genových markerů je obsahem separátní publikace: Šálek C, Benešová L, Zavoral M, Nosek V, Kašperová L, Ryska M, Strnad R, Traboulsi E, Minárik M. Evaluation of clinical relevance of examining K-ras, p16 and p53 mutations along with allelic losses at 9p and 18q in EUS-guided fine needle aspiration samples of patients with chronic pancreatitis and pancreatic cancer (v přípravě).
Projekt byl podpořen grantem č. 8027-3 IGA MZ ČR.
LITERATURA
- 1. Ries LAG, Eisner MP, Kosary CL, et al. SEER Cancer Statistics Review, 1973-1998. National Cancer Institute: Bethesda, 2001.
- 2. Hruban RH, Iacobuzio-Donahue C, Wilentz RE, et al. Molecular pathology of pancreatic cancer. Cancer J 2001; 7: 251-258.
- 3. Almoguera C, Shibata D, Forrester K, et al. Most human carcinomas of the exocrine pancreas conttain mutant c-K-ras genes. Cell 1988; 53: 549-554.
- 4. Schutte M, Hruban RH, Geradts J, et al. Abrogation of the Rb/p16 tumor-suppressive pathway in virtually all pancreatic carcinomas. Cancer Res 1997; 57: 3126-3130.
- 5. Halin SA, Schutte M, Hoque AT, et al. DPC4: a candidate tumor suppressor gene at human chromosome 18q21.1. Science 1996; 271: 350-353.
- 6. Moskaluk CA, Hruban RH, Kern SE. p16 and K-ras gene mutations in the intraductal precursors of human pancreatic adenocarcinoma. Cancer Res 1997; 57: 2140-2143.
- 7. Hermanová M, Lukáš Z, Nenutil R, et al. Amplification and overexpression of HER-2/neu in invasive ductal carcinomas of the pacreas and pancreatic intraepithelial neoplasms and the relationship to the expression of p21(WAFl/CIPl). Neoplasma 2004; 51: 77-83.
- 8. Malumbres M, Pellicer A. Ras pathways to cell cycle control and cell transformation. Front Biosci 1998;3:887-912.
- 9. Lané DP, Hollenstein M, Sidransky D, et al. P53 mutations in human cancers. Science 1991; 253: 49-53.
- 10. Caldas C, Halin SA, da Costa LT, et al. Frequent somatic mutations and homozygous deletions of the p16 (MTSI) gene in pancreatic adenocarcinoma. Nat Genet 1994; 8: 27-32.
- 11. Massague J, Wotton D. Transcriptional control by the TGF-beta/Smad signaling system. Embo J 2000; 19: 1745-1754.
- 12. Zheng M, Liu LX, Zhu AL, et al. K-ras gene mutation in the diagnosis of ultrasound guided fine-needle biopsy of pancreatic masses. World J Gastroenterol 2003; 9: 188-191.
- 13. Costentin L, Pages P, Bouisson M, et al. Frequent deletions of tumor suppressor genes in pure pancreatic juice from patients with tumoral or nontumoral pancreatic diseases. Pancreatology 2002; 2: 17-25.
- 14. Uehara H, Nakaizumi A, Tatsuta M, et al. Diagnosis of pancreatic cancer by detecting telomerase activity in pancreatic juice: comparison with K-ras mutations. Am J Gastroenterol 1999; 94: 2513-2518.
- 15. Zhou GX, Huang JF, Li ZS, et al. Detection of K-ras point mutations and telomerase activity during endoscopic retrograde cholangiopancreatography in diagnosis of pancreatic cancer. World J Gastroenterol 2004; 10: 1337-1340.
- 16. van Laethem JL, Vertongen P, Deviere J, et al. Detection of c-Ki-ras gene codon 12 mutations from pancreatic duet brushings in the diagnosis of pancreatic tumours. Gut 1995; 36: 781-787.
- 17. Uemura T, Hibi K, Kaneko T, et al. Detection of K-ras mutations in the plasma DNA of pancreatic cancer patients. J Gastroenterol 2004; 39: 56-60.
- 18. Trumper L, Menges M, Daus H, et al. Low sensitivity of the ki-ras polymerase chain reaction for diagnosing pancreatic cancer from pancreatic juice and bile: a multicenter prospective trial. J Clin Oncol 2002; 20: 4331-4337.
- 19. Wilentz RE, Chung CH, Sturm PD, et al. K-ras mutations in the duodenal fluid of patients with pancreatic carcinoma. Cancer 1998; 82: 96-103.
- 20. Caldas C, Hahn SA, Hruban RH, et al. Detection of K-ras mutations in the stool of patients with pancreatic adenocarcinoma and pancreatic ductal hyperplasia. Cancer Res 1994; 54: 3568-3573.
- 21. Greenhalf W, Vitone L, Neoptolemos JP. Novel molecular diagnostic strategies: Molecular diagnosis of pancreatic cancer in pancreatic juice. In: Gress TM, Neoptolemos JP, Lemoine NR, Real FX (eds.) Exocrine pancreas cancer. Solvay Pharmaceuticals 2005: 404-425.
- 22. Takahashi K, Yamao K, Okubo K, et al. Differential diagnosis of pancreatic cancer and focal pancreatitis by using EUS-guided FNA. Gastrointest Endosc 2005; 61: 76-79.
- 23. Minárik M, Mináriková L, Bjorheim J, et al. Cycling gradient capillary electrophoresis: a low-cost tool for high-through-put analysis of genetic variations. Electrophoresis 2003; 24: 1716-1722.
- 24. Gress FG, Hawes RH, Savides TJ, et al. Role of EUS in the pre-operative staging of pancreatic cancer: a large single-center experience. Gastrointest Endosc 1999; 50: 786-791.
- 25. Lu X, Xu T, Qian J, et al. Detecting K-ras and p53 gene mutation from stool and pancreatic juice for diagnosis of early pancreatic cancer. Chin Med J (Engl) 2002; 115: 1632-1636.
- 26. Wang Y, Yamaguchi Y, Watanabe H, et al. Detection of p53 gene mutations in the supernatant of pancreatic juice and plasma from patients with pancreatic carcinomas. Pancreas 2004; 28: 13-19.
- 27. Maitra A, Kern SE, Hruban RH. Molecular pathogenesis of pancreatic cancer. Best Pract Res Clin Gastroenterol 2006; 20: 211-226.
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users