Detection of bacterial translocation from the gut after liver transplantation - preliminary results
Jana Juránková Orcid.org , Veronika Příbramská Orcid.org , Jan Lata1, Pavel Sauer Orcid.org , Taťána Štosová Orcid.org , Pavel Studeník Orcid.org , Helena Skácelová Orcid.org , Dagmar Koukalová Orcid.org , Vladimír Mejzlík Orcid.org 2
+ Affiliation
Summary
SUMMARY
Juránková J, Příbramská V, Lata J, Sauer P, Štosová T, Studeník P, Mejzlík V, Skácelová H, Koukalová D. Detecting bacterial translocation from the gut after liver transplantation - preliminary results
The aim of the study. The patients after liver transplantation are at risk of infections caused by agents originating from the gastrointestinal tract. Due to impaired intestinal barrier functions, bacteria pass through the intestinal wall and enter the bloodstream. Bacteria may get to distant systems and cause infection. By investigation of the level of endotoxin, cultivation of gut microfiora and pathogenes from extraintestinal sides and comparison of their fenotype and genotype, we try to demonstrate translocation.
Material and methods. In the postoperative period we investigated 14 patients. There were cultivated the samples from stool, urine and larynx and the level of endotoxin was monitored. The strains were compared based on their phenotype and genotype.
Results. In 8 patients the translocation wasn't found. The endotoxin level was increased in 6 patients and phenotypically and genotypically identical strains were found in the gut and outside the intestine.
Conclusion. Monitoring of serum endotoxin levels may help to detect early bacterial translocation with an increased risk of infectious complications.
Key words: bacterial translocation, endotoxin level, liver transplantation.
ÚVOD
Nozokomiální infekce u pacientů s chronickým onemocněním, po chirurgickém zákroku, stejně jako v intenzivní péči jsou časté a velmi závažné, komplikující základní onemocnění a pooperační průběh. Často jsou endogenního původu, způsobené fakultativně patogenními bakteriemi, které vycházejí z trávicího traktu, v němž jsou součástí přirozené mikroflóry. Rovněž se však může jednat o kolonizující nemocniční kmeny, nesoucí různé mechanismy rezistence k antimikrobním přípravkům.
Právě u těžce nemocných pacientů, obvykle s dysfunkční střevní bariérou, jsou běžně popisovány nozokomiální nákazy v mimostřevních lokalitách způsobené gramnegativními agens. Kromě jejich druhově specifických faktorů virulence k rozvoji infekce a jejímu průběhu velkou měrou přispívá endotoxin, lipid obsažený v povrchové lipopo-lysacharidové vrstvě stěny všech gramnegativních bakterií. Vykazuje biologickou aktivitu, odvislou od jeho množství ve vnitřním prostředí člověka, projevující se zvýšenou teplotou až šokovým stavem. Z jeho rostoucí hladiny v krvi pacientů pak lze usuzovat na přítomnost gramnegativních bakterií v krevním řečišti ještě před rozvojem klinických příznaků infekce.
Cílem práce bylo monitorovat hladiny endotoxinu v krvi nemocných po transplantaci jater a geneticky porovnávat případné fenotypově shodné perianální izoláty s agens zachyceným z infekční leze, jako důkaz translokace střevních bakterií do krevního řečiště.
MATERIÁL A METODIKA
Soubor pacientů
Do studie bylo zařazeno 14 pacientů v pooperačním období po transplantaci jater, 8 mužů v průměrném věku 49 roků (29-64 roků) a 6 žen průměrného věku 55 roků (43-64 roků). U 8 pacientů se jednalo o toxonutritivní cirhózu, 2 pacienti byli léčeni pro cirhózu při primární sklerózující cholangoitidě, 2 pacienti pro cirhózu při non-alkoholické steatohepatitidě a 1 pacient pro cirhózu při autoimunní hepatitíde. Pacienti byli zařazeni po schválení studie etickou komisí FN Brno a po podpisu informovaného souhlasu.
U všech bylo průběžně (2., 4., 6., 8., 10., 14., 18, 21. pooperační den, výjimečně i další dny) sledováno zastoupení bakterií v přirozeně osídlených lokalitách, dále jejich přítomnost v moči a drénech z operačních ran. Současně byla vyšetřována i hladina endotoxinu v krvi. Při nálezu fenotypově shodných izolátů v perianální oblasti a infekční lézi, bylo provedeno porovnání jejich genomu pomocí pulzní gelové elektroforézy (PFGE).
Kultivační vyšetření
Klinický materiál, tj. stery z perianálních řas, výtěry z horních cest dýchacích, vzorky moče a sekrety z drénů operačních ran, byl kultivován standardním způsobem na krevním (Merck) a McConkeyho agaru (Oxoid) za aerobních podmínek při teplotě 37 °C po dobu 24 hodin. Perianální stery a sekrety z operačních ran byly dále inokulovány na VL agar (OXOID) a inkubovány v anaerobním boxu při teplotě 37 °C po dobu 48 hodin. Druhová identifikace izolátů probíhala podle výsledků jejich růstových a biochemických aktivit pomocí komerčních diagnostických souprav (ENTEROtest 24 Lachema, BBL Crystal Orion Diagnostica, ANA II Systém Re-mel). Současně byl stanoven i jejich antibiogram difúzni diskovou metodou. K průkazu produkce širokospektrých P-laktamáz (ESBL) byl použit Double Disk Synergy Test. Izoláty perianální a z infekční leze od téhož pacienta, které vykazovaly naprostou shodu ve fenotypových vlastnostech včetně anti-biogramu, byly dále porovnávány PFGE.
Hladina endotoxinu v séru
Hladina endotoxinu v séru byla stanovována pomocí Limulus testu LAL (Pyrochrome). Limulus amebocytový lyzát je vodný roztok extraktu krevních buněk (amébocytů) ostrorepa Limuluspolyphemus. V přítomnosti endotoxinu dochází k aktivaci faktorů obsažených v LAL a zahájení kaskádového proteolytického procesu, jehož výsledkem je štěpení bezbarvého substrátu přítomného v LAL. Proteolytické štěpení substrátu uvolňuje žlutý p-nitroanilin, který absorbuje světlo s vlnovou délkou 405 nm. Test se provádí přidáním Pyrochromu ke vzorku a následnou inkubací reakční směsi při 37 °C. Hodnoty se odečítají metodou konečného bodu (endpoint), kdy je měřeno množství uvolněného pNA po fixní době inkubace. Citlivost metody je 0,005 EU/1 ml (1) .
PFGE
Získané izoláty Escherichia coli, Klebsiella pneumoniae a Enterobacter cloacae byly charakterizovány molekulárně-biologickou typizací za použití PFGE. Celková DNA byla vyizolována podle následujícího postupu: Kolonie obou druhů byly vykultivovány na krevním agaru (Trios) a po pomnožení v Mueller-Hintonově bujónu (Trios) zcentrifugovány (3000 otáček po dobu 10 min). Následovalo opakované promytí v pufru (10 mM Tris/HCl, 10 mM EDTA, 10 mM EGTA, 1M NaCl, pH = 7,5) a zakoncentrování centrifugací (3000 otáček/10 min). Poté byly vzorky izolátů znovu naředěny v 10 ml stejného pufru na OD600= 0,3 a zcentrifugovány (3000 otáček po dobu 10 min). Získaná peleta byla resuspendována ve 100 μl výše jmenovaného pufru a bylo přidáno 100 μl rozpuštěné 2% low-melting-point agarózy (Bio-Rad). Po zatuhnutí ve formě byly vzniklé bločky přeneseny do 1 ml lyzačního roztoku (6mM Tris/HCl, 100 mM EDTA, 1M NaCl, 0,2% Na-deoxycholát, 0,5% laurylsarkosin, pH = 7,6 s 500 ug lysozymu) a inkubovány přes noc při 37 °C. Lyzační roztok byl vyměněn za 1 ml deproteinizačního roztoku (25 mM EDTA, 20 mM EGTA, 1% laurylsarkosin, pH = 9,0 a 500 μg proteinázy K) a bločky znovu inkubovány při 55 °C 12 hod. Po této inkubaci byly bločky opakovaně promyty v 10 ml promývacího roztoku (10 mM EDTA, pH = 8,0). Restrikční štěpení připravených agarózových bločků s imobilizovanou DNA bylo provedeno s použitím reštrikční endonukleázy Xbal (Sigma Aldrich) v 80 μl pufru. Bločky byly inkubovány při 37 °C po dobu 12 hod. PFGE byla provedena v 1,2% agarózovém gelu (Bio-Rad) s použitím 1x TBE pufru (Bio-Rad) na přístroji CHEF-DR II (Bio-Rad). Parametry reakce byly nastaveny na 24 hod. při 6 V/cm, pulzní časy 2-35 s, teplotu 14 °C. Po ukončení PFGE byl gel obarven v ethidium bromidu (1 (xg/ml; Sigma Aldrich) a zdokumentován při UV. Získané restrikční mapy jednotlivých kmenů byly porovnány programem GelCompare II(2) .
VÝSLEDKY
V pooperačním období po transplantaci jater (0.-21. den) bylo sledováno 14 nemocných.
U 8 z nich nedošlo ke zvýšení endotoxinu v séru, jeho hladiny se držely na nízké úrovni s průměrnou hodnotou 0,061 EU/1 ml. U 3 z těchto nemocných se nevyskytly mimostřevní infekční komplikace vůbec, u 5 byly zachyceny z perianálních stěrů gramnegativní bakterie a z mimostřevních lokalizací gramnegativní bakterie odlišných rodů a druhů a grampozitivní bakterie, nebyla tak prokázána souvislost mezi střevními a mimostřevními izoláty.
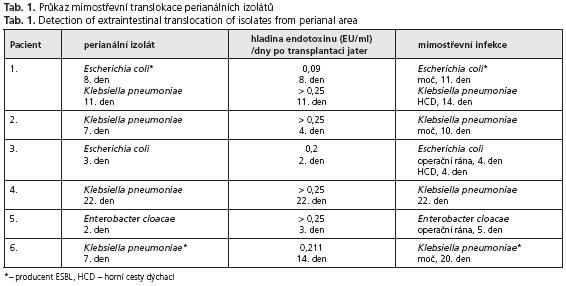
U 6 dalších pacientů byly zjištěny zvýšené hladiny endotoxinu, které předcházely nálezu mimostřevní infekce se zdrojem v gastrointestinálním traktu. Tento zdroj byl prokázán fenotypovou i genotypovou shodou vykultivovaných bakterií (tab. 1).
U 1. nemocného se v potransplantačním období nacházela fyziologická střevní mikroflóra, moč byla sterilní, výtěr z horních cest dýchacích rovněž obsahoval jen fyziologickou mikroflóru. Hladina endotoxinu v séru byla na nízké úrovni - 0,071 EU/1 ml. Osmý pooperační den se ve střevě objevila Escherichia coli s produkcí ESBL. Zároveň u pacienta došlo k vzestupu hladiny endotoxinu na hodnoty 0,09 EU/l ml. Jedenáctý den byl fenotypově stejný izolát zachycen i v moči. Metodou PFGE byl u obou izolátů Escherichia coli potvrzen shodný genotyp, jednalo se tedy o identický kmen. Ve stejné době byla ze stolice vypěstována Klebsiella pneumoniae, stejný kmen (fenotypová i genotypová shoda) byl po třech dnech nalezen i v horních cestách dýchacích. Hladina endotoxinu v této době zůstávala na vysokých hodnotách - více než 0,25 EU/1 ml.
Pacient 2 v potransplantačním období vykazoval fyziologické nálezy ve výtěrech perianálních i z horních cest dýchacích, moč byla sterilní. Hladiny endotoxinu v krvi se pohybovaly na nízkých hodnotách - 0,071 EU/1 ml, 0,051 EU/1 ml. Čtvrtý pooperační den došlo k vzestupu hladiny endotoxinu na hodnoty vyšší než 0,25 EU/1 ml a za 6 dní, tedy 10. den po operaci, se v moči objevila Klebsiella pneumoniae, identická s předcházejícím stejným izolátem ze stolice o tři dny dříve (opět fenotypová a genotypová shoda).
U 3. pacienta byla hned druhý pooperační den naměřena vysoká hladina endotoxinu (0,2 EU/1 ml), která další den stoupla na hodnotu vyšší než 0,25 EU/1 ml a zároveň byl nalezena Escherichia coli v perianálním steru. Následující den byl stejný izolát vykultivován z operační rány. Oba izoláty byly opět identické, jednalo se o jeden kmen, který navíc byl současně vypěstován i ze steru z horních cest dýchacích. K jeho translokaci ze střeva došlo pravděpodobně již v průběhu operace. Hladina endotoxinu v krvi se udržovala po celou dobu na uvedených vysokých hodnotách.
Nemocný 4 měl v potransplantačním období jen fyziologickou mikroflóru ve vzorcích z vyšetřovaných sliznic, nebyla zjištěna ani močová infekce. Až 22. pooperační den došlo k vzestupu do té doby nízké hladiny endotoxinu (0,092 EU/1 ml) až na hodnoty vyšší než 0,25 EU/1 ml séra a zároveň se objevila v moči Klebsiella pneumoniae, identická s izolátem ze stolice.
U 5. pacienta byl již od druhého pooperačního dne izolován ze stolice Enterobacter cloacae, moč byla sterilní a ve výtěru z horních cest dýchacích byla nalezena jen fyziologická mikroflóra. Hladina endotoxinu byla nízká, pohybovala se kolem 0,05 EU/1 ml. Třetí den došlo k jejímu vzestupu na hodnotu vyšší než 0,25 EU/1 ml, pátý den se objevil v sekretu z operační rány Enterobacter cloacae se stejným fenotypem a genotypem, jako byl zjištěn u dřívějšího izolátu ze stolice. Sedmý den po operaci již sekret z rány byl sterilní a současně hladina endotoxinu poklesla na hodnoty 0,16 EU/1 ml až nulové.
Pacient 6 měl v potransplantačním období fyziologické nálezy ve stolici i horních cestách dýchacích, moč byla sterilní. Hladiny endotoxinu byly nízké (0,06 EU/1 ml). Sedmý den se ve stolici objevila Klebsiella pneumoniae s produkcí ESBL. Kmen ve stolici přetrvával, aniž by došlo ke klinickým projevům infekce. Za sedm dní, tedy 14. den po transplantaci, došlo ke zvýšení hladiny endotoxinu na hodnoty 0,211 EU/1 ml až více než 0,25 EU/1 ml a 20. den po operaci, tzn. pět dní po vzestupu endotoxinu, se tentýž kmen objevil v moči, hladina endotoxinu zůstávala na vysoké hodnotě.
U všech popsaných klinických případů tak lze konstatovat translokaci agens z gastrointestinálního traktu do primárně sterilních lokalit transplantovaných za vzniku infekční komplikace a současně praktickou užitečnost prováděného monitoringu.
DISKUSE
Pacienti s chronickým jaterním onemocněním a v pooperačním období jsou zvýšeně ohroženi infekcemi, jejichž původci jsou zástupci přirozené mikroflóry člověka, zejména gastrointestinálního traktu(3). Je známo, že bakteriální infekce je u nemocných s jaterní cirhózou častá, v literatuře je uváděn až 40% výskyt (4) . Tyto infekční komplikace jsou nejčastěji způsobeny gramnegativními střevními tyčinkami. Z literatury je zřejmé, že až u 50 až 70 % takto nemocných dochází k bakteriální kolonizaci tenkého střeva až do jeho proximální části postupným šířením ze střeva tlustého. Opakovaně bylo prokázáno jejich přerůstání ve střevě a následná zvýšená translokace v důsledku dysfunkce střevní slizniční bariéry, roli hraje také narušená motilita tenkého střeva a změny ve složení střevní mikroflóry ve prospěch fakultativně anaerobních bakterií čeledi Enterobacteriaceae na úkor rodů Lactobacillus a Bifidobacterium (5). U těžce nemocných pacientů, kterými nemocní s jaterní cirhózou a po transplantaci jaterní bezesporu jsou, je narušena motilita tenkého střeva, vedoucí k bakteriálnímu přerůstání a s tím související bakteriální translokaci, způsobenou dysfunkcí střevní slizniční bariéry. Rovněž principy intenzivní péče, jako jsou umělá plieni ventilace, aplikace morfinu a další, dysfunkčnost zánětem alterované motility ještě potencují. Studie také ukazují, že ileus se může vyskytnout u více než 40 % kriticky nemocných pacientů. U pacientů s jaterní cirhózou se na zvýšené střevní propustnosti, a tedy zhoršené funkčnosti střevní bariéry, podílí zejména portální hypertenze (6) . U pacientů s jaterní cirhózou a portální hypertenzí klesá cévní rezistence a stoupá splanchnický průtok. Tyto změny působí hypoperfuzi střevní sliznice a hypoxii, která dále poškozuje střevní stěnu. V důsledku poškození pak snadno dochází k translokaci střevních bakterií (7,8) .
Pojem bakteriální translokace byl poprvé použit v roce 1979(9). Bakteriální translokace je definována jako aktivní či pasivní penetrace živých mikroorganismů a jejich toxinů extraluminálně - skrze epiteliální vrstvu sliznice do lamina propria mucosae. Odtud bakterie migrují do mezenteriálních lymfatických uzlin a/nebo do extraintestinálních lokalizací(9) . Za normálních podmínek jde o malé množství endogenních bakterií, které jsou pohotově ničeny imunitním systémem v lamina propria, což je umožněno jednak malým množstvím bakterií, jednak indukcí specifické imunitní odpovědi v Peyerských placích. Translokace je možná teprve při vysokém množství bakterií ve střevě (v literatuře je uváděno až 108 bakterií v 1 gramu stolice) (10-12) .
Bakterie, které uniknou fagocytům a destrukci komplementem, mohou proniknout až do krve. Enterobakterie, stafylokoky a enterokoky mají schopnost translokovat, tedy živě přecházet, přes střevní epitel do mezenteriálních lymfatických uzlin, krve a ostatních orgánů, zatímco většina anaerobních mikroorganismů tuto vlastnost postrádá. Bakteriální translokace je prokazatelná pozitivitou kultivace z mezenteriálních lymfatických uzlin. Hlavními mechanismy vedoucími k translokaci jsou deficit lokální slizniční imunitní odpovědi, pokles fagocytární aktivity makrofágů i neutrofilů, zvýšená propustnost střevní bariéry a zmíněné intestinální bakteriální přerůstání(10,13) .
Faktory, které ovlivňují bakteriální translokaci, lze rozdělit do tří skupin. Jednak je to faktor bakteriální, představující povahu translokujícího agens a stav okolní fyziologické mikroflóry, jednak faktor střevní stěny, tedy její morfologický a funkční stav, v neposlední řadě tzv. defenzivní faktory, lokální a systémové antibakteriální aktivity organismu (fagocytóza apod.) (11-14) . Přítomnost komenzální bakteriální mikroflóry je důležitá pro všechny obranné systémy (15) . Biologický tlak střevních mikrobů je nezbytný pro udržení slizniční bariérové funkce (16) . Porušení normální mikrobiální rovnováhy (např. u akutní pankreatitidy jaterní cirhózy vlivem aplikace morfinu) vyús»uje v dysfunkci slizniční bariéry způsobuje vzestup bakteriální translokace a mimo střevo se tak dostávají potenciálně patogenní bakterie. Současné a/nebo neadekvátní podávání antibiotik může vést k selekci rezistentních kmenů, jak se stalo i u našich pacientů, kdy producenti širokospektrých betalaktamáz ze střeva se stali původci infekcí v extraintestinálních lokalizacích. Neadekvátní podávání antibiotik tak může způsobit bakteriální selekci a potenciální zhoršení stavu (17). Pokud ale obligátní anaerobní střevní bakterie převyšují svým množstvím více než 100x aerobní druhy, pak k translokaci dochází jen výjimečně (18).
Je známé, že místní zánětlivé změny způsobují gastrointestinální hypomotilitu až ileus (19) . Zhoršení průchodu střevem je pak spojeno s přerůstáním bakterií do tenkého střeva. Bakteriální přerůstání do tenkého střeva je nejčastějším mechanismem vedoucím k bakteriální translokaci do extraintestinálních systémů. Fulminantní translokace může vyústit v bakteriémii. Koncept bakteriální translokace jako predisponujícího faktoru vzniku infekce je dále podpořen daty ukazujícími, že bakterie izolované z mezenteriálních lymfatických uzlin jsou geneticky identické s kmeny způsobujícími spontánní bakteriální peritonitidu u stejných zvířat (20) . Také u našich pacientů byla shoda v genotypu u bakterií, které byly vykultivovány z gastrointestinálního traktu s bakteriemi, které jsme izolovali ze sekundárních infekčních ložisek.
Zvýšení hladiny endotoxinu jako součásti stěny gramnegativních bakterií je fenomén považovaný za důkaz translokace bakterií ze střeva do krevního oběhu. Bývá pozitivní u cirhotických pacientů bez zjevné infekce, a předchází tak možnému pozdějšímu rozvoji těžké bakteriální infekce (21) .
Pro detekci poruchy permeability má měření hladiny endotoxinu významnou výpovědní hodnotu. Endotoxémie je u cirhotiků častým nálezem a hraje důležitou roli i při stimulaci cytokinů, které mohou ovlivnit tvorbu a degradaci extracelulární matrix, což je důležité při rozvoji jaterní fibrózy i cirhotické přestavby (22-24) . Systémová endotoxémie bez nálezu gramnegativní bakteriémie je častá u lidí s onemocněním jater. Pravděpodobně je způsobena jednak zhoršením jaterní clearance endotoxinu absorbovaného z gastrointestinálního traktu, jednak zvýšenou permeabilitou střevní slizniční bariéry. Hladiny endotoxinu lze vyšetřovat pomocí Limulus testu, který odhaluje jejich zvýšení především u pacientů po chirurgických zákrocích, i když ještě nejsou patrné klinické známky endotoxémie (25) . Rovněž u našich pacientů předcházel vzestup krevní hladiny endotoxinu mimostřevní infekční komplikace, způsobené stejným kmenem již dříve izolovaným z perianální oblasti. Patogenní uplatnění translokovaných kmenů u našich nemocných bylo zaznamenáno v močových cestách a operačních ranách, další byl zachycen jako kolonizující agens dýchacích cest s následnou možností rozvoje bronchopneumonie. Detekce zvýšené hladiny endotoxinu jako markeru translokace gramnegativních bakterií tak může být užitečným nástrojem časné diagnostiky infekčních komplikací, zejména u nemocných po transplantaci jater.
Práce byla podpořena výzkumným záměrem MŠMT MSM 6198959223 a grantem Interní grantové agentury MZ ČR č. NR 9116-3.
LITERATURA
- 1. Lindsay GK, Roslansky PF, Novitsky TJ. Single-step, chromogenic Limulus amebocyte lysáte assay for en-dotoxin. J Clin Microbiol 1989; 27: 947-951.
- 2. Ernjaes K, Sandvag D, Lundgren B, et al. Pulsed field gel electroforesis Typing of Escherichia coli Strains from samples collected before and after Pivmecillinam or placebo treatment of uncomplicated community-acquired urinary tract infection in women. Journal of Clinical Microbiology 2006; 39: 1776-1781.
- 3. Overhaus M, Togel S, Pezzone M, Bauer AJ. Mechanisms of polymicrobial sepsis-induced ileus. Am J Physiol Gastrointest Liver Physiol 2004; 287: 685-694.
- 4. Campillo B. Nosocomial spontaneous bacterial peritonitis and bacteremia in cirrhotic patients. Clin Infect Dis 2002; 35: 1-9.
- 5. Floch MH, Katz J, Conn H. Qualitative and quantitative relationships of the fecal flora in cirrhotic patients with portal systemic encephalopathy and following potrocaval anastomosis. Gastroenterology, 1970; 59: 70-75.
- 6. Ersôz G, Aydin A, Erdem S, et al. Intestinal permeability in liver cirrhosis. Europian J Gastroent Hepatol 1999; 11: 409.
- 7. Goulis J, Patch D, Burrougs AK. Bacterial infection in the patogenesis of variceal bleeding. Lancet 1999; 353: 139.
- 8. Lata J, Vaňásek T. Kritické stavy v hepatologii. 1. vydání. Praha: Grada Publishing 2005; 168.
- 9. Berg R, Garlington A. Translocation of certain indigenous bacteria from the gastrointestinal tract to the mesenteric lymph nodes and other organs in a gnoto-biotic mouse model. Infect Immun 1979; 23: 403-411.
- 10. Guarner C, Runyon BR, Young S, et al. Intestinal bacterial overgrowth and bacterial translocation in cirrhotic rats with ascites. J Hepatology 1997; 26: 1372-1378.
- 11. Zbořil V. Mikroflóra trávicího traktu - klinické souvislosti. Praha: Grada Publishing 2005; 23-33.
- 12. Hanson LA, Yolken RH. Probiotics, other nutritional factors and intestinal microflora. Philadelphia: Lippincot-Raven 1999; 18-67.
- 13. Ramachandran A, Balasubramanian K. Intestinal dysfunction in liver cirrhosis. Its role in spontaneous bacterial peritonitis. J Gastroenterol Hepatol 2001; 16: 607-612.
- 14. Thalheimer U, Triantos CK, Samonakis DN. Infection, coagulation and variceal bleeding in cirrhosis. Gut 2005; 54: 556-563.
- 15. Guarner F, Malagelada J. Gut flora in health and disease. Lancet 2003; 361: 512-519.
- 16. Hooper L, Gordon J. Commensal host-bacterial relationships in the gut. Science 2001; 292: 1115-1118.
- 17. Kolář M. Antibiotická léčba nozokomiálních infekcí. Praha: Triton 2000.
- 18. Steffen EK, Berg RD, Deitch EA. Comparison of translocation rates of various indigenous bacteria from tha gastrointestinal tract to the mesenteric lymph node. J Infect Dis 1988; 157: 1032-1037.
- 19. Berg RD. Bacterial translocation from the gastrointestinal tract. Trends Microbiol 1995; 3: 149-154.
- 20. Llovat JM, Bartoli R, March F, Planas R. Translocated intestinal bacteria cause spontaneous bacterial peritonitis in cirrhotic rats: molecular epidemiologie evidence. J Hepatol 1998; 28: 307-313.
- 21. Albillos A, de-la Herra A, Alvarez-Mon M. Serum lipopolysaccharide-binding protein prediction of severe bacterial infection in cirrhotic patiens with ascites. Lancet 2004; 363: 1608-1610.
- 22. Wu CD, Li MZ, Chen CL. Endotoxin-induced liver injury and plasma tumor necrosis factor alfa, inter-leukin 6 level changes in rabbits. Chin J Dig Dis 1995; 15: 256-258.
- 23. Hai YZ, Hui JW, Zhi L. Intestinal microflora in patients with liver cirrhosis. Chin J Dig Dis 2004; 5: 64-72.
- 24. Lata J. Portální hypertenze při jaterní cirhóze a její důsledky. Plzeň, PA: GAAN CZ 2000
- 25. Kimura Y, Nakao A, Tamura H, Tanaka S. Clinical and experimental studies of the limulus test after digestive surgery. Surg Today 1995; 25: 790-794.
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users