Chromocolonoscopy increases flat adenoma detection in patients after colorectal cancer resection
Jan Bureš Orcid.org 1, Jan Petrášek Orcid.org , Josef Chalupa Orcid.org 2, Jiří Platoš Orcid.org 3, Jan Kuchař Orcid.org 3, Ivana Mikoviny Kajzrlíková Orcid.org 4, Pavel Řeha Orcid.org 3, Vladimír Jr. Hořava Orcid.org 5, Petr Vítek6,7
+ Affiliation
Summary
SUMMARY
Vítek P, Bureš J, Petrášek J, Chalupa J, Platoš J, Kuchař J, Kajzrlíková I, Řeha P, Hořava V jr. Chromocolonoscopy increases flat adenoma detection in patients after colorectal cancer resection
The aim of the study: Authors decided to evaluate benefit of chromoendoscopy in patient after colorectal cancer (CRC) resection.
Material and methods: A total of 62 patients (35 men, 27 women, mean age 67 years) after CRC resection were examined colonoscopically during the period from 10/2005 to 7/2007. Normal colonoscopy was performed first, lesions were decribed and biopsy from all lesions was taken. Chromocolonoscopy with 0,1% solution of methylene blue followed. New lesions were identified and biopsy from all lesions was taken. Examination time, withdrawal time, bowel preparation and dye consumption were measured.
Results: We have found 66 lesions during normal colonoscopy, of them 36 neoplastic (2 CRC, 3 HGD adenomas, 31 LGD adenomas). During chromocolonoscopy we have found another 106 lesions, of them 39 neoplastic (3 HGD adenomas, 36 LGD adenomas). Chromoendoscopy added on average 20 minutes to the total examination time. Mean consumption of dye solution was 55 ml. There were no complications of chromoendoscopy in our group of patients.
Conclusion: Chromocolonoscopy with methylene blue solution resulted in two-fold increase of neoplastic lesion detection, especially type 0-IIa flat adenomas. Advanced neoplastic lessions missed by normal colonoscopy were also detected. Based on these results we can recommend chromocolonoscopy for this group of patients.
Key words: adenoma - chromoendoscopy- colonoscopy - colorectal neoplasms - methylene blue.
ÚVOD
Kolorektální karcinom je v České republice druhým nejčastějším novotvarem u obou pohlaví. Incidence i mortalita onemocnění v posledních třiceti letech neustále stoupají(1). Nemocní po resekci kolorektálního karcinomu patří do vysokorizikové skupiny která je ohrožena vznikem metachronní neoplazie. Cílem dispenzárních endoskopických programů u těchto nemocných je detekovat a endoskopicky odstraňovat neoplastické leze (adenomy) kolon a takto snižovat riziko vzniku metachronního karcinomu(2).
Chromoendoskopie je souhrnný název pro metody, při kterých se aplikují různá barviva na sliznice jednotlivých částí gastrointestinálního traktu(3). Metylénová modř patří mezi absorpční barviva (barvivo je vstřebáváno cylindrickým epitelem) a její roztok lze použít při chromoendoskopii Barretova jícnu i pro vyhledávání neoplazií v kolon. Chromoendoskopie je vzhledem ke své jednoduchosti v současnosti prakticky realizovatelná na všech endoskopických pracovištích používajících videoendoskopy v České republice.
Autoři se rozhodli posoudit přínos chromoendoskopie kolon s použitím 0,1% roztoku metylénové modři u nemocných po kurativní resekci kolorektálního karcinomu.
MATERIÁL A METODIKA
Soubor tvoří celkem 62 nemocných po resekci kolorektálního karcinomu, kteří byli v rámci dispenzárního sledování odesláni v období od října 2005 do července 2007 ke kolonoskopickému vyšetření na endoskopické pracoviště Beskydského gastrocentra Nemocnice ve Frýdku-Místku. Soubor zahrnuje 35 mužů a 27 žen, průměrného věku 67 let. V souboru převažovali nemocní po resekci karcinomu sigmo-idea (29 nemocných, tedy 47 %), zastoupení ostatních lokalit je patrné z tabulky 1.

U 20 nemocných se jednalo o první kolonoskopické vyšetření po resekci, u zbývajících 42 nemocných se jednalo o běžné intervalové vyšetření v rámci dispenzárního programu. U všech nemocných byl zpracován rodokmen se zaměřením na detekci hereditárního non-polypózního kolorektálního karcinomu (HNPCC), u žádného nemocného nebyl na základě dat rodokmenu diagnostikován HNPCC, ani vysloveno podezření na tuto diagnózu.
K vyšetřením byly použity běžné kolonoskopy Olympus řady EVIS-EXERA160 (CFQ160L, CFQ160ZL).
U nemocných bylo nejprve provedeno standardní nativní kolonoskopické vyšetření. Byla zhodnocena příprava, případné zbytky tekuté stolice byly odsáty. Veškeré zachycené leze byly popsány a bioptovány.
K popisu bylo použito Pařížské klasifikace povrchových neoplazií(4), velikost byla odhadnuta s pomocí porovnání s rozpětím bioptických kleští. Měřili jsme celkový čas vyšetření a prohlížecí čas vyšetření.
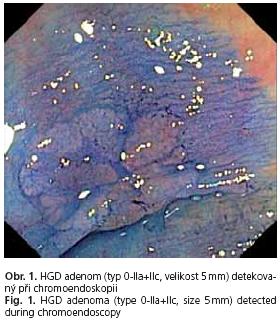
Následně byl znovu zaveden endoskop do céka a provedena chromoendoskopie celého kolon s 0,1% roztokem metylénové modři. K aplikaci roztoku byl použit sprejovací katetr (Olympus PW 205V). Veškeré nově zachycené leze byly popsány a bioptovány (obr. 1), byl opět měřen celkový čas vyšetření. Bylo zhodnoceno množství roztoku barviva aplikovaného během chromoendoskopie do lumen kolon.
Byly sledovány komplikace během diagnostického vyšetření i komplikace případných terapeutických zákroků.
Všechna vyšetření provedl jeden endoskopista. Pro přípravu k vyšetření nemocní použili roztok Fortrans (Beafour Ipsen) v obvyklém dávkování.
Bioptické vzorky byly standardně fixovány 10% formalínem a hodnoceny na jednom patologickém pracovišti.
Na základě velikosti a histologického vyšetření byly leze pro vyhodnocení rozděleny do následujících skupin: invazivní karcinom (CRC), adenom s těžkou dysplazií větší nebo roven 10 mm (HGD >10 mm), adenom s těžkou dysplazií menší než 10 mm (HGD < 10 mm), adenom s lehkou dysplazií větší nebo roven 10mm (LGD >10 mm), adenom s lehkou dysplazií menší než 10 mm (LGD < 10 mm), hyperplastické a ostatní non-neoplastické leze (NN). Jako pokročilý adenom (AA) byla hodnocena neoplastická leze s těžkou dysplazií a/nebo větší než 10 mm. Dle makroskopického vzhledu byly leze klasifikovány dle Pařížské klasifikace povrchových neoplazií trávicí trubice (0-Ip, 0-Is, 0-IIa, 0-IIb, 0-IIc, 0-III) (4) .
Pro statistické zhodnocení struktury lézí nalezených při nativní endoskopii a při následné chromoendoskopii byl použit Mann-Whitney neparametrický test.
Všichni nemocní podepsali informovaný souhlas s vyšetřením i zařazením do studie. Studie byla schválena etickou komisí.
VÝSLEDKY
Nativní kolonoskopie byla provedena u všech 62 pacientů, u čtyř z nich nebylo vzhledem k suboptimální přípravě možné provést úplnou chromokolonoskopii. U těchto čtyř nemocných byla doporučena dispenzární kolonoskopie v intervalu jednoho roku. Úplná chromokolonoskopie byla tedy provedena u 58 nemocných.
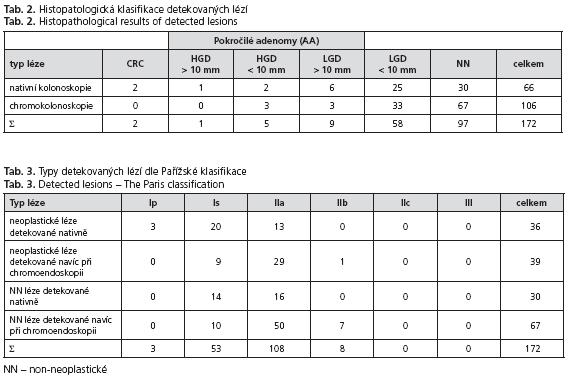
Nativně bylo nalezeno celkem 66 lézí (2x karcinom v anastomóze, 1 HGD > 10 mm, 2 HGD < 10mm, 6 LGD > 10mm, 25 LGD < 10mm, 30 NN).
Při následné chromokolonoskopii bylo nalezeno dalších 106 lézí (3 HGD < 10 mm, 3 LGD > 10 mm, 33 LGD < 10 mm, 67 NN). Výsledky jsou uvedeny v tabulce 2. Typy neoplastických i non-neoplastických lézí dle Pařížské klasifikace povrchových neoplazií jsou uvedeny v tabulce 3. Průměrný čas nativní kolonoskopie byl 14 minut, z toho prohlížecí čas 8 minut. Průměrný čas chromoendoskopie byl 19 minut. Průměrná spotřeba 0,1% roztoku metylénové modři na jedno vyšetření byla 55 ml.
Na jeden nativně nedetekovatelný adenom bylo tedy potřeba 28 minut vyšetřovacího času a 82ml roztoku.
Pro statistické zhodnocení typu lézí nalezených při nativní endoskopii a při následné chromoendoskopii byl použit Mann-Whitney neparametrický test.
Bylo prokázáno, že při chromoendoskopii byl významně vyšší záchyt plochých adenomů (typ 0-IIa) než při nativní endoskopii (p = 0,01). Rovněž záchyt plochých non-neoplastických lézí (typ 0-IIa) byl významně vyšší než při nativní endoskopii (p < 0,001). Chromoendoskopie měla také signifikantně delší celkový čas než nativní endoskopie (p < 0,001).
Komplikace: U jednoho nemocného došlo po polypektomii 8 mm velkého LGD adenomu typu Is (viditelného nativně) třetí den po výkonu ke krvácení, které si vyžádalo třídenní hospitalizaci bez nutnosti krevních převodů. Krvácení bylo ošetřeno naložením endoklipu. Další komplikace diagnostiky a terapie v souboru jsme nezaznamenali.
V souboru jsme se během dispenzárních vyšetření setkali s nálezem karcinomu v oblasti ana-stomózy u dvou pacientů (3 %), v jednom případě u nemocného po nízké resekci rekta 5 let po operaci, ve druhém pak v oblasti sestupného tračníku dva roky po operaci. U obou nemocných byly primární resekce sice hodnoceny jako R0, uvedené nálezy však vzhledem k časovému intervalu hodnotíme jako reziduálni nemoc a ne pravou recidívu. U jedné nemocné ze souboru po operaci karcinomu rekta, která měla negativní nativní kolonoskopii i chromokolonoskopii včetně biopsií z oblasti anastomózy jeden rok po nízké resekci, byl za šest měsíců po tomto vyšetření diagnostikován rozsáhlý symptomatický extramurální tumor s prorůstáním do rekta. Celkově bylo v souboru tedy zaznamenáno 4,8 % karcinomů v oblasti primární anastomózy po resekci, ve všech případech se jednalo o reziduálni nemoc.
DISKUSE
Nemocní po resekci kolorektálního karcinomu jsou ohroženi jednak reziduálni nemocí, která se manifestuje v oblasti anastomózy a dále metachronními de novo vzniklými karcinomy. V případě reziduálni nemoci v kolon (2-4% nemocných) se v drtivé většině případů jedná o extramurální pokročilý tumor a dispenzární endoskopické kontroly obvykle nevedou ke zlepšení přežití(5,6). Je ovšem prokázáno, že intenzivní endoskopické dispenzární intervaly mohou zlepšit přežití u nemocných s reziduálni nemocí, popřípadě lokální recidívou tumorů rekta, která je až 10x častější a závisí na operační technice(7). V našem souboru jsme karcinom v oblasti anastomózy diagnostikovali u dvou pacientů, u další nemocné s karcinomem rekta byl rozsáhlý extramurální karcinom s prorůstáním do rekta diagnostikován za půl roku po negativní dispenzární kolonoskopii.
Incidence pravých metachronních karcinomů je odhadována na 0,35 %/rok a endoskopická dispenzarizace spojená s preventivním odstraňováním adenomů je účinná(8,9). Doporučení jednotlivých endoskopických společností stran dispenzárních intervalů se mírně liší, obecně klíčový je především nález při prvním dispenzárním kolonoskopickém vyšetření(2,10,11) .
V současnosti již víme, že běžná kolonoskopie bílým světlem není dokonalou metodou vyšetření střeva. V tandemových endoskopických studiích z konce 90. let minulého století bylo prokázáno přehlédnutí až 6 % pokročilých adenomů (větších než 10 mm) (12) . V souvislosti s dostupností metody CT kolonografie bylo ve specializovaných centrech v klinických studiích prokázáno endoskopické přehlédnutí až 12-17% pokročilých adenomatózních polypů (13,14) . Riziko konverze těchto pokročilých adenomů na karcinom je odhadováno na 1 % ročně (15) .
Dalším aspektem, ke kterému je nutno přihlédnout, je fakt, že až 30 % tumorů v kolon je primárně nepolypózních (16,17) . Pro záchyt těchto neoplazií jsou doporučeny různé metody, které jsou závislé na přístrojové technologii, technice endoskopisty a rovněž způsobu přípravy kolon (18) (menší insuflace během endoskopie, optimalizace přípravy střeva, z technologických inovací především endoskopie s vysokým rozlišením, narrow band imaging a autofluorescence) (19) . Chromoendoskopie patří mezi způsoby, kdy můžeme zlepšit vizualizaci plochých lézí během běžné endoskopie bílým světlem, a je k tomuto účelu doporučena (4) . Chromoendoskopie prokazatelně zvyšuje záchyt plochých neoplastických lézí v kolon (20-24) , její praktická aplikace není vázána na dodatečné investice do přístrojového vybavení. Obvykle je používán 0,1% roztok indigokarmínu, což je kontrastní barvivo, které se do sliznice nevstřebává (25) . Metodika chromoendoskopie je některými autory považována za příliš náročnou na čas a nepohodlnou vzhledem k nutnosti opakovaného zavádění sprejovací kanyly s barvivem(26) . I v našem souboru jsme prokázali významné prodloužení vyšetřovacího času vzhledem k nativní kolonoskopii.
Metylénová modř patří mezi absorpční barviva. Po aplikaci do lumen je absorbována cylindrickým epitelem střeva i kolon. Bývá užívána při diagnostice specializované intestinální metaplazie v Barretově jícnu (27) a gastrické intestinální metaplazie (28) . V kolon její použití převažuje především v diagnostice dysplazie v terénu ulcerózní kolitidy (29) . Na našem pracovišti používáme roztok metylénové modři k chromoendoskopii v kolon od roku 2003 po osobních zkušenostech s prací japonského endoskopisty s tímto barvivem(30) .
Stejně jako u indigokarmínu získáme při aplikaci roztoku metylénové modři sliznici kolon v úvodu reliéfové barvení, následně po vstřebání barviva pak můžeme detekovat oblasti s nižším či žádným zbarvením, které obvykle odpovídají neoplastickým či zánětlivým změnám. Metylénová modř se vylučuje močí, vyšetřovaného je tedy nutno upozornit na modrozelenou barvu moči po vyšetření. Někteří autoři vyslovili v souvislosti s použitím kombinace metylénové modři a bílého světla při gastrointestinální endoskopii obavy z možného oxidativního poškození DNA střevního epitelu (31) , klinický dopad tohoto zjištění však zatím nebyl prokázán.
Pro kvalitní chromoendoskopii je nezbytná optimální příprava střeva. V souboru jsme u čtyř nemocných nedosáhli uspokojivé přípravy a chromoendoskopii jsme tedy nemohli provést.
Dalším parametrem, který prokazatelně zvyšuje záchyt neoplastických lézí v kolon při endoskopickém vyšetření, je prohlížecí čas (32) . Tento byl v našem souboru sledován jak při nativním vyšetření, tak při chromoendoskopii. V současnosti je jako minimální prohlížecí čas doporučeno 6 minut (19) . Tento čas byl v našem souboru dodržen či překročen ve všech případech nativních vyšetření, během chromoendoskopie byl prohlížecí čas dále významněji prodloužen. Je tedy otázkou, zdali kromě vlastní chromoendoskopie nepřispělo k významně zvýšenému záchytu plochých neoplastických lézí i samotné prodloužení času prohlížení sliznice, ke kterému během chromoendoskopie došlo. Součástí posuzování rozdílů v úspěšnosti detekce adenomů mezi jednotlivými endoskopisty jsou i procenta detekovaných adenomů u nemocných nad 50 let. Současným standardem je detekce alespoň jednoho adenomu u 25 % mužů a 15 % žen (18) . V souboru byl vliv tohoto parametru na výsledky vyloučen tím, že všichni pacienti byli vyšetřeni jedním endoskopistou.
ZÁVĚR
Chromokolonoskopie s roztokem metylénové modři vedla u nemocných po resekci kolorektálního karcinomu k více než dvojnásobnému zvýšení záchytu neoplastických lézí, a to včetně záchytu nativně nedetekovatelných pokročilých adenomů. Jednalo se o zlepšenou detekci především plochých lézí typu 0-IIa. Záchyt těchto lézí vyžadoval významné prodloužení vyšetřovacího času a nezanedbatelné množství barviva. Na základě našich výsledků jsme přesvědčeni, že chromokolonoskopii lze využít v rámci dispenzárního sledování této vysokorizikové skupiny nemocných.
LITERATURA
- 1. ÚZIS. Novotvary 2004.
- 2. Rex DK, Kahi CJ, Levin B, Smith RA, Bond JH, Brooks D, Burt RW, Byers T, Fletcher RH, Hyman N, Johnson D, Kirk L, Lieberman DA, Levin TR, O'Brien MJ, Simmang C, Thorson AG, Winawer SJ. Guidelines for colonoscopy surveillance after cancer resection: a consensus update by the American Cancer Society and US Multi-Society Task Force on Colorectal Cancer. CA Cancer J Clin 2006; 56: 160-167; quiz 185-186.
- 3. Bureš J, Rejchrt S, Repák R, Slezák L, Kopáčova M, Široký M. Chromoendoskopie. Čes Slov Gastroent 2000; 54: 65-68.
- 4. Inoue H, Kashida H, Kudo S, Sasako M, Shimoda T, Watanabe H, Yoshida S, Guelrud M, Lightdale CJ, Wang K, Riddell RH, Diebold MD, Lambert R, Rey JF, Jung M, Neuhaus H, Axon AT, Genta RM, Gonvers JJ. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastroin-test Endosc 2003; 58: S3-S43.
- 5. Barillari P, Ramacciato G, Manetti G, Bovino A, Sammartino P, Stipa V. Surveillance of colorectal cancer: effectiveness of early detection of intraluminal recurrences on prognosis and survival of patients treated for cure. Dis Colon Rectum 1996; 39: 388-393.
- 6. Ohlsson B, Breland U, Ekberg H, Graffner H, Tranberg KG. Follow-up after curative surgery for colorectal carcinoma. Randomized comparison with no follow-up. Dis Colon Rectum 1995; 38: 619-626.
- 7. Renehan AG, Egger M, Saunders MP, O'Dwyer ST. Impact on survival of intensive follow up after curative resection for colorectal cancer: systematic review and meta-analysis of randomised trials. Bmj 2002; 324: 813.
- 8. Cali RL, Pitsch RM, Thorson AG, Watson P, Tapia P, Blatchford GJ, Christensen MA. Cumulative incidence of metachronous colorectal cancer. Dis Colon Rectum 1993; 36: 388-393.
- 9. Green RJ, Metlay JP, Propert K, Catalano PJ, Macdonald JS, Mayer RJ, Halier DG. Surveillance for second primary colorectal cancer after adjuvant chemotherapy: an analysis of Intergroup 0089. Ann Intern Med 2002; 136: 261-269.
- 10. Davila RE, Rajan E, Baron TH, Adler DG, Egan JV, Faigel DO, Gan SI, Hirota WK, Leighton JA, Lichtenstein D, Qureshi WA, Shen B, Zuckerman MJ, VanGuilder T, Fanelli RD. ASGE guideline: colorectal cancer screening and surveillance. Gastrointest Endosc 2006; 63: 546-557.
- 11. Benson AB, 3rd, Desch CE, Flynn PJ, Krause C, Loprinzi CL, Minsky BD, Petrelli NJ, Pfister DG, Smith TJ, Somerfield MR. 2000 update of American Society of Clinical Oncology colorectal cancer surveillance guidelines. J Clin Oncol 2000; 18: 3586-3588.
- 12. Rex DK, Cutler CS, Lemmel GT, Rahmani EY, Clark DW, Helper DJ, Lehman GA, Mark DG. Colonoscopic miss rates of adenomas determined by back-to-back colonoscopies. Gastroenterology 1997; 112:24-28.
- 13. Pickhardt PJ, Choi JR, Hwang I, Butler JA, Puckett ML, Hildebrandt HA, Wong RK, Nugent PA, Mysliwiec PA, Schindler WR. Computed tomographic virtual colonoscopy to screen for colorectal neoplasia in asymptomatic adults. N Engl J Med 2003; 349: 2191-2200.
- 14. Van Gelder RE, Nio CY, Florie J, Bartelsman JF, Snel P, De Jager SW, Van Deventer SJ, Lameris JS, Bossuyt PM, Stoker J. Computed tomographic colonography compared with colonoscopy in patients at increased risk for colorectal cancer. Gastroenterology 2004; 127: 41-48.
- 15. Stryker SJ, Wolff BG, Culp CE, Libbe SD, Ilstrup DM, MacCarty RL. Natural history of untreated co-Ionic polyps. Gastroenterology 1987; 93: 1009-1013.
- 16. Saitoh Y, Waxman I, West AB, Popnikolov NK, Gatalica Z, Watari J, Obara T, Kohgo Y, Pasricha PJ. Prevalence and distinctive biologic features of flat colorectal adenomas in a North American population. Gastroenterology 2001; 120: 1657-1665.
- 17. Rembacken BJ, Fujii T, Cairns A, Dixon MF, Yoshida S, Chalmers DM, Axon AT. Flat and depressed colonic neoplasms: a prospective study of 1000 colonoscopies in the UK. Lancet 2000; 355: 1211-1214.
- 18. Rex DK. Maximizing detection of adenomas and cancers during colonoscopy. Am J Gastroenterol 2006; 101: 2866-2877.
- 19. Rex DK. Who is the best colonoscopist? Gastrointest Endosc 2007; 65: 145-150.
- 20. Hurlstone DP, Cross SS, Slater R, Sanders DS, Brown S. Detecting diminutive colorectal lesions at colonoscopy: a randomised controlled trial of pan-colonic versus targeted chromoscopy Gut 2004; 53: 376-380.
- 21. Hurlstone DP, Sanders DS, Cross SS, Adam I, Shorthouse AJ, Brown S, Drew K, Lobo AJ. Colonoscopic resection of lateral spreading tumours: a prospective analysis of endoscopic mucosal resection. Gut 2004; 53: 1334-1339.
- 22. Brooker JC, Saunders BP, Shah SG, Thapar CJ, Thomas HJ, Atkin WS, Cardwell CR, Williams CB. Total colonic dye-spray increases the detection of diminutive adenomas during routine colonoscopy: a randomized controlled trial. Gastrointest Endosc 2002; 56: 333-338.
- 23. Le Rhun M, Coron E, Parlier D, Nguyen JM, Canard JM, Alamdari A, Sautereau D, Chaussade S, Galmiche JP. High resolution colonoscopy with chromoscopy versus standard colonoscopy for the detection of colonic neoplasia: a randomized study. Clin Gastroenterol Hepatol 2006; 4: 349-354.
- 24. Lee JH, Kim JW, Cho YK, Sohn CI, Jeon WK, Kim BI, Cho EY. Detection of colorectal adenomas by routine chromoendoscopy with indigocarmine. Am J Gastroenterol 2003; 98: 1284-1288.
- 25. Wong Kee Song LM, Adler DG, Chand B, Conway JD, Croffie JM, Disario JA, Mishkin DS, Shah RJ, Somogyi L, Tierney WM, Petersen BT Chromoendoscopy. Gastrointest Endosc 2007; 66: 639-649.
- 26. Johanson JF. Practicality of high-resolution chromoendoscopy during routine screening colonoscopy. Gastrointest Endosc 2006; 63: 829-830.
- 27. Kiesslich R, Hahn M, Herrmann G, Jung M. Screening for specialized columnar epithelium with methylene blue: chromoendoscopy in patients with Barrett's esophagus and a normal control group. Gastrointest Endosc 2001; 53: 47-52.
- 28. Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Lara-Santos L, Guilherme M, Moreira-Dias L, Lomba-Viana H, Ribeiro A, Santos C, Soares J, Mesquita N, Silva R, Lomba-Viana R. Magnification chromoendoscopy for the diagnosis of gastric intestinal metaplasia and dysplasia. Gastrointest Endosc 2003; 57: 498-504.
- 29. Kiesslich R, Fritsch J, Holtmann M, Koehler HH, Stolte M, Kanzler S, Nafe B, Jung M, Galie PR, Neurath MF. Methylene blue-aided chromoendoscopy for the detection of intraepithelial neoplasia and colon cancer in ulcerative colitis. Gastroenterology 2003; 124: 880-888.
- 30. Vítek P, Urban O, Chalupa J. Pracovní setkání s reprezentantem japonské endoskopické školy. Čes Slov Gastroent 2004; 58: 21-23.
- 31. Olliver JR, Wild CP, Sahay P, Dexter S, Hardie LJ. Chromoendoscopy with methylene blue and associated DNA damage in Barrett's oesophagus. Lancet 2003; 362: 373-374.
- 32. Rex DK, Petřini JL, Baron TH, Chak A, Cohen J, Deal SE, Hoffman B, Jacobson BC, Mergener K, Petersen BT, Safdi MA, Faigel DO, Pike IM. Quality indicators for colonoscopy. Gastrointest Endosc 2006; 63: S16-S28.
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users