Biologic therapy in gastroenterology
Vladimír Zbořil Orcid.org 1
+ Affiliation
DEFINICE BIOLOGICKÉ TERAPIE
Biologická terapie spočívá v podání látek biologické povahy, které zasahují do patofyziologického mechanizmu zánětu ve prospěch léčeného organizmu. Většina látek specificky inhibuje translaci mRNA určité molekuly proteinu, angažovaného v zánětlivé reakci. Podle FDA (Food and Drug Administration) náleží do skupiny této léčby: terapeutická séra, toxiny antitoxiny produkty virů, bakterií a kvasinek nebo jiných usmrcených či živých mikroorganizmů(1). Konkrétními představiteli biologické léčby jsou:
- nativní biologické přípravky a izobáty (např. hyperimunní gamaglobulin, koagulační faktory),
- rekombinantní peptidy a proteiny (např. rekombinantní cytokiny antagonisté cytokinových receptorů),
- monoklonální protiláky proti cytokinům (např. antiTNF-α),
- syntetické oligonukleotidy (např. ISIS 2302),
- genová terapie.
Na rozdíl od základní definice v dělení biologické terapie existují určité odlišnosti, jak vidíme například u Ardizzona2, který navrhuje rozlišovat:
- buněčnou a genovou terapii (včetně alterace autologních a donorových buněčných populací),
- nativní biologické preparáty a izoláty (imunoglobuliny vakcíny),
- rekombinantní peptidy a proteiny (monoklonální protilátky),
- terapii na bázi nukleových kyselin (protilátkové oligonukleotidy).
Významnou perspektivu jistě představuje genová terapie, která v experimentu může probíhat in vivo a ex vivo. Při metodice ex vivo dochází ke zpracování cílové buňky cytokiny nebo jinými faktory, poté jsou vloženy nebo deletovány cílové geny v izolovaných cílových buňkách a ty, takto zpracované, jsou vráceny hostiteli. Při technice in vivo je pomocí virového nebo plazmidového vektoru vložena informace do cílových buněk, což vede ke vzniku produkce anti-m-RNA. Z praktického hlediska do oblasti klinického experimentu vstoupily následující druhy biologické terapie(2):
- 1. anti-CD-4 monoklonální protilátky,
- 2. interleukin-1 (IL-1),
- 3. interleukin-2 (IL-2),
- 4. interleukin-4 (IL-4),
- 5. inteleukin-10 (rhu IL-10: rekombinantní humánní IL-10),
- 6. inteleukin-11 (rhu IL-11: rekombinantní humánní IL-11),
- 7. blokáda adhezivních molekul, převážně tzv. integriny např. VCAM (vascular cell, adhes. mol.) a ICAM (intracell. adhes. mol),
- 8. stimulace růstovými faktory (např. TGF-β: transformující růstový faktor beta),
- 9. PPARS (peroxizomální proliferaci aktivující receptory),
- 10. blokáda TNF (tumor nekrózujícího faktoru).
Biologická terapie se dnes uplatňuje v alergologii a imunologii, revmatologii, dermatologii a také gastroenterologii. Hlavní indikační oblast v gastroenterologii dnes nepochybně představují idiopatické střevní záněty. V biologické terapii se u nich uplatňují látky blokující TNF-α a inhibitory adhezivních molekul.
LÁTKY BLOKUJÍCÍ TNF-α
Biologické účinky TNF-α lze shrnout do následujícího přehledu:
- indukce prozánětlivých cytokinů (IL-1, IL-6, IFN-γ),
- zvýšení permeability endotelu, což usnadňuje migraci leukocytů,
- zvýšení exprese adhezivních molekul na endoteliálních buňkách a leukocytech,
- aktivace funkce neutrofilů a eozinofilů,
- indukce tvorby proteinů akutní fáze v játrech,
- uvolnění prokoagulačních látek,
- potlačení aktivity lipoproteinové lipázy v adipocytech,
- stimulace aktivace a diferenciace osteoklastů a snížení jejich apoptózy
Z tohoto přehledu vyplývá, že TNF-α má řadu fyziologických úloh především v mechanizmu zánětlivé reakce organizmu. Fyziologický zánět v organizmu má ovšem klasickou strukturu tří fází:
- a) akutní cévní odpověď spojená s vazodilatací, vyšší permeabilitou a neutrofilní infiltrací, která trvá asi 24 hodin a přechází do
- b) fáze akutní buněčné odpovědi s lymfocytární a monocytární infiltrací, která v průběhu asi 7 dnů ustupuje do fáze
- c) chronické buněčné odpovědi s destrukcí a reparací poškozené tkáně.
Problém nastává u chronických zánětlivých procesů, kde fáze b perzistuje a v různé míře se překrývá s fází c. Destrukce a především reparace tkáně tak vlastně nikdy není dokončena. Za těchto okolností se ovšem TNF-α stává jedním z faktorů, které udržují mechanizmus zánětu ve stavu aktivity, a tím do značné míry brání jeho ukončení, a tedy vyhojení(3). Z hlediska patofyziologického se tedy nabízí blokování TNF-α jako jedna z možností jak tlumit - léčit chronické zánětlivé procesy. V současné době jsou k dispozici tři skupiny látek a metod jak aktivitu TNF-α neutralizovat:
- prostaglandiny, inhibitory fosfodiesterázy, adenosiny, kortikosteroidy a IL-10,
- blokátory tvorby TNF pro-proteinů (inhibitory metalproteinázy),
- anti-TNF-α - protilátky.
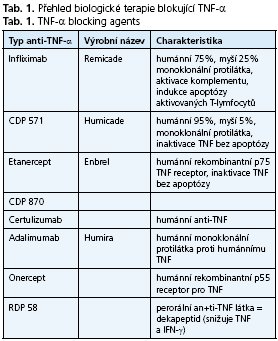
Aktuálně existuje několik základních typů látek blokujících TNF-α. Přehled látek blokujících TNF-α je uveden v tabulce 1.
Vývoj ukazuje a klinické zkušenosti potvrzují, že schopnost indukce apoptózy je jedním z nejdůležitějších faktorů efektivity látek, blokující funkci TNF-α.
V terapii ISZ našly uplatnění v klinické praxi dosud dvě látky - infliximab s adalimumabem. Pozitivní zkušenosti byly získány v klinických studiích s certulizumabem, který do klinické praxe vstupuje s onerceptem.
Infliximab
Je chimérická monoklonální protilátka proti TNF-α třídy IgG, která obsahuje ze 75 % lidskou a z 25 % myší bílkovinu. Na vazebném místě (Complementary Determining Region) v molekule imunoglobulinu figuruje proteinová kombinace izolovaná z imunizované myši. Infliximab se podává ve formě intravenózních infuzí v dávce 5 mg/kg váhy, výjimečně ve zvláš» zvážených případech také 10 mg/kg váhy. Léčba iniciační zahrnuje infuze v týdnech 0,2 a 6. Na ni může navázat pokračovací cyklická terapie s infuzí po 8 týdnech. V současné době je uzavřena řada klinických studií u souboru, který přesáhl 1700 pacientů, přičemž k dispozici jsou zhodnocené zkušenosti se dvěma základními indikacemi léčby:
- Crohnova nemoc - k dispozici je 7 kompletních studií a 1106 nemocných léčených infliximabem (ze 1140). Hlavními studiemi jsou ACCENT I.(4), ACCENT II.(5).
- Ulcerózní kolitida - hlavními studiemi jsou ACT 1(6), ACT 2(7).
Mimo těchto základních indikací byl infliximab použit v léčbě tzv. indeterminované kolitidy (V podstatě se jedná o záněty tračníku, kde není jednoznačný závěr, zda se jedná o ulcerózní kolitidu či kolitidu crohnovskou.) a pouchitidy Důvodem k zahájení léčby mohou být též závažné extra-intestinální manifestace (zejména kloubní, kožní, ale i oční) a kortikosteroidní dependence s cílem eliminovat kortikosteroidy.
Crohnova choroba
V současné době je indikací refrakterní průběh Crohnovy nemoci nereagující na jinou terapii (aminosalicyláty, kortikosteroidy, imunosupresiva, enterální výživa) nebo Crohnova choroba komplikovaná perianální pištěli. Dalšími indikace jsou již uváděné extraintestinální manifestace nemoci a kortikorezistence a kortikodependence. Studie prokázaly, že luminální forma Crohnovy nemoci reaguje lépe, než je tomu u fistulující Crohnovy choroby. Pokud navážeme na iniciální terapii pokračovací léčbou na 46 týdnů, pak i po jejím ukončení klinický efekt ve fázi follow up trvá u 48 % forem luminálních a 46 % forem fistulujících. To hovoří jednoznačně ve prospěch pokračovací cyklické terapie namísto podání epizodického, kde je remise významně kratší(8). Hanauerova studie4 prokázala, že při jednorázovém podání infliximabu je navozena klinická remise u 11%, při udržovací léčbě u 30 %. Medián doby do relapsu po jednorázovém podání činil 19 týdnů, při udržovací léčbě dávkou 5 mg/kg 38 týdnů a při udržovací léčbě dávkou 10 mg/kg dokonce více než 54 týdnů. Podání obou látek má výrazný steroidšetřící efekt. Tato terapie rovněž snižuje riziko osteopenie/osteoporózy, která doprovází Crohnovu nemoc nejen jako vedlejší účinek léčby, ale také z podstaty nemoci a jejích komplikací(9). Zatímco tyto výsledky byly hodnoceny pomocí klinických indexů aktivity, další hodnocení efektivity infiiximabu u Crohnovy nemoci se týkalo slizničního hojení (Crohrís Disease Endoscopic Index of Severity). Výsledky ukázaly, že indukční terapie třemi dávkami infiiximabu (podobně iniciační léčby adalimumabem) vedla k endoskopickému zlepšení u 76 % (jedna dávka pouze u 32 %), při prodloužení terapie do udržovací fáze pak endoskopické hojení dosahovalo v 54. týdnu dokonce 93 %. Úplného slizničního vyhojení přitom bylo dosaženo ve 4. týdnu po jejím ukončení u 29 % léčených. Jestliže byla léčba epizodická, pak v 54. týdnu bylo úplné slizniční vyhojení přítomno u 18 %, kdežto při léčbě cyklicky opakované 44 %. Tyto výsledky jasně hovoří ve prospěch léčby opakované, cyklické. Protože řada nemocných s Crohnovou chorobou musí být léčena chirurgicky, a to také opakovaně, byla zkoumána také otázka rizika pooperačních komplikacích spojených s terapii infiiximabem. Marchalova reference(10) provedla srovnání a dospěla k závěru, že předchozí léčba infliximabem nezvyšuje riziko pooperačních komplikací, k podobným závěrům dospěla práce Colombela a spolupracovníků(11). V současné době je široce diskutována kombinace terapie infiiximabu s imunosupresivy. Původní představa, že po navození remise iniciační terapie infiiximabem převezme úlohu fungující profylaxe imunosuprese thiopuriny, se ukázala jako lichá. Práce Lémana(12) na souboru 117 pacientů léčených úspěšně iniciační dávkou infiiximabu totiž ukázala, že tato léčebná strategie, označovaná jako bridging terapie, je úspěšná v 57 % pouze u tzv. imunosupresivně naivních pacientů, tedy těch, kteří dosud imunosupresiva neužívali. Naproti tomu u dříve imunosupresivem léčených se přechod na efektivní imunosupresi podaří pouze ve 27 %. Při dlouhodobé kombinaci (více než 6 měsíců) se nepotencuje účinek obou léků ani nesnižuje tvorba protilátek(13). Nejnovější práce navíc upozorňují na růst rizika lymfomů při dlouhodobém souběhu terapie azathioprinem a infiiximabem(14). V roce 2007 byla publikována práce o výsledcích terapie Crohnovy nemoci infiiximabem v dětském věku(15). Prokázala ještě vyšší účinnost této biologické terapie než u dospělých (klinická odpověď na iniciační terapii 88,4 %, remise 58,9 %, přetrvávající remise v 54. týdnu 55,8 %).
Ulcerózní kolitida (UC)
Studie ACT 1 hodnotila efektivitu infiiximabu v léčbě středně a vysoce aktivní UC (hodnocení bylo pomocí Mayo indexu), léčba probíhala ve třech skupinách (placebová, infiiximab 5 mg/kg, infiiximab 10 mg/kg). Statisticky významný byl rozdíl účinné látky vůči placebu, léčebná odpověď v 8. týdnu dosáhla 61,5 % a 69,4 %, remise pak ve 32,0 % a 38,8 %. Rozdíly mezi zvolenými dávkami nebyly statisticky významné. Ještě ve 30. týdnu léčby dosahovala remise stále průměru 35 %. ACT 2 studie doplnila výsledky o hodnocení klinické odpovědi na léčbu infiiximabem ve 30. týdnu léčby u souboru 364 nemocných s UC, kteří byli rezistentní na terapii aminosalicyláty, kortikosteroidy a imunosupresivy Klinická odpověď dosáhla 60 % ve skupině s dávkou 10 mg/kg a 47,1 % ve skupině s dávkou 5 mg/kg. Procento dosažených remisí bylo ve skupině s vyšší dávkou 35,8 %, u nižší dávky dosáhlo 25,6 %. Zajímavé bylo zjištění, že slizniční hojení byla detekována u 46,3 %, resp. 56, 3 %, s aktivní terapii infiiximabem, což vlastně převýšilo výskyt klinických remisí. V roce 2005 použil Járnerot(16) infiiximab jako záchrannou terapii fulminantního průběhu ulcerózní kolitidy Rychlý nástup účinku léčby vedl ve skupině léčených k poklesu nutnosti chirurgického řešení na 29 %, zatímco ve skupině placebové bylo operováno 67 %. Je však otázka, nakolik tato léčba mění dlouhodobou prognózu těchto pacientů. V této oblasti jsou už literární reference skeptičtější(17).
Adalimumab
Jedná se o rekombinantní humánní monoklonální protilátku proti TNF-α třídy IgG. Adalimumab se podává ve formě subkutánní injekce pravidelně po 14 dnech, indukční léčba zahrnuje dvě dávky. První 80-160 mg, druhá 40-80 mg, pokračuje se dávkou 40 mg. V přípravě jsou injekční pera pro jednoduchou aplikaci pacientem.
Podobně jako u infiiximabu, také adalimumab disponzuje řadou studií, ze kterých vyplývají základní indikace revmatologické, gastroenterologické a také dermatologické. Celkem bylo do studií zařazeno 5293 nemocných. V České republice je od letošního roku schválen pro léčbu Crohnovy nemoci při neodpovídavosti nebo nemožnosti použít léčbu infiiximabem.
- Crohnova choroba - k dispozici jsou především studie CLASSIC I, II, CHARM, GAIN.
Crohnova choroba
V těsné návaznosti byly studie CLASSIC I(18) a CLASSIC II(19). První z nich prokázala, že indukční léčba Crohnovy nemoci adalimumabem v dávce 160 mg v týdnu 0 a 80 mg v týdnu 2 je signifikantně vysoce efektivní v navození remise oproti placebu. U souboru 229 nemocných naivních k léčbě TNF-antagonisty byla remise navozena ve 36 % (placebo ve 12 %). V návaznosti na tuto studii CLASSIC II prokázala, že podávání dávky 40 mg adalimumabu u 55 nemocných se středně těžkou a těžkou Crohnovou nemocí, reagujících na indukční terapii, vedlo k udržení remise po dobu 56 týdnů významně výš než ve skupině placebové (79 % vs. 44 %). Studie CLASSIC II ukázala důležitý fakt, totiž že počet navozených remisí v průběhu jednoho roku od zahájení léčby stále stoupá.
Studie CHARM(20) sledovala 449 nemocných, kteří pozitivně zareagovali na indukční terapii adalimumabem. Při pokračovací léčbě 40 mg adalimumabu jednou týdně nebo jednou za 14 dnů bylo dosaženo následujících výsledků: Ve 26. týdnu činil počet remisí u léčených 47 %, resp. 40 %, v 56. týdnu pak 41 %, resp. 36 % (analogické výsledky ve skupině placeba činily 17 % a 12 % v jednotlivých hodnocených intervalech). Navíc ve 26. týdnu bylo možné zahájit refrakci až eliminaci léčby kortikosteroidy takže na konci sledování bylo 29 % léčených bez kortikosteroidní terapie. Adalimumab byl efektivní v léčbě pištěli, které se při jeho použití zhojily na konci studie ve 33 %, resp. 31 %.
Studie GAIN(21) prokázala, že 20 % nemocných ztrácejících odpověď na léčbu infiiximabem zareagovalo pozitivně na léčbu adalimumabem.
Na základě všech studií je považována podávání adalimumabu jednou za 14 dnů za srovnatelně účinné s aplikací jednou týdně.
Ulcerózní kolitida
Studie na použití adalimumabu při ulcerózní kolitidě probíhají.
Certolizumab pegol
Je humanizovaný Fab fragment monoklonální protilátky anti TNF-α, který je navázán na dvě molekuly polyetylenglykolu, což významně prodlužuje biologický poločas molekuly. Účinná látka se podává jako subkutánní injekce jednou za 4 týdny v dávce 400 mg.
- Crohnova choroba - k dispozici jsou závěry studií PRECISE l-4(22).
PRECISE 1 u nemocných s aktivní Crohnovou chorobou prokázala účinnost certolizumabu vůči placebu. Remise ve 4. týdnu léčby dosáhla 19,5 % a ve 26. týdnu 29,5 %. Léčebná odpověď činila ve stejných obdobích 28,7% a 37,2 %. PRECISE 2 sledovala léčebnou odezvu při pokračování léčby u pacientů, kteří odpověděli pozitivně na úvodní dvě dávky. Pozitivní léčebné odpovědi ve 26. týdnu terapie dosáhlo 62,8 % léčených s remisí ve 47,9 %. PRECISE 3 navázala na výsledky předchozí studie, když pokračovala v udržovací terapii certolizumab em u pacientů, kteří odpovídali na léčbu ve 26. týdnu. Účinná látka jim byla aplikována až do 80. týdne, kdy stále činila léčebná odpověď 44,2 %, přičemž v remisi setrvalo 37,2% nemocných. Design PRECISE 4 byl zajímavý tím, že hodnotil efekt neindukční terapie u pacientů, kteří ve studiích PRECISE 1 a 2 ztratili léčebnou odpověď. Reindukce spočívala v podání subkutánní injekce certozulimabu v týdnech 0, 2, 4 a dále vždy jednou měsíčně. V 52. týdnu dosáhlo remise 11,4 % rezistentních v PRECISE 1 a 34,7 % rezistentních v PRECISE 2. Výsledek je, zejména u PRECISE 2, překvapivě dobrý.
Onercept
Je perorální anti TNF protilátka - dekapeptid, rekombinantní forma lidského solubilního p55 TNF receptoru. Snižuje TNF a interferon gama. Rutgeerts et al.(23) podávali látku 12 nemocným s aktivní Crohnovou chorobou v dávce 11,5 mg nebo 50 mg 3x týdně po dobu 14 dnů. Následně byli nemocní sledování 6 měsíců V obou skupinách dramaticky klesly hodnoty CDAI (o 100 bodů) v průběhu 6 týdnů, remise dosáhlo 7 nemocných.
INHIBITORY ADHEZIVNÍCH MOLEKUL
Tato skupina představuje blokátory integrinů, které jsou nutné k migraci leukocytů z kapilárního řečiště do tkáně. Čtyři randomizované studie sledovaly efektivitu natalizumabu.
Natalizumab
Je humanizovaná monoklonální protilátka IgG proti adhezivní molekule α4β1 integrinů. Látka byla použita ve čtyřech randomizovaných studiích, které potvrdily pozitivní vliv infuzí v dávce 3-4 mg/kg/den v opakovaném podání u aktivní Crohnovy nemoci. Protože u tří nemocných léčených natalizumabem (dva se sklerosou multiplex, jeden s Crohnovou nemocí) došlo k progresivní multifokální leukoencefalopatii (u dvou s úmrtím), byl natalizumab zatím schválen pouze pro léčbu sclerosis multiplex, nikoli pro Crohnovu chorobu(24).
NEŽÁDOUCÍ ÚČINKY A OTEVŘENÉ OTÁZKY BIOLOGICKÉ TERAPIE U IDIOPATICKÝCH STŘEVNÍCH ZÁNĚTŮ
Nežádoucí účinky uvedených biologických medikamentů a s nimi spojené otazníky kolem léčebné strategie lze shrnout do následujících skupin:
Infuzní reakce
Z 1678 nemocných, kteří obdrželi 11 253 infuzí infiiximabu, mělo okamžitou infuzní reakci 20,5 %. Druhou možností vedle okamžité reakce v průběhu podání ifliximabu, nebo bezprostředně poté je riziko tzv. reakce oddálení přecitlivělosti v období 3.-5. dne po jeho podání, připomínající příznaky virové infekce. Vyskytuje se však pouze asi v 1,2 % případů.
Pozoruhodná je možnost snížit výskyt infuzních reakcí pomocí terapie kortikosteroidy a zejména imunosupresivy Za zmínku stojí také poznatek ze závěrů studie ACCENT II, podle něhož současná antibiotická terapie zvyšuje riziko poinfuzních reakcí dvoj/trojnásobně.
Vznik infuzních reakcí souvisí s tvorbou protilátek.
Protilátky proti biologické terapii a druhotná ztráta léčebné odpovědi
Sérový infliximab může interferovat s detekcí a interpretací protilátkové odpovědi, protože obsahuje antigenní náboj, zejména v podobě myších sekvencí. Kumulativní incidence vzniku ATI v různých studiích a režimech podání je hodnocena na úrovni 61 %.
Vyšší výskyt protilátek proti infliximabu souvisí s vyšším výskytem infuzních reakcí a snižováním léčebné odpovědi, resp. druhotnou ztrátu odpovědi. Primární neodpovídavost na terapii anti-TNF-α dosahuje až 20 %, druhotná ztráta pak dosahuje až 30 %. Protilátky proti adalimumabu byly detekovány pouze ve 3,4 % léčených, proti certolizumabu v 8-14 %. Tyto skutečnosti jsou důvodem, proč v případě ztráty odpovědi na infliximab resp. alergické reakci je metodou volby přechod (switch) na adalimumab. Tvorba protilátek může být snížena současným podáváním kortikosteroidů event. imunosupresivní léčby, nicméně již zmíněná studie IMID(13) neprokázala pozitivní vliv kombinace azathioprin + infliximab na snížení odpovědi, resp. alergické reakce.
Otázka druhotné ztráty léčebné odpovědi nabývá na aktuálnosti, jak rostou počty nemocných léčených cyklickou terapií. Při jejím vzniku v případě infliximabu se doporučuje intenzifikace dávky (z 5 mg/kg na 10 mg/kg), zkrácení intervalů podávání eventuálně přechod na jiný anti-TNF-α preparát. Zajímávaje pozitivní zkušenost studie PRECISE 4 s neindukční léčbou certulizumabem, které již byly zmíněny.
Vážné infekce
Výsledky kontrolovaných studií ukázaly, že riziko vážných infekčních komplikací je relativně malé - kolem 6,2 % (v placebové skupině 6,8 %). Rizikové jsou generalizované latentní virové infekce viry herpes zoster a cytomegalovirem. U adalimumabu je popsáno riziko reaktivace chronické hepatitidy typu B. Výrazná pozornost je věnována riziku manifestace latentní tuberkulózy, které sice dosáhlo maximálně 1 %, nicméně pro svou závažnost je dnes důvodem pro vstupní plicní vyšetření a následných pravidelných kontrol během biologické terapie anti-TNF-α.
Kardiovaskulární komplikace a neurologické komplikace
Poměrně časté jsou návaly a hypertenze (26 %), méně časté hypotenze, synkopy, palpitace, bradykardie, vazospazmy, vznik hematomů a petechií. U 24 % léčených infliximabem byly registrovány jako vedlejší účinky cefalea a vertigo, vzácně pak amence, somnolence, amnézie, apatie a deprese. Relativně vysoké procento výskytu těchto nežádoucích účinků vyvažuje fakt, že prakticky nevedly k přerušení či ukončení léčby.
Autoimunita
Po biologické léčbě anti-TNF-α se může objevit pozitivita ds-DNA (do 12 %) event. lupus like syndrom, který je však registrován do 0,5 % případů. Ojediněle byly pozorovány případy motýlového exantému, lupus like syndromu a pleuroperikarditidy.
Malignity U nemocných léčených infliximabem bylo Colombelem v roce 2003(11) vyhodnoceno
500 nemocných na vznik nádorových onemocnění. Registrovány byly pouze 3 případy,
jeden s Hodgkinským lymfomem, dva s rakovinou plic. Nebylo prokázáno, že by
přípravky blokující TNF zvyšovaly riziko nádorového onemocnění. Nicméně ve
skupině kuřáků s chronickou bronchitidou, léčených těmito přípravky, byl
zjištěn častější výskyt nádorů zejména v oblasti hlavy, plic a krku. Proto je u
této rizikové skupiny pacientů doporučována opatrnost při léčbě blokátory TNF.
Za nevyřešený problém je třeba považovat riziko vzniku lymfoproliferativních
chorob při dlouhodobé anti-TNF-α terapii. Opakovaně citované je hlavně riziko
tzv. hepatosplenického T-lymfomu. Jedná se vysoce maligní onemocnění s fatálním
průběhem s hepatosplenomegalií bez lymfadenopatie a s progredující
pancytopenií. Jedenáct případů bylo registrováno při léčbě infliximabem a
thiopuriny14. Kombinace s chirurgickou léčbou Otázka je dosud otevřená u adalimumabu a certulizumabu, nicméně studie
Marschalova10 a Colombelova(11) nepotvrdily, že by konkomintantní léčba
infliximabem nepříznivě ovlivňovala pooperační průběh a komplikace u nemocných
s Crohnovou chorobou. Biologická terapie u střevních stenóz Problém je navozen skutečností, že efektivní anti-TNF-α terapie navozuje
relativně rychlé hojení s převahou regulačních-fibroproduktivních cytokinů a
rizikem progrese stenóz, resp. vazivových změn. Přesto podle Hanauerových
zkušeností4 je riziko klinicky významné progrese stávajících stenóz nebo
vzniku nových na lačníku minimální.LITERATURA
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users