Transplantace střevní mikrobioty – historie, současnost a budoucnost
Roman Stebel1, Lenka Vojtilová Orcid.org 1, Petr Husa1
+ Pracoviště
Souhrn
Narušení mikrobiálního ekosystému střeva dnes představuje významný patogenetický faktor řady onemocnění. Známá je úloha alterace intestinální mikrobioty u rekurentní klostridiové kolitidy (rCDI – recurent Clostridioides difficile infection). Přenosem stolice od zdravého dárce do zažívacího traktu nemocného dokážeme navrátit přirozenou homeostázu střevní mikrobioty, a tím efektivně přerušit „bludný kruh“ chronicky relabující klostridiové infekce. Do budoucna očekáváme dominantně perorální způsob podání fekálního transplantátu v podobě enterosolventních kapslí či komerčně vyráběných fekálních derivátů. Tato cesta podání minimalizuje riziko nežádoucích komplikací, které vzácně pozorujeme při administraci suspenze stolice nazoenterální sondou, endoskopicky nebo rektálním klyzmatem. V posledních letech je transplantace střevní mikrobioty testována i u dalších chorobných stavů, jejichž patogeneze je pravděpodobně asociována s intestinální dysbiózou. V tomto smyslu jsou nejčastěji diskutovány idiopatické střevní záněty, syndrom dráždivého tračníku, jaterní encefalopatie a v posledních letech i „civilizační nemoci“, jako jsou diabetes mellitus 2. typu, roztroušená skleróza, Parkinsonova nemoc či metabolický syndrom. Efekt fekální bakterioterapie je pozorován i při eradikaci multirezistentních bakteriálních kmenů kolonizujících střevo pacientů. U rCDI je dnes v rámci medicíny založené na důkazech fekální bakterioterapie celosvětově akceptovaným a doporučovaným terapeutickým postupem. U ostatních onemocnění se jedná stále o metodu experimentální, na přesvědčivé výsledky randomizovaných kontrolovaných studií prozatím čekáme.
Klíčová slova
Clostridioides difficile, dysbióza, fekální transplantace, mikrobiální léková rezistence, pseudomembranózní enterokolitida, střevní mikroflóraÚvod
Díky moderním sekvenačním metodám (využívají znalosti nukleotidové sekvence genu kódujícího 16S podjednotku ribozomální RNA) dnes víme, že lidský organizmus je osídlen různými symbiotickými mikroorganizmy, přičemž počet buněk mikrobů převyšuje počet lidských buněk nejméně 10násobně [1]. Jedná se o tzv. mikrobiotu, komplexní společenství mikroorganizmů přežívajících v různých částech hostitele. Mluvíme tak např. o mikrobiotě (či starším názvem mikroflóře) střevní, kožní, respirační nebo urogenitální. Pod pojmem mikrobiom pak rozumíme kompletní set genů všech mikrobů, které jsou součástí mikrobioty. Odhaduje se, že jen v lidském střevě žijí desítky tisíc druhů bakterií, virů, prvoků a mikroskopických hub. Ve zdravém lidském střevě jsou zastoupeny především dva hlavní bakteriální kmeny – Firmicutes a Bacteroidetes [2].
Byla prokázána řada mechanizmů, kterými se mikrobiota podílí na životních pochodech organizmu člověka. Je známa funkce při metabolizmu živin a xenobiotik, biosyntéze vitaminů a stimulaci obnovy střevního epitelu. Mikroorganizmy také ovlivňují střevní motilitu a prokrvení sliznice, trvale modulují imunitní systém, tvorbou substrátů se účastní výživy buněk sliznice střeva a zasahují rovněž do metabolizmu žlučových kyselin [3]. Mezi další klinicky významné funkce střevní mikrobioty patří produkce mastných kyselin s krátkým řetězcem (SCFA – short chain fatty acids) a zajištění tzv. kolonizační rezistence (ochrany před invazí obligátních patogenů i přerůstáním komenzálních mikrobů) [2].
Složení střevního mikrobiálního ekosystému je u každého jedince unikátní a po 1. roce života zůstává dlouhodobě relativně stabilní [3]. V momentě závažného narušení složení nebo funkce mikrobioty, ke které dochází nejčastěji v důsledku antibiotické (ATB) terapie (ale také během protinádorové chemoterapie, při poruše střevní peristaltiky či při zásadní a dlouhodobé změně ve složení stravy), mluvíme o tzv. dysbióze [4].
Fekální bakterioterapie
Terapeuticky zasáhnout na úrovni alterované střevní mikrobioty se snažíme různými způsoby. U jaterní encefalopatie podáváme specifická ATB (např. rifaximin), v rámci prevence a léčby postantibiotických průjmů využíváme probiotika, syndrom dráždivého tračníku se snažíme ovlivnit změnou stravovacích návyků s dostatečným zastoupením vlákniny v potravě [5]. Jako velmi nadějná se jeví metoda mající za cíl dosáhnout restituce přirozené mikrobiální homeostázy v tlustém střevě pomocí stolice od zdravého dárce, která je přenesena do zažívacího traktu nemocného. Pro tuto metodu se u nás vžil název fekální bakterioterapie. V zahraniční literatuře se nejčastěji setkáváme s označením Fecal Microbiota Transplantation (FMT) [6].
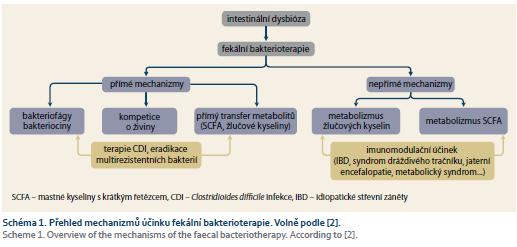
Aktuálně během FMT manipulujeme se střevní mikroflórou do značné míry nespecificky, předpokládáme, že přenosem stolice od zdravého člověka do trávicího traktu nemocného dokážeme „opravit“ narušenou rovnováhu střevního mikrobiálního ekosystému [5]. Mechanizmy, kterými FMT dokáže léčit, jsou předmětem intenzivního výzkumu. Účinnost FMT v léčbě mnoha onemocnění dnes vysvětlujeme řadou cílených sofistikovaných mechanizmů. Jejich zjednodušený přehled znázorňuje schéma 1. Mezi přímé mechanizmy (nezávislé na hostiteli) řadíme kompetici s patogenními bakteriemi o živiny a blokování adherence patogenů na povrchu epitelu střeva, účinek specifických enzymů a peptidů se selektivním antimikrobiálním účinkem (tzv. bakteriocinů) a v neposlední řadě i působení bakteriofágů (virů s lytickým účinkem na některé bakterie). Mezi často diskutované nepřímé mechanizmy pak patří zejména ovlivnění metabolizmu SCFA a žlučových kyselin ve střevě [4].
SCFA vznikají v tlustém střevě činností bakteriální mikroflóry při fermentaci nestravitelných sacharidů. Mezi nejvýznamnější patří acetát a propionát (produkované kmenem Bacteriodetes) a butyrát (produkovaný Firmicutes) [2]. SCFA vykazují imunomodulační účinek, inhibují produkci prozánětlivých cytokinů a zvyšují zastoupení regulačních CD4+ T lymfocytů ve sliznici střeva. Stimulací proliferace střevních epiteliálních buněk dále posilují bariérovou funkci střevní stěny [4].
Důležitou úlohu v regulaci homeostázy intestinální mikrobioty sehrávají rovněž žlučové kyseliny. Primární žlučové kyseliny (kyselina cholová, chenodeoxycholová) se dostávají do střeva spolu se žlučí. V tenkém střevě usnadňují trávení lipidů a vitaminů rozpustných v tucích, z 95 % jsou pak v distálním ileu reabsorbovány zpátky enterohepatálním oběhem. Zbylých 5 % je v tlustém střevě činností bakterií vybavených 7α-dehydroxylázovým enzymovým komplexem transformováno na sekundární žlučové kyseliny (zejména kyselinu lithocholovou). Ty vykazují rovněž imunomodulační účinek, inhibují produkci prozánětlivých cytokinů a regulují růst některých bakterií [2]. Je známo, že primární žlučové kyseliny podporují germinaci spor Clostridioides difficile. Naopak sekundární žlučové kyseliny jsou potentním inhibitorem růstu i klíčení klostridií. U pacientů s rekurentní klostridiovou kolitidu (rCDI – recurent Clostridioides difficile infection) v důsledku těžké dysbiózy chybí v tračníku bakterie vybavené potřebnými enzymy pro přeměnu (dekonjugaci a dehydroxylaci) primárních žlučových kyselin na sekundární, ve stolici těchto pacientů tak nacházíme jen minimum sekundárních žlučových kyselin. Po FMT dochází ke zvýšení jejich zastoupení jednak úpravou dysbiózy, ale také jejich přímým transferem do střeva se stolicí zdravého dárce [7].
Historie
Střevní mikrobiom a jeho vztah ke zdraví člověka se dostal do středu pozornosti medicíny založené na důkazech teprve nedávno. Z historických pramenů ale víme, že již naši dávní předkové využívali přenos stolice k léčbě řady onemocnění. První historické zmínky o léčebném využití stolice pocházejí ze 4. století n. l., kdy staří Číňané podávali lektvary s lidskou stolicí perorální cestou nemocným s otravami a těžkými průjmy [3]. V 16. století pak jeden z významných čínských myslitelů Li Shizhen podával preparáty z lidské stolice (čerstvé nebo fermentované) nemocným s bolestmi břicha, zvracením a zácpou. Tyto přípravky nazýval „žlutou polévkou“. V historii moderní medicíny je pak z hlediska využití FMT průlomový rok 1958, kdy americký chirurg Ben Eiseman podal stolici zdravého dárce formou klyzmatu čtyřem pacientům s blíže nespecifikovanou kolitidou [6]. Využití FMT v léčbě CDI pak bylo podrobněji popsáno v roce 1981 Bowdenem. První použití FMT v rámci neinfekčního onemocnění se datuje do roku 1989, kdy Bennet trpící refrakterní ulcerózní kolitidou (UC – ulcerative colitis) realizoval sám na sobě „výměnu střevní mikroflóry“ s pozitivním klinickým efektem [8]. Od té doby bylo publikováno nepřeberné množství kazuistik a případových studií popisujících úspěchy léčby řady chorob pomocí FMT.
Současnost
Dle doporučení Evropské společnosti pro klinickou mikrobiologii a infekční nemoci (ESCMID – European Society of Clinical Microbiology and Infectious Diseases) je FMT (po předchozí léčbě vankomycinem či fidaxomicinem) metodou volby u rCDI [9]. V patogenezi rCDI je dnes za klíčový považován interval zvýšené „zranitelnosti“ střeva („the window of vulnerability“) po ukončení léčby ataky kolitidy. Tato perioda začíná v okamžiku dosažení subinhibiční hladiny ATB použitého k léčbě v tlustém střevě a končí až plnou restitucí střevní mikroflóry přibližně po 8 týdnech. K léčbě CDI v současnosti používáme ATB, která kromě účinku na C. difficile působí destruktivně i na řadu dalších bakterií, jež jsou součástí střevní mikrobioty. Klostridia ale i po léčbě přežívají ve střevě v podobě vysoce odolných spor. V terénu perzistující dysbiózy se tyto spory mohou velmi rychle vyvinout do vegetativních forem a začít opětovně produkovat toxiny, mluvíme pak o relapsu CDI. V tomto intervalu může také snadno dojít k reinfekci (nová infekce z vnějšího prostředí). Období zvýšené vulnerability střeva představuje nejvhodnější moment, kdy můžeme terapeuticky zasáhnout pomocí FMT a obnovením ochranné funkce intestinální mikrobioty zabránit rekurenci onemocnění [10].
Po první epizodě CDI dochází k recidivě přibližně u 20 % nemocných, u druhé a další epizody již riziko stoupá až k 60 % [11]. Pacient s opakovanými atakami CDI postupně fyzicky i psychicky strádá, rozvíjí se malnutrice, hypoalbuminemie, často zůstává imobilní na lůžku. Rozvíjí se postupně bludný kruh, kdy recidivu CDI střídá jiná nozokomiální infekce s nutností další širokospektrální ATB terapie, která dále potencuje přítomnou dysbiózu. Účinnost FMT (absence rekurence CDI v intervalu 8 týdnů po podání fekálního transplantátu) dle metaanalýz dosahuje až 90 % [2]. Transplantace střevní mikrobioty se dnes stala v řadě zemí rutinní součástí péče o pacienty s rCDI. Přesto je FMT stále doprovázena řadou medicínských, etických a právních otázek. Nejedná se o metodu globálně standardizovanou. V rámci ČR byl oficiální doporučený postup FMT pro léčbu rCDI publikován Společností infekčního lékařství České lékařské společnosti J. E. Purkyně teprve v roce 2018 [12].
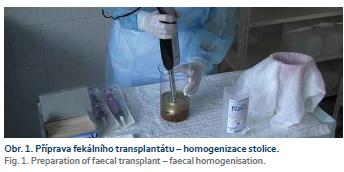
Z medicínského hlediska probíhají intenzivní diskuze na téma výběru optimálního dárce stolice, použití čerstvé nebo zamrazené suspenze stolice, rozsahu vyšetření dárce a způsobu přípravy pacienta před FMT. Diskutabilní je rovněž cesta podání fekálního transplantátu do trávicího ústrojí nemocného. Každý pacient i dárce musí být před FMT důkladně poučen o průběhu procedury a seznámen s přínosy i možnými riziky, což stvrzuje podpisem informovaného souhlasu. Dárce stolice by měl být ideálně zcela zdráv, neměl by v posledních 3 měsících užívat ATB a neměl by trpět žádnými zažívacími obtížemi. Každý dárce je předem vyšetřen s cílem eliminovat zejména možná rizika přenosu infekčních nemocí na pacienta. Vyšetření zahrnuje odběr kompletní anamnézy, klinické vyšetření (tab. 1) a laboratorní testy, které by neměly být starší 4 týdnů (tab. 2) [5,12]. Výběr vhodného dárce stolice je i problémem etickým. V případě příbuzného dárce (nejčastěji se jedná o dospělá vnoučata pacientů) pozorujeme lepší přijatelnost procedury a současně určitý psychologický efekt na straně pacienta (léčíme ho materiálem získaným od člověka, kterého zná a o kterém ví, že je zdravý) i na straně rodiny (může se aktivně, konkrétními činy zapojit do péče o svého příbuzného). V případě příbuzného dárce aplikujeme zpravidla čerstvou suspenzi stolice zpracovanou ihned po získání vzorku, přičemž cca 100 g stolice homogenizujeme mixérem s 200 ml sterilního nebakteriostatického krystaloidního roztoku (fyziologický roztok, voda). Proces homogenizace stolice ponorným mixérem ilustruje obr. 1. K odstranění nežádoucích příměsí je směs následně přefiltrována přes několikavrstvou gázu. Podání čerstvé suspenze stolice by mělo proběhnout ideálně do 6 hod od defekace [12]. Koncept „univerzálního dárce“ vychází z možnosti skladovat zamrazenou stolici podrobně vyšetřeného dárce po dobu až 6 měsíců. Literatura připouští možnost skladovat při −80 °C buď samotnou nativní stolici, nebo již hotovou suspenzi určenou k FMT, ke které je přidán 10% glycerol zabraňující tvorbě ledových krystalků [13]. Použití zamrazené stolice má nezpochybnitelnou výhodu v možnosti operativně aplikovat FMT prakticky kdykoli, bez limitací daných časovými možnostmi dárce. Účinnost FMT při použití zamrazené stolice je přitom srovnatelná s použitím čerstvého materiálu [14]. V posledních letech se v zahraničí setkáváme s institucemi, které deponují dle jednotných standardů připravené vysoce kvalitní suspenze stolice získané od podrobně vyšetřených a předem podle přísných kritérií vybraných dárců. Tyto tzv. banky stolice (ve Spojených státech neziskový projekt OpenBiome, v Evropě např. The Netherlands Donor Feces Bank) jsou následně schopny doručit kurýrní službou k aplikaci přichystaný zamrazený fekální transplantát prakticky kamkoli. Centrálně přitom monitorují případné nežádoucí události po FMT a nabízejí individuální konzultaci při plánování optimální strategie péče o pacienta s rCDI [2].
Existuje několik způsobů, jak připravený roztok stolice aplikovat do trávicího traktu pacienta. Zjednodušeně můžeme způsob aplikace rozdělit na podání do horních etáží trávicí trubice (nazoenterální sondou nebo ve formě enterosolventních kapslí) a na aplikaci do tlustého střeva přes konečník (endoskopicky či retenčním klyzmatem). V literatuře se můžeme setkat se studiemi, které privilegují administraci cestou koloskopie s aplikací fekálního transplantátu do oblasti céka a následnou rekolonizací celého tračníku. Je popisován i pozitivní efekt ortográdního vyprázdnění střeva osmotickými laxativy (makrogolem) s eliminací reziduálních toxinů a spor C. difficile a následným snadnějším „přihojením“ fekálního transplantátu při redukovaném objemu intestinální mikrobioty [2,15]. Koloskopie je nicméně relativně invazivním a nákladným zákrokem, který v terénu odeznívajících zánětlivých změn střevní stěny vykazuje vysoké riziko komplikací (krvácení, iatrogenní perforace střeva). Jistou, méně invazivní alternativou je aplikace FMT pomocí sigmoideoskopie či u nás běžnějším retenčním klyzmatem. V literatuře nacházíme randomizované kontrolované studie, které nicméně neprokázaly statisticky významný rozdíl v úspěšnosti FMT v závislosti na způsobu podání [16]. Vodítkem k výběru cesty podání FMT by tak mělo být zejména zhodnocení rizika periprocedurálních komplikací u konkrétního jedince. Stále častěji se také setkáváme s využitím enterosolventních kapslí. Tato perorální forma podání je dle aktuálních výsledků srovnatelně úspěšná s aplikací sondou do tenkého střeva či koloskopicky do tračníku, současně ale odpadá diskomfort a rizika spojená s endoskopickým zákrokem. Nevýhodou může být nutnost polykat relativně velké množství kapslí [17].
Pacienti jsou před FMT standardně léčeni 10 dní cílenou ATB terapií. FMT by měla být podána ideálně až po 48 hod od poslední dávky ATB. Některé studie prokázaly přítomnost vankomycinu intraluminálně ve střevě ještě 4. den po ukončení jeho podávání orální cestou s možným negativním ovlivněním během FMT přenesené mikroflóry [12,13]. Další příprava pacienta se odvíjí od formy administrace, přičemž názory na její nutnost se liší. V případě podání do horních etáží trávicí trubice je doporučováno lačnění min. 6 hod před výkonem, podávají se také inhibitory protonové pumpy (večer a ráno před zákrokem). Některá doporučení uvádějí i podání prokinetik (metoklopramidu parenterálně) těsně před výkonem. Před aplikací FMT rektální cestou je fakultativně doporučováno (kromě standardní přípravy střeva osmotickými laxativy nebo salinickým klyzmatem) podání loperamidu per os s cílem přechodně zpomalit střevní peristaltiku, retenční klyzma by měl pacient podržet min. 1 hod. Doporučuje se rovněž lačnění k potlačení gastrokolického reflexu [12].
Prozatím nebyla definována absolutní kontraindikace k FMT, klinické studie potvrdily bezpečnost i u imunokompromitovaných pacientů [1]. Dokumentované závažné nežádoucí události byly ve většině případů asociovány se samotnou procedurou aplikace fekálního transplantátu (aspirace s pneumonií v případě podání do horních etáží trávicí trubice nebo perforace stěny střeva se sterkorální peritonitidou při rektální formě administrace). Mezi častěji pozorované nezávažné komplikace patří zejména mírný břišní diskomfort, flatulence, meteorizmus, nauzea, přechodný průjem nebo obstipace a subfebrilie [1,5].
Budoucnost
Očekáváme vývoj FMT hned v několika rovinách. Již dnes pozorujeme zdokonalování způsobu podání fekálního transplantátu. V rámci klinických studií se stále častěji setkáváme s komerčně vyráběnými fekálními deriváty. Jedná se o složením přesně nedefinované, ale pečlivě kontrolované přípravky vyrobené ze stolice desítek důkladně vyšetřených dárců. Fekální deriváty jsou upravovány pro možnost delšího skladování a jednoduššího podání pacientovi, stojí tak určitým způsobem na hranici mezi FMT a probiotiky. Preparát RBX2660 má podobu suspenze živých bakterií získaných ze stolice dárce, je skladován zamrazený a podává se formou retenčního klyzmatu. Odlišný přístup využívá bakteriálních spor, které mohou být v podobě enterosolventních kapslí podány perorálně. Preparát SER-109 obsahuje purifikované spory bakterií z kmene Firmicutes. Stále se ale jedná o preparát relativně nedefinovaný s variabilním mikrobiálním složením. Stejná farmakologická společnost vyvíjí i preparát SER-262, v tomto případě se již jedná o přípravek s definovaným složením – obsahuje 12 druhů bakterií ve formě spor [7]. Budoucnost pak bude s velkou pravděpodobností patřit perorální formě podání FMT – ať již v podobě individuálně připravovaných enterosolventních kapslí se zamrazenou či lyofilizovanou stolicí dárce, nebo komerčně vyráběných fekálních derivátů. Cílem bude zajistit co nejlepší toleranci FMT ze strany pacienta, maximální jednoduchost při aplikaci a současně bezpečnost při standardizovaném screeningu dárců. Lze očekávat také další rozvoj institucí fungujících jako tzv. banky stolice. Ty mají potenciál rozšířit dostupnost FMT i na pracoviště, která s touto metodou nemají zkušenosti, při zachování adekvátní kvality a bezpečnosti.
Budoucnost FMT vidíme ale i v preciznější a cílenější manipulaci s intestinální mikroflórou, což jistě povede k rozšíření indikací o řadu dalších chorobných stavů.
Idiopatické střevní záněty
Mezi onemocnění, která jsou patogeneticky spojena s alterovaným mikrobiálním ekosystémem střeva, patří idiopatické střevní záněty (IBD – inflammatory bowel diseases). U pacientů s Crohnovou nemocí (CD – Crohn’s disease) a UC pozorujeme v tlustém střevě sníženou mikrobiální diverzitu, redukováno je zejména zastoupení anaerobních bakterií [2]. Teorie etiopatogeneze IBD často operují s hypotézou neadekvátní zánětlivé reakce geneticky predisponovaného jedince na některé složky střevní mikrobioty [4]. Modulace střevní mikroflóry pomocí FMT se u IBD nabízí jako slibná terapeutická alternativa zejména u pacientů, kteří nereagují na standardní léčbu. Dostupné metaanalýzy použití FMT u UC však vykazují poměrně rozporuplné výsledky. U CD pak relevantní data z randomizovaných studií prozatím chybí [18]. Moayyediho randomizovaná a placebem kontrolovaná studie z roku 2015 prokázala u pacientů s UC statisticky významný rozdíl v úspěšnosti léčby. U pacientů léčených FMT došlo k remisi v 9 z 36 případů (24 %), ve skupině s placebem ve 2 z 34 (5 %) [19]. Ve stejném roce Rossenovou publikovaná randomizovaná kontrolovaná studie ale statisticky významný rozdíl mezi FMT a placebem neprokázala. U pacientů odpovídajících na léčbu nicméně bylo s odstupem několika týdnu po transplantaci pozorováno podobné složení mikrobioty jako u jejich dárců, u skupiny nereagujících pacientů bylo složení rozdílné [20]. Aktuální situaci dobře ilustruje recentně publikovaná kazuistika, ve které Moutinho et al léčili pomocí FMT pacienta s kombinací primární sklerozující cholangitidy a UC refrakterní k léčbě azathioprinem i biologiky. Po FMT došlo u pacienta k přechodnému klinickému zlepšení, po cca 1 měsíci se ale aktivita onemocnění vrátila do stavu před zákrokem. Po 8 měsících opakovaná FMT již ke klinickému zlepšení nevedla. Pacient zůstal kortikodependentní, po FMT bylo nicméně možné dávky kortikoidů podstatně snížit [8]. V léčbě rCDI v terénu IBD vykazuje FMT obdobné výsledky jako u jedinců bez této komorbidity. U pacientů s IBD byly častěji pozorovány nežádoucí události v podobě bolestí břicha, febrilií a přechodné elevace zánětlivých parametrů (nejspíše v důsledku narušené bariérové funkce střevní stěny). Literatura uvádí i ojedinělé ataky UC s rozvojem v návaznosti na FMT. Není zde ale jasné, zda zhoršení symptomatologie IBD souviselo s fekální bakterioterapií, nebo spíše se samotnou epizodou CDI, která byla léčena [2].
Multirezistentní bakterie
Význam transplantace střevní mikrobioty je studován také u jedné z největších hrozeb současné medicíny – celosvětově narůstající rezistence bakterií k ATB. Jedinci kolonizovaní multirezistentními bakteriálními kmeny (MDRO – multidrug-resistant organisms) jsou v extrémním riziku závažných infekčních komplikací. Mezi nejnebezpečnější patří infekce vyvolané karbapenem rezistentními enterobakteriemi (zejména kmeny Klebsiella pneumoniae) [21]. V rámci ČR se s MDRO setkáváme naštěstí stále ještě vzácně, většinou se jedná o importované nákazy u cestovatelů, kteří byli léčeni (a kolonizovali se) zejména v rozvojových zemích. V případě kolonizace tlustého střeva, kde se MDRO stávají de facto součástí mikroflóry, jsou možnosti jejich eradikace velmi limitované. Nadějné výsledky při dekolonizaci vykazuje právě FMT. Mechanizmy, jakými se fekální bakterioterapie podílí na eliminaci MDRO, zatím přesně neznáme. Jedna z teorií předpokládá restituci fyziologické rovnováhy mikrobiálního ekosystému tlustého střeva s výslednou dominancí kmenů Bacteroidetes a Firmicutes a redukcí zastoupení kmene Proteobacteria, který je hlavním nositelem genů pro rezistence k ATB. Jistý význam je přisuzován i působení specifických bakteriocinů a bakteriofágů z dárcovské stolice [2]. Jednu z mála prospektivních multicentrických studií na toto téma publikovali francouzští autoři Dinh et al v roce 2017. Po 3 měsících od FMT aplikované nazojejunální sondou došlo ve sledovaném souboru k eradikaci karbapenem rezistentních enterobakterií ze střeva u 4 z 8 pacientů. Eradikace vankomycin rezistentních enterokoků byla úspěšnější, po 3 měsících došlo k dekolonizaci 7 z 8 pacientů [22]. Na našem pracovišti byla FMT v této indikaci použita 2×. V obou případech se jednalo o pacienty primárně léčené pro rCDI. Současně ale byli kolonizováni kmeny Pseudomonas aeruginosa s produkcí metalo-β-laktamáz. U jednoho pacienta došlo v intervalu 8 týdnů k dekolonizaci střeva, druhá pacientka bohužel záhy po FMT zemřela.
Syndrom dráždivého tračníku
Patogenetická úloha střevní dysbiózy je diskutována i u syndromu dráždivého tračníku (IBS – irritable bowel syndrome). Ve střevě pacientů s IBS bylo pozorováno nižší zastoupení bakterií produkujících SCFA a současně porušená bariérová funkce střevního epitelu [2]. Jednu z mála randomizovaných kontrolovaných studií využití FMT v léčbě IBS publikovali Johnsen et al. V této studii zaznamenali významný pokles skóre závažnosti IBS po 3 měsících od aplikace fekálního transplantátu od zdravého dárce u 65 % pacientů (36/55). Kontrolní skupině byla podána autologní FMT s úspěšností 43 % (12/28). S odstupem 12 měsíců byl nicméně výsledný rozdíl v úspěšnosti již výrazně menší [23]. Podobně jako u IBD bude i v případě IBS do budoucna klíčová cílenější manipulace s intestinální mikrobiotou.
Jaterní encefalopatie
První vlaštovkou v tomto směru je využití FMT v léčbě jaterní encefalopatie. U pacientů s jaterní cirhózou se ve střevě v důsledku dysbiózy setkáváme s vyšším zastoupením bakterií, které produkují amoniak. Jedná se zejména o čeledi Enterobacteriaceae a Streptococcaceae. Naopak čeledi Lachnospiraceae a Ruminococcaceae jsou spojeny s redukcí hyperamonemie [2,24]. Tím vykazují ochranný účinek proti neuronální dysfunkci, která je podkladem jaterní encefalopatie. Bajaj et al využili ve své studii stolici od pečlivě vybraného dárce s vysokým zastoupením právě těchto „ochranných“ bakterií. U skupiny pacientů léčených kromě standardní terapie jaterní encefalopatie (rifaximin, laktulóza) i pomocí suspenze stolice od tohoto „superdárce“ (aplikované rektálním klyzmatem) bylo pozorováno méně nových epizod jaterní encefalopatie oproti skupině, která pomocí FMT léčena nebyla [25]. Jaterní encefalopatie se tak do budoucna nabízí jako slibná indikace k FMT pomocí fekálního transplantátu o předem definovaném mikrobiálním složení.
Metabolický syndrom
Změny v mikrobiálním ekosystému střeva jsou dnes také dávány do souvislosti s patogenezí jednoho „evergreenu“ vnitřního lékařství – metabolického syndromu. Koincidence obezity abdominálního typu s arteriální hypertenzí, dyslipidemií a poruchami metabolizmu cukrů představuje komplexní a vzájemně propojený proaterogenní, prozánětlivý a prokoagulační stav, který rezultuje ve vysoké riziko kardiovaskulárních onemocnění [2]. V patogenezi metabolického syndromu jsou standardně popisovány jisté genetické dispozice spolu se zevními faktory „západního“ životního stylu – nadměrným energetickým příjmem a nedostatkem pohybové aktivity. Mechanizmy, kterými se intestinální dysbióza podílí na metabolických změnách, dosud podrobně zmapovány nejsou. Předpokládá se změněná schopnost mikrobů metabolizovat některé substráty ve střevě a současně narušení buněčné signalizace zprostředkované nízkomolekulárními látkami vznikajícími činností mikrobů (SCFA, žlučové kyseliny a další). Tyto molekuly se podílejí na regulaci metabolizmu triglyceridů, utilizace hnědé tukové tkáně a homeostáze cukrů. Intestinální mikroflóra je také nezbytná pro fermentaci některých nestravitelných potravin ve střevě za vzniku produktů, které mohou být dále organizmem využity [26]. Některé studie prokázaly, že obézní myši jsou schopny z požité potravy získat více energie oproti neobézní skupině. U myší, kterým byla transplantována mikroflóra od obézních dvojčat, byla také pozorována snížená mikrobiální diverzita ve střevě a zvolna narůstající adipozita. Obezita a inzulinová rezistence u potkanů krmených vysokofruktózovou dietou pak byla ve studiích zvrácena perorální FMT od „štíhlých“ potkanů [26]. Tyto výsledky na zvířecích modelech potvrzují schopnost mikrobioty ovlivňovat metabolický fenotyp jedince. U lidí zatím přesvědčivé výsledky z kontrolovaných studií chybí. Jednu z mála publikovali Vrieze et al v roce 2012. V této studii byl obézním pacientům s diabetes mellitus 2. typu (n = 9) podán nazojejunální sondou fekální transplantát od štíhlých dárců. Kontrolní skupině (n = 9) pak byla podána stejnou cestou vlastní stolice (autologní FMT). Po 6 týdnech nebyl pozorován statisticky významný rozdíl v indexu tělesné hmotnosti (BMI – body mass index) mezi oběma skupinami. U pacientů, kterým byla podána stolice od štíhlých dárců, došlo nicméně k nárůstu diverzity střevní mikrobioty a bylo pozorováno zvýšení citlivost tkání na inzulin (inzulinová rezistence je charakteristickým znakem metabolického syndromu) [27]. Zajímavostí je v roce 2015 publikovaná kazuistika s jinak nevysvětlitelným nárůstem tělesné hmotnosti u dříve štíhlé pacientky, které byl v rámci léčby rCDI podán fekální transplantát od obézního dárce [28]. Dnes je rutinně do protokolů screeningu dárců stolice zakomponován i výpočet BMI (měl by být ideálně < 30) a jedinci s nadváhou či obezitou jsou z dárcovství vyloučeni [12].
Neuropsychiatrická onemocnění
Střevní mikrobiota sehrává důležitou roli i v neurohumorální komunikaci mezi střevem a centrálním nervovým systémem (CNS), mluvíme o tzv. ose střevo–mozek. Narušení této komunikace má podíl na patogenezi řady neurologických a neuropsychiatrických onemocnění. Jako příklad jsou uváděny poruchy autistického spektra – pervazivní poruchy mentálního vývoje dítěte, zdánlivě nijak nesouvisející se zažívacím traktem. U autistických dětí byla zaznamenána narušená diverzita intestinální mikrobioty. V důsledku této dysbiózy byla pozorována excesivní produkce některých mikrobiálních metabolitů, jednalo se zejména o SCFA, para-cresol a amoniak [29]. Autistické děti také častěji trpí chronickými zažívacími potížemi (zácpa, průjmy, syndrom dráždivého tračníku) a dle statistik jsou jim častěji předepisována širokospektrá ATB [2,29]. V roce 2017 Kang et al publikovali otevřenou studii zabývající se možností pozitivně ovlivnit příznaky autismu (a také souběžně se vyskytující zažívací potíže) pomocí různých režimů FMT. Fekální transplantát byl u těchto pacientů podáván několikrát za sebou pomocí nazoenterální sondy i rektálních klyzmat. U autistických dětí ve věku 7–16 let skutečně po FMT došlo ke zlepšení neuropsychiatrických i zažívacích symptomů [30]. Kontrolované randomizované studie potvrzující tyto pozitivní výsledky nicméně nejsou k dispozici. Fekální bakterioterapie se v rámci preklinických studií jeví být potenciálně efektivní i u dalších onemocnění CNS s vysokou pravděpodobností asociovaných s intestinální dysbiózou a dysregulací imunity. V centru pozornosti jsou dnes změny střevní mikrobioty u roztroušené sklerózy (RS) a Parkinsonovy nemoci. U pacientů s aktivní RS byla pozorována střevní dysbióza rezultující v patologickou aktivaci řady imunitních mechanizmů. Tento prozánětlivý stav je spojován i s patogenezí Parkinsonovy nemoci, u ní v důsledku mitochondriální toxicity (mezi jinými) dochází k degeneraci dopaminergních neuronů v bazálních gangliích [2]. Neuroprotektivní a protizánětlivé účinky FMT jsou nicméně u těchto nemocí podloženy pouze jednotlivými kazuistikami.
Závěr
Velmi obtížně dnes nalezneme klinickou jednotku, u níž by se FMT min. v rámci základního výzkumu či experimentu na zvířatech netestovala. Pro použití FMT v klinické praxi nicméně musíme vycházet z medicíny založené na důkazech. Výsledky robustních kontrolovaných klinických hodnocení dnes máme prozatím jen u léčby rCDI. V této indikaci je FMT mezinárodně uznávaným a doporučovaným léčebným postupem [12,13], který je již v řadě zemí (a od 1. 1. 2020 bude i v rámci ČR) financován z prostředků veřejného zdravotního pojištění. Fekální bakterioterapie je metodou velmi bezpečnou. Z dlouhodobého hlediska však dopady FMT (zejména v oblasti interakce s imunitním systémem a metabolizmem hostitele) odhadnout neumíme. Všichni pacienti by po FMT měli být dlouhodobě klinicky sledováni. Dispenzarizace má za cíl jednak exaktně dokumentovat terapeutický účinek, současně ale také aktivně pátrat po výskytu případných nežádoucích komplikací [12]. Ve chvíli, kdy budeme schopni dokonale zmapovat mikrobiom daného jedince a budeme přesně vědět, jaké jeho změny vedou k predispozicím či rozvoji konkrétních chorobných stavů, budeme moci cíleně do mikrobioty zasáhnout podáním definované, na míru připravené směsi mikrobů. Lze tak očekávat, že FMT najde v budoucnu své místo v prevenci či léčbě řady onemocnění nejen gastrointestinálního traktu.
Doručeno/Submitted: 9. 8. 2019Přijato/Accepted: 23. 9. 2019
MUDr. Roman Stebel
Klinika infekčních chorob LF MU a FN Brno
Jihlavská 20
625 00 Brno
stebel.roman@fnbrno.cz

Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Rao K, Young VB. Fecal Microbiota transplantation for the management of Clostridium difficile Infection. Infect Dis Clin North Am 2015; 29 (1): 109–122. doi: 10.1016/j.idc.2014.11.009.
2. Ooijevaar RE, Terveer EM, Verspaget HW et al. Clinical application and potential of fecal microbiota transplantation. Annu Rev Med 2019; 70 (1): 335–351. doi: 10.1146/annurev-med-111717-122956.
3. Gens KD, Elshaboury RH, Holt JS. Fecal microbiota transplantation and emerging treatments for Clostridium difficile infection. J Pharm Pract 2013; 26 (5): 498–505. doi: 10.1177/089719 0013499527.
4. Wilson BC, Vatanen T, Cutfield WS et al. The super-donor phenomenon in fecal microbiota transplantation. Front Cell Infect Microbiol 2019; 9. doi: 10.3389/fcimb.2019.00002.
5. Ooijevaar RE, Van Beurden YH, Terveer EM et al. Update of treatment algorithms for Clostridium difficile infection. Clin Microbiol Infect 2018; 24 (5): 452–462. doi: 10.1016/j.cmi.2017.12.022.
6. Wang JW, Kuo CH, Kuo FC et al. Fecal microbiota transplantation: review and update. J Formos Med Assoc 2019; 118 (Supl 1): S23–S31. doi: 10.1016/j.jfma.2018.08.011.
7. Mills JP, Rao K, Young VB. Probiotics for prevention of Clostridium difficile infection. Curr Opin Gastroenterol 2018; 34 (1): 3–10. doi: 10.1097/MOG.0000000000000410.
8. Moutinho BD, Baima JP, Rigo FF et al. Fecal microbiota transplantation in refractory ulcerative colitis – a case report. J Int Med Res 2019; 47 (2): 1072–1079. doi: 10.1177/0300060518821790.
9. Debast SB, Bauer MP, Kuijper EJ et al. European Society of Clinical Microbiology and Infectious Diseases: update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect 2014; 20 (Supl 2): S1–S26. doi: 10.1111/1469-0691.12418.
10. Yacyshyn B. Pathophysiology of Clostridium difficile–associated diarrhea. Gastroenterol Hepatol 2016; 12 (9): 558–560.
11. Napolitano LM, Edmiston CE Jr. Clostridium difficile disease: diagnosis, pathogenesis, and treatment update. Surgery 2017; 162 (2): 325–348. doi: 10.1016/j.surg.2017.01.018.
12. Polívková S, Vojtilová L, Husa P et al. Doporučený postup fekální bakterioterapie pro léčbu rekurentní klostridiové kolitidy. Klin Mikrobiol Infekc Lek 2018; 24 (2): 57–64.
13. Cammarota G, Ianiro G, Tilg H et al. European consensus conference on faecal microbiota transplantation in clinical practice. Gut 2017; 66 (4): 569–580. doi: 10.1136/gutjnl-2016-313017.
14. Lee CH, Steiner T, Petrof EO et al. Frozen vs fresh fecal microbiota transplantation and clinical resolution of diarrhea in patients with recurrent Clostridium difficile infection. JAMA 2016; 315 (2): 142–149. doi: 10.1001/jama.2015.18098.
15. Li YT, Cai HF, Wang ZH et al. Systematic review with meta-analysis: long-term outcomes of faecal microbiota transplantation for Clostridium difficile infection. Aliment Pharmacol Ther 2016; 43 (4): 445–457. doi: 10.1111/apt.13492.
16. Youngster I, Sauk J, Pindar C et al. Fecal microbiota transplant for relapsing Clostridium difficile infection using a frozen inoculum from unrelated donors. Clin Infect Dis 2014; 58 (11): 1515–1522. doi: 10.1093/cid/ciu135.
17. Li N, Tian H, Ma C et al. Efficacy analysis of fecal microbiota transplantation in the treatment of 406 cases with gastrointestinal disorders. Zhonghua Wei Chang Wai Ke Za Zhi 2017; 20 (1): 40–46.
18. Březina J, Bajer L, Špičák J et al. Fekální mikrobiální transplantace u idiopatických střevních zánětů. Gastroent Hepatol 2016; 70 (1): 51–56. doi: 10.14735/amgh201651.
19. Moayyedi P, Surette MG, Kim PT et al. Fecal microbiota transplantation induces remission in patients with active Ulcerative colitis in a randomized controlled trial. Gastroenterology 2015; 149 (1): 102–109. doi: 10.1053/j.gastro.2015.04.001.
20. Rossen NG, Fuentes S, Van Der Spek MJ et al. Findings from a randomized controlled trial of fecal transplantation for patients with Ulcerative colitis. Gastroenterology 2015; 149 (1): 110–118. doi: 10.1053/j.gastro.2015.03.045.
21. Wang T, Kraft CS, Woodworth MH et al. Fecal microbiota transplant for refractory Clostridium difficile infection interrupts 25-year history of recurrent urinary tract infections. Open Forum Infect Dis 2018; 5 (2): 016. doi: 10.1093/ofid/ofy016.
22. Dinh A, Fessi H, Duran C et al. Clearance of carbapenem-resistant Enterobacteriaceae vs vancomycin-resistant enterococci carriage after faecal microbiota transplant: a prospective comparative study. J Hosp Infect 2018; 99 (4): 481–486. doi: 10.1016/j.jhin.2018.02.018.
23. Johnsen PH, Hilpüsch F, Cavanagh JP et al. Faecal microbiota transplantation versus placebo for moderate-to-severe irritable bowel syndrome: a double-blind, randomised, placebo-controlled, parallel-group, single-centre trial. Lancet Gastroenterol Hepatol 2018; 3 (1): 17–24. doi: 10.1016/S2468-1253 (17) 30338-2.
24. Mullish BH, Mc Donald JA, Thursz MR et al. Fecal microbiota transplant from a rational stool donor improves hepatic encephalopathy: a randomized clinical trial. Hepatology 2017; 66 (4): 1354–1355. doi: 10.1002/hep.29369.
25. Bajaj JS, Kassam Z, Fagan A et al. Fecal microbiota transplant from a rational stool donor improves hepatic encephalopathy: a randomized clinical trial. Hepatology 2017; 66 (6): 1727–1738. doi: 10.1002/hep.29306.
26. Marotz CA, Zarrinpar A. Treating obesity and metabolic syndrome with fecal microbiota transplantation. Yale J Biol Med 2016; 89 (3): 383–388.
27. Vrieze A, Van Nood E, Holleman F et al. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology 2012; 143 (4): 913–916. doi: 10.1053/j.gastro.2012.06.031.
28. Alang N, Kelly CR. Weight gain after fecal microbiota transplantation. Open Forum Infect Dis 2015; 2 (1): ofv004. doi: 10.1093/ofid/ofv004.
29. Yang Y, Tian J, Yang B. Targeting gut microbiome: a novel and potential therapy for autism. Life Sci 2018; 194: 111–119. doi: 10.1016/j.lfs.2017.12.027.
30. Kang DW, Adams JB, Gregory AC et al. Microbiota transfer therapy alters gut ecosystem and improves gastrointestinal and autism symptoms: an open-label study. Microbiome 2017; 5 (1): 10. doi: 10.1186/s40168-016-0225-7.