Tofacitinib – první JAK inhibitor v léčbě ulcerózní kolitidy. Začátek terapeutické éry „malých molekul“ u idiopatických střevních zánětů?
Milan Lukáš Orcid.org 1
+ Pracoviště
Terapeutické možnosti u idiopatických střevních zánětů (IBD – inflammatory bowel disease) se v posledních letech neustále rozšiřují, a to nejen v oblasti medikamentózní terapie, ale také v chirurgických intervencích a v nutriční léčbě. Na konci 20. století přišla do medikamentózní terapie IBD revoluce v podobě biologické léčby (BL), která výrazně změnila strategii léčby IBD a podstatně zlepšila kvalitu poskytované péče. Nicméně přes nezpochybnitelný benefit, mají monoklonální protilátky své limitace ve smyslu omezené účinnosti, relativně malé bezpečnosti (anti-tumor nekrotizující faktor (anti-TNF) léčba) a vysoké finanční nákladnosti. Jiným omezením je, že biologika vyžadují parenterální aplikaci (intravenózní nebo subkutánní), která může být pro pacienty vyžadující dlouhodobou terapii zatěžující. V posledních několika letech je zřetelný zájem o nová léčiva, u kterých se vžilo označení „malé molekuly“ (SMD – small molecule drugs), aby se tím zdůraznila jejich odlišná struktura a příprava od monoklonálních protilátek (MP).
Rozdíly mezi monoklonálními protilátkami a „malými molekulami“
Podstatný rozdíl mezi SMD a MP je jejich molekulární hmotnost. SMD jsou definovány jako látky s nízkou molekulární hmotností < 1kDa (obvykle < 500 Da). Mohou mít jakoukoli chemickou strukturu, ale většinou se jedná o organické sloučeniny složené z uhlíku, dusíku a kyslíku [1]. Nízká molekulová hmotnost umožňuje SMD snadněji pronikat přes buněčné membrány. Naproti tomu MP jsou velké makromolekulární struktury s molekulární hmotností > 1kDa [1,2]. Většina biologických látek jsou komplexní proteiny složené z polypeptidových řetězců s primární, sekundární, terciární a kvartérní strukturou. Tento rozdíl v molekulové velikosti významně ovlivňuje způsob podání léčiv, cílové místo účinku, farmakokinetické vlastnosti, imunogenitu a lékové interakce. Jednou z hlavních výhod SMD oproti MP je možnost perorálního podání, protože léky s nízkou molekulovou hmotností odolávají žaludeční degradaci daleko lépe než imunoglobuliny a z tenkého střeva se SMD rychle resorbují a vstupují snadno do systémové cirkulace. SMD mají obvykle velmi krátký biologický poločas (v důsledku metabolizmu a vazby na plazmatické proteiny) pohybující se v řádu několika hodin, zatímco MP vykazují mnohem delší poločas (s pomalou degradací proteázami) v řádu mnoha dní až týdnů. Proto se musí většina SMD užívat denně nebo dokonce 2× denně. Zásadní rozdíl je v odbourávání SMD, které je stabilní v průběhu celé doby léčby a dobře předvídatelné. Naproti tomu degradace a clearence MP je velmi individuální, a navíc se v průběhu doby u konkrétního pacienta může významně měnit, což vede ke změně biologické dostupnosti a také ke změně efektivity podávané léčby s nutností navyšování expozice léčivy (tzv. optimalizace léčby). Právě změněná a nepředvídatelná clearence biologického léčiva v průběhu terapie je obviňována z omezené biologické dostupnosti a také z indukce tvorby ADA (anti-drug antibodies) protilátek, což nakonec vede k sekundární ztrátě účinnosti. Imunitní odpověď je obvykle zaměřena proti velkým molekulám nebo jejich fragmentům. SMD nemají antigenní potenciál a nevykazují žádnou imunogenitu, vzniká předpoklad jejich dlouhodobé účinnosti s vysokou perzistencí pacientů na léčbě. SMD však mohou vyvolat idiosynkrastickou reakci a/nebo lékovou alergii [1–3]. Nevýhodou SMD proti biologickým léčivům je relativně vysoká pravděpodobnost lékových interakcí, které jsou u MP výjimečné. SMD se mohou navíc vázat na jinou cílovou strukturu, než pro kterou byly původně zamýšleny, a tím vyvolávat toxicitu prostřednictvím „mimocílových“ účinků.
Mechanizmus účinku
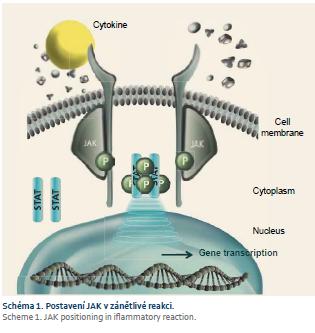
Systém Janus kinázy (JAK) zahrnuje čtyři intracelulární tyrozinkinázy: JAK-1, JAK-2, JAK-3 a tyrozinkinázu 2 (TYK-2), které zprostředkovávají nitrobuněčný přenos signálu, který je indukován prozánětlivými cytokiny reagujícími s buněčnými membránovými receptory. Přítomnost dvou homologických kinázových domén přispěla k jejich pojmenování podle římského boha dvou tváří Januse. Jedna doména je katalyticky aktivní, kdežto druhá aktivní není. Zjednodušený mechanizmus účinku JAK a možnost jejich cíleného ovlivnění jsou znázorněny na schématu 1. Po aktivaci cytokinových receptorů na buněčném povrchu se JAK naváže na cytoplazmatický konec transmembránového receptorového komplexu a fosforyluje se, čímž umožní navázání proteinu STAT (Signal Transducer and Activator of Transcription) a jeho fosforylaci. Následně se STAT protein z komplexu s JAK uvolní, v cytoplazmě vytvoří dimer a přesune se do buněčného jádra, kde se naváže na promotorovou oblast a spustí transkripci určitých genů regulujících imunitní odpověď.
JAK se aktivují v párech a různé kombinace JAK jsou spojeny s různými cytokinovými receptory. Inhibice JAK může potenciálně blokovat současně několik cytokinových cest aktivace zánětlivé kaskády. V porovnání s BL, která je zaměřena proti jedinému specifickému extracelulárnímu, resp. transmembránově vázanému cíli (trimer TNFa), představují JAK inhibitory léčbu nové generace cíleně ovlivňující nitrobuněčnou signalizaci imunitní a zánětlivé odpovědi zprostředkované několika cytokiny najednou [1–3].
Tofacitinib v léčbě ulcerózní kolitidy
Tofacitinib je perorální neselektivní inhibitor JAK, který inhibuje především aktivitu JAK-1 a JAK-3 a v menší míře také JAK-2. Tato inhibice blokuje signalizaci velké podskupiny zánětlivých cytokinů zahrnujících IL-2, IL-4, IL-6, IL-7, IL-9, IL-15, IL-21 a interferonu g [4]. Uvedené cytokiny jsou klíčové pro aktivaci lymfocytů, buněk s mimořádným významem v patogenezi IBD. Tofacitinib byl již v minulých letech povolen pro léčbu středně těžké a těžké revmatoidní artritidy u pacientů s nedostatečnou odpovědí na metotrexát nebo s jeho intolerancí. V květnu, resp. v červnu 2018 byl povolen v USA a v EU pro léčbu nemocných se středně těžkou a těžkou ulcerózní kolitidou (UC – ulcerative collitis) do klinické praxe.
Efektivita tofacitinibu u UC byla potvrzena ve III. fázi klinického sledování (studie OCTAVE 1 a 2), která zkoumala účinnost a bezpečnost indukční a udržovací terapie tofacitinibem u UC. Výsledky potvrdily, že podíl pacientů v klinické remisi v 8. týdnu (při léčbě tofacitinibem 10 mg 2× denně) byl statisticky významně vyšší v porovnání s placebem (18,5 vs. 8,2 %; p = 0,007 a 16,6 vs. 3,6 %; p = 0,0005) a současně významně vyšší podíl nemocný dosáhl slizničního zhojení v porovnání s kontrolní skupinou [5]. Účinnost léčby tofacitinibem byla podobná u pacientů s UC exponovaných a biologicky naivních pacientů. Nemocní, kteří vykazovali odpověď v indukčních studiích (OCTAVE 1 a OCTAVE 2) v týdnu 8, která byla definována snížením pMayo indexu nejméně o 3 body, přešli do udržovací fáze (OCTAVE Sustain), ve které byli rerandomizováni do tří ramen na dávku 2 × 10 mg denně, 2 × 5 mg denně a k podávání placeba. Pacienti, kteří neodpověděli v týdnu 8, mohli pokračovat ještě dalších 8 týdnů v prodlouženém indukčním režimu do týdne 16. Ti nemocní, kteří odpověděli v prodlouženém indukčním režimu v týdnu 16, pokračovali dále ve stejné dávce 2 × 10 mg dlouhodobě v rámci projektu (OCTAVE Open). Pacienti, kteří neměli odpověď v týdnu 16, dále v léčbě tofacitinibem nepokračovali. Výsledky pacientů ve dlouhodobé udržovací fázi (OCTAVE Sustain) prokázali, že v rameni 10 mg 2× denně podíl nemocných dosahujících remise v týdnu 52 byl 40,6 % a v aktivním rameni s dávkou tofacitinibu 2 × 5 mg denně byl 34,3 %, v porovnání s placebem (11,1 %) byly výsledky v obou aktivních skupinách statisticky signifikantní (p < 0,001) [6].
Na základě výsledků této studie bylo doporučeno dávkování pro nemocné s UC v indukčním režimu po dobu 8 týdnů 2 × 10 mg denně a v udržovací terapii 2 × 5mg. Zajímavé zjištění přenesla post-hoc analýza pacientů, kteří neodpověděli v týdnu 8, ale dosáhli opožděné klinické odpovědi v týdnu 16 a dále pokračovali v léčbě 2 × 10 mg po dobu dalších několika let. Ukázalo se, že podíl nemocných dosahující klinické remise, klinické odpovědi a slizničního zhojení na konci 1. roku není odlišný od nemocných, kteří odpověděli v 8. týdnu terapie [6]. Tento nález podporuje představu, že nedojde-li k efektu do 8 týdnů a snese-li to klinický stav pacienta, je možné s indukční dávkou 2 × 10 mg pokračovat ještě dalších 8 týdnů a teprve při neefektivitě terapii ukončit. SPC Xeljanz (tofacitinib) navíc uvádí, že např. u pacientů, kterým selhala předchozí léčba anti-TNF, je třeba zvážit pokračování podávání dávky 10 mg 2× denně jako udržovací léčbu za účelem udržení léčebného přínosu. Vedle toho bylo zjištěno, že klinický efekt tofacitinibu se dostavuje relativně rychle a již ve 2. týdnu léčby významně vyšší počet nemocných s UC vykazovalo snížení hodnoty pMayo indexu v porovnání s placebovou skupinou.
Nejčastěji hlášenými nežádoucími účinky u pacientů léčených tofacitinibem byly infekční komplikace, a to především nazofaryngitida, močové infekce a infekce způsobené virem varicela zoster [5]. Zvýšený výskyt exacerbace infekce herpes zoster byl u všech exponovaných nemocných 3,8× vyšší v porovnání s pacienty randomizovanými k terapii placebem. Jednalo se v 75 % zaznamenaných případů o postižení jednoho nebo dvou dermatomů, které nevedlo k nutnosti předčasného ukončení terapie. U 16 % nemocných bylo zjištěno postižení více dermatomů a v 8 % případů se jednalo o systémovou infekci. V tomto ohledu je nutné minimalizovat riziko exacerbace spící infekce vyšetřením protilátek proti varicela zoster a v případě negativity nebo velmi nízkému titru imunoglobulin G protilátek před zahájením léčby tofacitinibem provést vakcinaci. Dalším nežádoucím účinkem byl vznik neutropenie (v rozmezí 1 000–1 500 buněk/l × 109) a na dávce závislé zvýšení sérových hladin lipoproteinů s nízkou hustotou (LDL), vysokou hustotou (HDL) a cholesterolu (jejichž hladiny se však normalizovaly po ukončení léčby [5]. Dne 17. 5. 2019 vydala Evropská léková agentura (EMA – European Medicines Agency) varování pro užívání tofacitinibu v dávce 2 × 10 mg denně u nemocných s vysokým rizikem tromboembolické nemoci. Bylo to na podkladě předběžných výsledků dlouhodobé studie u pacientů s revmatoidní artritidou, kteří byli starší 50 let a měli alespoň jeden rizikový faktor pro kardiovaskulární příhodu. Hlášeno bylo 19 případů plicní embolie na 3 884 paciento-roků. Jaký dopad má toto zjištění pro léčbu nemocných s UC, není zatím jasné [7]. Předpokládá se, že v klinické praxi se bude tofacitinib využívat u nemocných se střední a vysokou závažností UC, kteří neodpověděli na konvenční terapii, ale také u nemocných, kteří selhali na BL. Dostupný pro léčbu je v rámci center pro BL.
Domácí zkušenosti
Naše vlastní zkušenosti s tofacitinibem jsou vzhledem k velmi krátké době užívání tohoto léku limitovány na 28 pacientů se středně těžkou a těžkou UC, z nichž 24 pacientů v předcházejícím průběhu (86 %) selhalo min. na jeden preparát BL. K významnému klinickému zlepšení klinického stavu nebo k navození klinické remise došlo u 50 % nemocných v týdnu 8. V indukční fázi ani v udržovací léčbě, která je zatím v průměru 16 týdnů, jsme nepozorovali žádné vedlejší ani nežádoucí účinky, k nevýznamnému zvýšení krevních lipidů došlo prakticky u všech nemocných. Herpes zoster ani projevy tromboembolizmu nebyly zaznamenány u žádného pacienta (nepublikované vlastní pozorování).
prof. MUDr. Milan Lukáš, CSc.
Klinické a výzkumné centrum
pro střevní záněty ISCARE I.V.F. a.s.
Jankovcova 1569/2c, 170 00 Praha 7
milan.lukas@email.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Vaníčková R, Lukáš M. „Malé molekuly“ v léčbě idiopatických střevních zánětů. Farmakoterapeutická revue 2018; 4.
2. Cramer JA, Roy A, Burrell A et al. Medication compliance and persistence: terminology and definitions. Value Heal 2008; 11 (1): 44–47. doi: 10.1111/j.1524-4733.2007.00213.x.
3. Šenolt L. Inhibice Janus kinázy v léčbě revmatoidní artritidy. Farmakoterapie 2011 (3): 283–289.
4. Sandborn WJ, Ghosh S, Panes J et al. Tofacitinib, an oral janus kinase inhibitor, in active ulcerative colitis. N Engl J Med 2012; 367 (7): 616–624. doi: 10.1056/NEJMoa1112168.
5. Sandborn WJ, Su C, Sands BE et al. Tofacitinib as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2017; 376 (18): 1723–1736. doi: 10.1056/NEJMoa1606910.
6. Rubin DT, Dubinski M, Lukas M et al. Long-term efficacy of tofacitinib in patients who received extended induction therapy: results from OCTAVE open study for tofacitinib delayed responders. J Crohns Colitis 2019; 13 (Suppl 1): S050–S052. doi: 10.1093/ecco-jcc/jjy222.077.
7. European Medicines Agency. Restrictions in use of Xeljanz while EMA reviews risk of blood clots in lungs. 2019. [online]. Available from: https: //www.ema.europa.eu/en/news/restrictions-use-xeljanz-while-ema-reviews-risk-blood-clots-lungs.