Praktické klinické doporučení pro perioperační péči v bariatrické chirurgii 2023: adaptace doporučení společnosti ERAS (Enhanced Recovery After Surgery) s konsenzuálním hlasováním pracovní skupiny Společné sekce bariatricko-metabolické chirurgie České chi
Igor Satinský Orcid.org 1, Martin Hrubý2, Petra Šrámková3, Jiří Patka4, Michal Čierný5, P. Babiak6, Igor Šimoník7, Peter Schwarz8, Martin Haluzík Orcid.org 9,10
+ Pracoviště
Souhrn
Úvod: Bariatrická chirurgie je v současnosti nejúčinnější léčbou těžké obezity. Jejím výsledkem je dlouhodobý úbytek hmotnosti a prokázaný pozitivní vliv na komorbidity spojené s obezitou. V posledních 20 letech celosvětově prudce narůstá počet bariatrických operací. Proto je patrná snaha o konsenzus v perioperační péči v této oblasti chirurgie na základě ověřených důkazů. Metody: Pracovní skupina Společné sekce bariatricko-metabolické chirurgie České chirurgické společnosti (ČCHS) a České obezitologické společnosti (ČOS) zpracovala text praktického doporučení pro koncepci Enhanced Recovery After Surgery (ERAS) pro perioperační péči v bariatrické chirurgii. Vycházela z doporučení společnosti ERAS aktualizované v roce 2021. Původní text originálního doporučení pracovní skupina adoptovala, následně adaptovala a případně připojila ke konkrétním položkám svůj komentář. Závěrečnou fází tvorby bylo elektronické hlasování všech členů pracovní skupiny, kterým byla vyjádřena míra konsenzu nad jednotlivými elementy doporučení. Výsledky: Ve většině bodů se česká pracovní skupina shodla s doporučeními Enhanced Recovery After Bariatric Surgery (ERABS). Pro některé intervence z protokolu ERAS pro bariatrickou operativu neexistují kvalitní důkazy. Proto je nutné pro praxi založenou na důkazech extrapolovat z jiných chirurgických výkonů a oblastí. Závěr: Doporučení je zaměřeno na klinickou praxi v bariatrické operativě s protokolem ERAS vycházející ze současných poznatků a doporučení. Je založeno na recentním a zevrubném doporučení společnosti ERAS, které bylo českou pracovní skupinou společné sekce bariatrické a metabolické chirurgie adoptováno a adaptováno. Česká verze v komentářích odráží případné doplnění a upřesnění. Originální článek byl publikován v Rozhledech v chirurgii [1].
Klíčová slova
bariatrická a metabolická chirurgie, Enhanced Recovery After Surgery, praktické klinické doporučení
Úvod
Bariatrická chirurgie je nejúčinnější léčbou těžké obezity. Jejím výsledkem je přetrvávající úbytek hmotnosti a prokázaný pozitivní vliv na komorbidity spojené s obezitou. Tyto výhody v kombinaci s neustálým snižováním počtu komplikací vedly k výraznému nárůstu poptávky po bariatrických chirurgických výkonech na celém světě. Počet provedených operací celosvětově stoupá z 146 000 na 340 000 mezi lety 2003 a 2011. V roce 2016 byly třemi nejčastěji prováděnými primárními chirurgickými bariatrickými/metabolickými výkony celosvětově:
- sleeve gastrektomie (SG, 54 %);
- Roux-en-Y gastrický bypass (RYGB, 30 %);
- minigastrický bypass (one anastomosis gastric bypass, OAGB, 5 %) [2].
Použití multimodálního přístupu minimalizujícího stres může snížit míru morbidity po velkých gastrointestinálních operacích a může zkrátit funkční zotavení i délku hospitalizace v bariatrické chirurgii [3,4]. První verze doporučení založených na důkazech pro perioperační péči o pacienty podstupující bariatrickou operaci byla publikována společností Enhanced Recovery After Surgery (ERAS) v roce 2016 [5]. Vzhledem k pokračujícímu nárůstu bariatrické chirurgie prováděné po celém světě, stejně jako rostoucí popularitě nových chirurgických technik, se důkazy, na nichž jsou doporučení založena, neustále vyvíjejí. Proto je třeba klinická doporučení pravidelně přehodnocovat a aktualizovat.
Tento dokument je aktualizovaným, na důkazech založeným konsenzem o perioperační péči v bariatrické chirurgii založeným na současných dostupných důkazech.
Metoda
Členové pracovní skupiny Společné sekce bariatricko-metabolické chirurgie České chirurgické společnosti a České obezitologické společnosti vycházeli z textu doporučení společnosti ERAS pro perioperační péči v bariatrické chirurgii [6]. Tento dokument hodnotil hlavní literární zdroje v databázích Pubmed, EMBASE, Cochrane a v ClinicalTrials publikované do prosince 2020 se zaměřením zvláště na metaanalýzy, randomizované kontrolované studie a na rozsáhlé prospektivní kohortové studie. Vybrané studie byly posuzovány, shrnuty a ohodnoceny podle systému GRADE (Grading of Recommendations, Assessment, Development and Evaluation) [7]. Úroveň důkazů byla kategorizována do čtyř kategorií v souladu se systémem GRADE [8]:
- vysoká;
- střední;
- nízká;
- velmi nízká.
Pracovní skupina text adoptovala, poté ve vzájemné diskuzi text zkrátila a adaptovala. V tomto praktickém klinickém doporučení je kladen důraz na precizní formulace a závěry ze zdrojového dokumentu Stenbergovy autorské skupiny. Jsou tak uvedeny odkazy na literární zdroje zásadního významu. Pracovní skupina sekce pak na další zdrojová data odkazuje na literaturu uvedenou u originálního článku [6].
Závěrečnou fází tvorby bylo elektronické hlasování všech členů pracovní skupiny, kterým byla vyjádřena míra konsenzu nad jednotlivými elementy doporučení. Hlasování bylo anonymní a zúčastnili se ho všichni členové pracovní skupiny. Hlasování bylo zpracováno počítačově a graficky – k procentuálním výsledkům hlasování byla přiřazena síla shody (silná shoda, shoda, většinový souhlas, bez souhlasu) (tab. 1) [9].

V textu bylo ponecháno i hodnocení Stenbergovy skupiny, kde kritéria pro hodnocení síly doporučení byla následující [6]:
- Silné doporučení: panel je přesvědčen, že žádoucí účinky při dodržování doporučení převažují nad nežádoucími účinky.
- Slabé doporučení: žádoucí účinky při dodržování doporučení pravděpodobně převažují nad nežádoucími účinky, ale porota si je méně jistá.
Důkazy a doporučení pro položky ERAS jsou uvedeny ve čtyřech různých tabulkách – před hospitalizací, předoperační, peroperační a pooperační – a jsou očíslovány v pořadí, v jakém mají být použity v klinické praxi. Souhrnné tabulky (tab. 2–5) ukazují přehled kvality důkazů a stupeň doporučení ERABS (ERAS pro bariatrickou chirurgii) a sílu shody pracovní skupiny sekce bariatrické a metabolické chirurgie pro každou položku.

Předhospitalizační položky
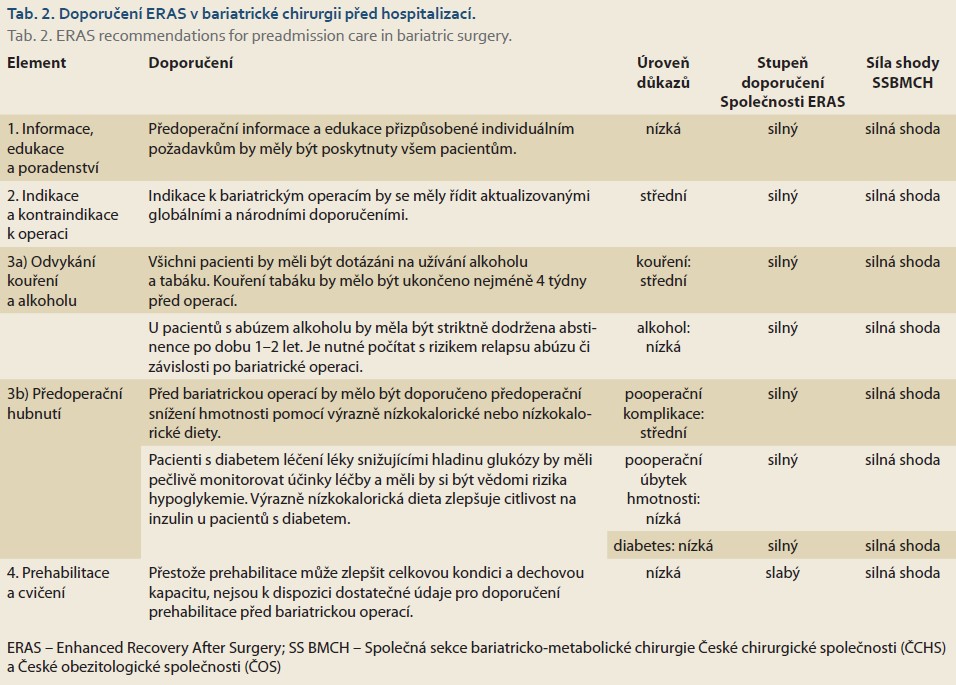
Informace, edukace a poradenství
Pacient plánovaný k bariatrické operaci musí být dobře informován o dopadu rozsáhlých změn spojených s životem po bariatrickém výkonu. Pacienti musí být motivováni a ochotni podílet se na dlouhodobé péči, změně stravovacích návyků a přijmout upravený životní styl po operaci. Často se doporučuje předoperační edukační program, aby se zajistila realistická očekávání, snížila se úzkost, pooperační bolestivost a výskyt ranných komplikací, zkrátila se doba hospitalizace. Výsledky však zůstávají rozporné. Ukazuje se, že edukační intervence se obtížně standardizuje a že je nedostatek studií hodnotících její přínos pro bariatrickou chirurgii.
I když stupeň důkazů zůstává nízký, před bariatrickou operací by mělo být provedeno formální psychosociální zhodnocení zahrnující environmentální, rodinné, nutriční a behaviorální faktory ve shodě se současnými doporučeními Americké společnosti pro metabolickou a bariatrickou chirurgii (ASMGS – American Society for Metabolic and Bariatric Surgery) [10].
Navzdory nízkému stupni důkazů se předoperační informace a edukace důrazně doporučují jako nezbytný krok informovaného souhlasu za účelem zlepšení znalostí, zajištění adekvátního vnímání rizik a umožnění aktivní účasti pacienta na přijímání dobře informovaných rozhodnutí (tab. 2).
Indikace a kontraindikace k operaci
Současné indikace pro bariatrickou chirurgii jsou BMI (body mass index) ≥ 40 kg/m2 nebo BMI ≥ 35 kg/m2 a komorbidita související s obezitou, u níž lze očekávat zlepšení/vyléčení udržováním úbytku hmotnosti po operaci. Tyto indikace byly stanoveny na konsenzuálním setkání v roce 1991 a následně potvrzeny novějšími doporučeními [11,12]. Zásadní doplněk k indikacím pro bariatrickou či spíše metabolickou chirurgii přinesla mezinárodní konsenzuální konference Diabetes Surgery Summit v roce 2007, která doporučila použití bariatrické a metabolické chirurgie k léčbě diabetes mellitus 2. typu (T2D), včetně jedinců s obezitou I. stupně. Společné prohlášení mezinárodních diabetologických organizací z roku 2016 doporučuje zvážit metabolickou chirurgii jako možnost léčby diabetu 2. typu u pacientů s obezitou I. stupně (BMI 30,0–34,9 kg/m2) a s nedostatečně kontrolovanou hyperglykemií navzdory optimální medikamentózní léčbě (tab. 2) [13].
Komentář pracovní skupiny (dále PS): Koncem roku 2022 vydaly dvě společnosti (The American Society for Metabolic and Bariatric Surgery [ASMBS] a International Federation for the Surgery of Obesity and Metabolic Disorders [IFSO]) nová doporučení pro indikace pro bariatrické operace. Indikováni jsou pacienti s obezitou II. stupně (BMI > 35 kg/m2) bez ohledu na přítomnost, nepřítomnost nebo závažnost přidružených onemocnění. Dále jsou indikováni pacienti s obezitou I. stupně (BMI 30,0–34,9 kg/m2) s metabolickým onemocněním (diabetem 2. typu [T2D]). Indikace k operaci by měla být zvažována u jedinců s BMI 30–34,9 kg/m2, kteří nedosahují podstatného nebo trvalého úbytku hmotnosti nebo zlepšení komorbidity pomocí nechirurgických metod [14]. Nové indikace tak posouvají hranice BMI níže o jeden stupeň obezity.
Předoperační optimalizace
Odvykání kouření a alkoholu
Ukončení kouření alespoň 4–8 týdnů před operací snižuje pooperační komplikace po nebariatrických operacích, zejména ranné a kardiovaskulární komplikace. U bariatrické chirurgie bylo kouření spojeno se zvýšeným rizikem vředů v anastomóze, se zvýšením infekčních a respiračních komplikací. Optimální načasování, kdy přestat kouřit, zůstává nejasné. Intervence, která začíná minimálně 4 týdny před operací a zahrnuje jednou týdně pohovor a používání přípravků na snížení závislosti na nikotinu, je pravděpodobně nejvíce úspěšným přístupem, jak ovlivnit komplikace a dlouhodobě přerušit kouření. Navzdory nejlepší snaze se jeví dosažení odvykání jako obtížné, zvláště z dlouhodobého pohledu (tab. 2).
Vysoká konzumace alkoholu může zvýšit riziko pooperačních komplikací – především infekčních a souvisejících s hojením ran. Účinek předoperačního odvykání alkoholu byl řešen v Cochranově přehledu zahrnujícím tři randomizované kontrolované studie (RCT – randomized control trial) s celkovým počtem 140 pacientů, kteří podstoupili kolorektální nebo ortopedickou operaci. Souhrnný odhad z těchto studií naznačil významné snížení rizika (RR 0,62; 95% CI 0,40–0,96) pooperačních komplikací po předoperačním poradenství a krátké, ale intenzivní intervenci u pacientů se zvýšenou konzumací. Komplexní povaha povinných změn chování v kombinaci se zvýšeným rizikem pooperační nadměrné konzumace alkoholu a závislosti, zejména u pacientů s předchozím abúzem návykových látek, je základem pro současná doporučení 1–2letého období dokumentované alkoholové abstinence pro pacienty s dřívější závislostí. Úroveň důkazů pro toto doporučení zůstává nízká (tab. 2).
Komentář PS: Pracovní skupina si plně uvědomuje negativní vliv nikotinu ve všech jeho formách na celkový zdravotní stav pacienta i na hojení střevních anastomóz. Zároveň si je ale vědoma omezených možností kontroly lékařem na přerušení užívání tabákových výrobků pacientem. Skupina se tak shoduje na důrazném předoperačním doporučení přerušení kouření minimálně 4 týdny před operací a na edukaci pacienta o negativních vlivech nikotinizmu na případné pooperační komplikace.
Předoperační hubnutí
Na rozdíl od předoperačního programu povinného hubnutí je před bariatrickou operací obvykle doporučována nízkokalorická dieta (1 000–1 200 kcal/d) nebo výrazně nízkokalorická dieta (800 kcal/d). Tento režim ukázal, že snižuje objem jater, a tak usnadňuje chirurgický přístup. Navíc je výrazně nízkokalorická dieta spojena se celkovým zvýšením inzulinové senzitivity. Tento efekt může být výraznější u pacientů s vyšším BMI. Výsledky studií ale zůstávají rozporné.
Z observačních studií je patrné výraznější pooperační snížení hmotnosti u pacientů, kteří předoperačně zhubli. Účinek předoperačního úbytku hmotnosti byl také hodnocen v nastavení ERAS, které prokázalo zkrácení operačního času a také zlepšený pooperační úbytek hmotnosti. Zdá se také, že dochází k výraznějšímu pooperačnímu snížení hmotnosti u pacientů, kteří dosáhnou předoperační snížení hmotnosti > 10 %.
Obecně se dá konstatovat, že existuje vysoká úroveň důkazů, že 2–4 týdny nízkokalorické nebo výrazně nízkokalorické diety vedou k snížení objemu jater. Dále existuje střední úroveň důkazů o snížení pooperačních komplikací a nízká kvalita důkazů ohledně vlivu na pooperační ztrátu hmotnosti (tab. 2)
Komentář PS: Doporučení předoperační nízkokalorické (LCD – low caloric diet) nebo výrazně nízkokalorické diety (VLCD – very low caloric diet) by mělo být součástí optimalizace v předoperačním období. Přes nízkou compliance by mělo být pacientům doporučení zvláště zdůrazněno v případech zjištění hepatomegalie nebo u pacientů s BMI > 40 kg/m2. Vhodná je i kombinace nízkokalorických diet s užíváním antiobezitik. Snížení hmotnosti před plánovanou bariatrickou operací a také nápodobu pooperačních změn v pocitech hladu a chutí lze navodit použitím zejména GLP-1 (glucagon-like peptid) analog. Nástup účinku antiobezitik trvá 3–5 týdnů, vlastní efekt – tedy redukce alespoň 5 % hmotnosti – lze pozorovat okolo 12. týdne od zahájení léčby. Samotné rozhodnutí k bariatrické operaci předchází vlastnímu operačnímu výkonu obvykle o 2–4 měsíce. Proto případné zahájení léčby antiobezitikem na vstupním vyšetření u chirurga či obezitologa zajistí dostatek času k redukci hmotnosti. Z antiobezitik jsou v České republice dostupná kombinace naltrexon + bupropion (Mysimba®) a liraglutid (Saxenda®). Dále je EMA (European Medicines Agency) schválen semaglutid (Wegovy®) a FDA (Food and Drug Administration) schválen tirzepatid (Mounjaro®), které zatím nejsou k dispozici [15].
Prehabilitace a cvičení
Koncept prehabilitace zahrnuje intervence s cílem zvýšit před operací fyzickou zdatnost, která pak vede k urychlení zotavování a snižuje pooperační morbiditu. V nedávné metaanalýze, zahrnující všechny randomizované klinické studie pacientů podstupujících různé typy břišních operací v letech 1966–2017 byl prokázán všeobecně pokles pooperační morbidity ve skupině s prehabilitací (OR 0,63; 95% CI 0,46–0,87), pokles plicních komplikací (OR 0,40; 95% CI 0,23–0,68) a hraničně významný pokles doby hospitalizace [16]. Existuje heterogenita mezi jednotlivými protokoly, které zahrnují intervence v období 2–4 týdnů před výkonem. Nebyl nalezen žádný rozdíl v testu 6minutové chůze. Přesto předcházející metaanalýzy ukázaly, že u pacientů s prehabilitací došlo ke snížení komplikací a zkrácení doby hospitalizace.
Relativně málo studií zaměřených na vliv prehabilitace bylo provedeno u pacientů s bariatrickými výkony. Dvanáctitýdenní cvičební program zahrnující vytrvalostní trénink byl spojen s redukcí hmotnosti, snížením kardiometabolických rizikových faktorů a se zlepšením všeobecné fyzické zdatnosti. Šestitýdenní předoperační trénink byl také spojen s udržením zlepšené fyzické zdatnosti 6 měsíců po výkonu. Žádná z těchto studií se nezmiňuje o výsledcích v zotavení a v komplikacích.
Ačkoli prehabilitace je slibnou intervencí, která může mít potenciál snížit morbiditu u různých chirurgických diagnóz, zůstává extrapolace výsledků směrem k bariatrické chirurgii diskutabilní (tab. 2).
Předoperační položky
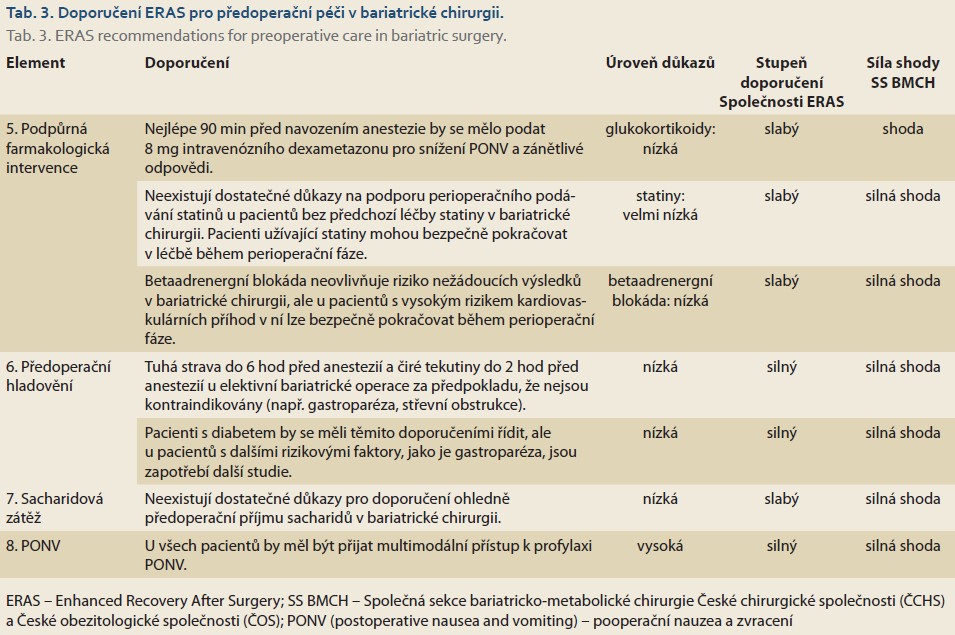
Podpůrná farmakologická intervence
Aby se snížila stresová reakce během operace a po ní, bylo navrženo několik farmakologických intervencí (viz níže).
Glukokortikoidy
Glukokortikoidy jsou známé pro své protizánětlivé vlastnosti, čímž potenciálně snižují perioperační stresovou reakci. U pacientů podstupujících chirurgický zákrok pro karcinom trávicího traktu byly kortikosteroidy podávané před operací nebo po úvodu do anestezie spojeny s menším počtem komplikací a mírnější systémovou zánětlivou odpovědí. Při elektivní operaci pro zánětlivé onemocnění střev snížila jednorázová dávka 8 mg dexametazonu po úvodu do anestezie pooperační ileus, intenzitu pooperační bolesti a zkrátila dobu hospitalizace. Jediná dávka dexametazonu se zdá být bezpečná, protože vedlejší účinky byly omezeny na fyziologický vzestup hladiny glukózy v krvi. Navíc předcházející systémové přehledy a metaanalýzy ukázaly, že předoperační podání dexametazonu nezvýšilo pooperační infekce (ranné ani systémové) a ani netěsnosti v anastomóze. Nadále je nedostatek studií o perioperačním podávání dexametazonu u bariatrických operací.
Statiny
V systematickém přehledu je perioperační podávání statinů u pacientů s různými typy břišních operací spojeno se snížením mortality, systémové infekce a netěsnosti v anastomóze [17]. Přesto další studie přinesly rozporné závěry. Literatura o užívání statinů v bariatrické chirurgii konkrétně chybí. Proto chybí doporučení ohledně rutinního perioperačního podávání statinů k prevenci komplikací u pacientů v bariatrické chirurgii.
Betablokátory
Byla vyslovena hypotéza, že betablokátory mohou potlačením účinku chirurgického stresu na srdce snížit komplikace, jako je infarkt myokardu, cévní mozková příhoda a srdeční arytmie. Ve studiích byly jak bradykardie, tak hypotenze zvýrazněny s nízkou, resp. se střední úrovní důkazů. Důkazy pro časnou úmrtnost ze všech příčin byly nejisté. Některé studie, které hodnotily kontinuální podávání betablokátorů v chirurgii trávicího traktu, ukázaly snížení rizika pooperačních kardiovaskulárních komplikací, snížení výskytu sepse a prosakování v anastomóze a snížení počtu úmrtí v období 90 dnů a 1 roku po operaci. V současnosti není u bariatrických operací doporučeno rutinní podávání betablokátorů, avšak u pacientů s vysokým rizikem kardiovaskulárních příhod a s již nastavenou medikací betablokátory může léčba během perioperačního období bezpečně pokračovat.
Předoperační hladovění
Předcházející srovnávací studie mezi pacienty s obezitou a pacienty s normální hmotností neprokázaly žádný rozdíl v reziduálním gastrickém tekutinovém objemu, v pH nebo ve vyprazdňování žaludku po příjmu kašovité stravy nebo tekutin. V randomizovaných klinických studiích nebyl zaznamenán žádný rozdíl v GRFV (gastric residual fluid volume) ani v pH u pacientů s těžkou obezitou, kteří pili 300 ml čirých tekutin 2 hod před úvodem do anestezie, ve srovnání s pacienty, kteří lačnili od půlnoci. Podobné výsledky s GRFV a s pH po hladovění od půlnoci byly u pacientů s obezitou a diabetem (s autonomní neuropatií, nebo bez ní) ve srovnání s pacienty bez diabetu.
I když úroveň důkazů zůstává nízká, je doporučeno předoperační hladovění bez tuhých jídel (srovnatelné s lehkou stravou) minimálně po dobu 6 hod a možnost pití čirých tekutin až 2 hod před úvodem do anestezie, pokud nejsou kontraindikace (tab. 3).
Příjem sacharidů
Předoperační příjem sacharidů formou izoosmolárních nápojů požitých 2–3 hod před úvodem do anestezie zmírnil rozvoj pooperační inzulinové rezistence, snížil pooperační ztráty dusíku a bílkovin a udržel svalovou hmotu [18]. Dvě metaanalýzy prokázaly, že podávání sacharidů je spojeno se zkrácením doby hospitalizace přibližně o 1 den po velké břišní operaci. Když byly sacharidy podávány pacientům s diabetem 2. typu (průměrný BMI 28,6 kg/m2), nebyly zaznamenány žádné rozdíly v dobách vyprazdňování žaludku ve srovnání se zdravými subjekty. Postprandiální koncentrace glukózy však dosáhly vyššího vrcholu a byly zvýšeny po delší dobu u pacientů s diabetem. Navíc popíjení sacharidových roztoků nezvýšilo komplikace spojené s aspirací u pacientů s gastrickým bypassem, dokonce ani u pacientů s diabetem a zpomaleným vyprazdňováním žaludku. V randomizované klinické studii srovnávající zrychlenou rehabilitaci a standardní péči (včetně předoperačního podávání sacharidů) u bariatrických pacientů nebyly zaznamenány žádné rozdíly v míře komplikací. Navíc compliance s podáváním sacharidových roztoků byla pouze 15 %.
V současnosti je nedostatek důkazů podporujících rutinní předoperační podávání sacharidů v bariatrické chirurgii (tab. 3)
Prevence nevolnosti a zvracení
Pacienti podstupující bariatrickou operaci jsou často ženy a nekuřáci, kteří podstupují laparoskopické nebo robotické výkony trvající déle než 1 hod a dostávají perioperační opioidní analgezii – a to vše jsou rizikové faktory pro pooperační nauzeu a zvracení (PONV – postoperative nausea and vomiting). K PONV může dále přispívat operace žaludku, anamnéza žaludečního refluxu a zmenšení velikosti žaludku, zejména po sleeve gastrektomii.
Nedávná guidelines doporučují multimodální přístup zahrnující celkovou intravenózní anestezii propofolem, vyhýbání se inhalačním anestetikům a přetížení tekutinami a minimalizují používání intra- a pooperačních opioidů [19].
Pro prevenci nauzey a zvracení se navíc doporučuje jedno antiemetikum ze tří z následujících šesti tříd: antagonisté 5-hydroxytryptaminového receptoru, dlouhodobě působící kortikosteroidy jako dexametazon, butyrofenony, antagonisté receptoru neurokininu-1, antihistaminika a anticholinergika. Kromě toho se jako opioidy šetřící strategie k dalšímu snížení rizika PONV doporučují multimodální analgezie a techniky regionální anestezie [20].
Důkazy pro multimodální režim PONV na základě současných RCT jsou silné, ale existují omezené údaje o použití celkové intravenózní anestezie (tab. 3).
Peroperační položky
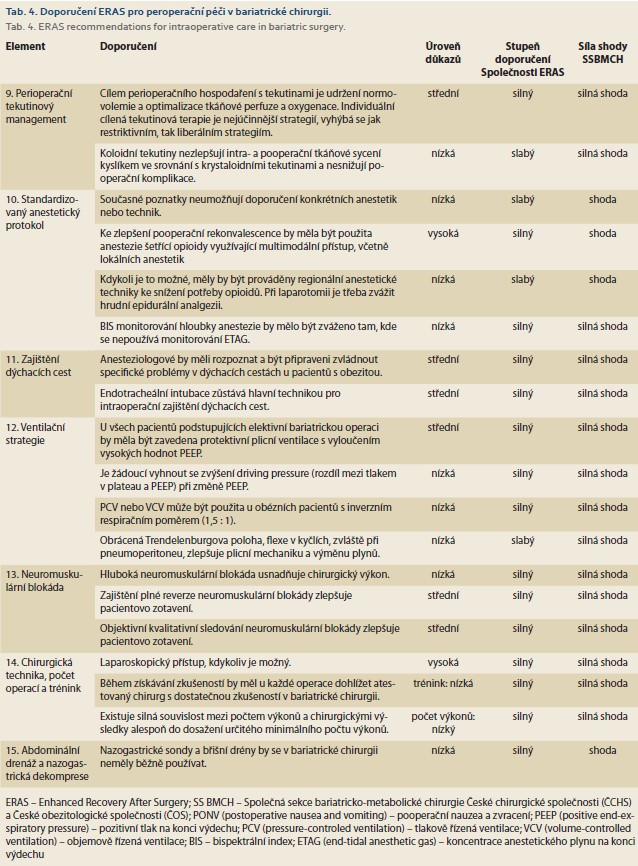
Perioperační tekutinová strategie
Obezita může způsobit změny v různých tekutinových kompartmentech a dokáže změnit složení těla vedoucí k navýšení absolutního objemu tekutin a následně i ke zvýšení srdečního výdeje. Proto v perioperačním období stále zůstává výzvou, jak určit tekutinové požadavky nutné k zajištění normovolemie, a optimálně tak zajistit tkáňovou perfuzi a oxygenaci.
Peroperační hypervolemie stejně jako hypovolemie je spojena s horšími výsledky. Existují data, která naznačují, že restriktivní tekutinový přívod jak u ne-bariatrických, tak u bariatrických operací může zvýšit komplikace stejně jako mortalitu a prodloužit délku hospitalizace. Na druhé straně stejně tak vysoký příjem tekutin v den operace je spojen s prodlouženou hospitalizací.
V současnosti je nejúčinnějším způsobem, jak optimalizovat srdeční výkon a zlepšit dodávku kyslíku v perioperační období, individualizovaná cílená tekutinová terapie (GDFT – goal-directed fluid therapy) [21]. GDFT může pokračovat na chirurgickém oddělení vedená neinvazivním měřením.
Pokud jde o typ tekutiny, krystaloidy opouštějí cirkulaci rychleji než koloidy, a proto mohou zvýšit riziko edému tkání a poruchy okysličení tkání. Intravaskulární účinky koloidů jsou závislé na kontextu, a proto jsou ovlivněny stavem tekutin. Během hypovolemie zůstávají koloidy déle intravaskulárně a mohly by následně lépe udržovat hemodynamickou stabilitu, což by následně mohlo vést ke zlepšení tkáňové perfuze a oxygenace. Chybí však dostatek studií srovnávajících krystaloidní a koloidní roztoky v bariatrické chirurgii. Údaje z některých RCT uvádějí prospěch z podání balancovaných krystaloidů a z omezení užívání 0,9 % fyziologického roztoku.
Existují středně kvalitní důkazy podporující individuální cílenou tekutinovou terapii, která se vyhýbá jak restriktivním, tak liberálním strategiím (tab. 3).
Standardizovaný anestetický protokol
Krátkodobě působící látky a minimální použití opioidů během operace jsou důležité pro zlepšení zotavení. Indukce anestezie by měla být přednostně založena na hmotnosti netukové tkáně, aby se zabránilo hypotenzi, zatímco použití celkové tělesné hmotnosti může být vhodnější pro udržovací infuzi. Klasické modely řízené infuze (TCI – target-controlled infusion) mají při použití u pacientů s obezitou špatnou prediktivní schopnost. Propofol je nejčastěji používanou indukční látkou a nebylo prokázáno, že by zvyšoval výskyt rhabdomyolýzy související se syndromem propofolu u pacientů s těžkou obezitou během standardní bariatrické chirurgie. Pokud se k udržení anestezie použijí inhalační anestetika, může desfluran nabídnout rychlejší dobu probouzení ve srovnání se sevofluranem nebo isofluranem u pacientů s BMI > 30 kg/m2. Na rozdíl od sevofluranu s jeho bronchodilatačními účinky však desfluran může vyvolat zvýšenou rezistenci dýchacích cest a také hypertenzi a tachykardii. Rozhodnutí o tom, kterou inhalační látku použít, by proto mělo být stanoveno na základě existujících komorbidit a dalších souvisejících faktorů.
Bispektrální index (BIS) představuje jeden z několika způsobů monitorování hloubky anestezie s cílem snížit peroperační stav vědomí a snížit množství podaného anestetika. Pro monitorování peroperačního stavu vědomí lze použít BIS nebo monitorování anestetického plynu na konci výdechu (ETAG – end-tidal anaesthetic gas). U obou bylo prokázáno, že podobně snižují míru informovanosti o stavu vědomí během operace ve srovnání s použitím pouze klinických příznaků.
Pacienti s obezitou obecně vykazují zvýšenou citlivost vůči sedativním účinkům opioidů a následně vyšší náchylnost k respirační depresi. Ve snaze snížit výskyt a závažnost pooperační bolesti byla obhajována multimodální analgezie s použitím omezených dávek opioidů. Lidokain, dexmedetomidin, ketamin a hořčík, pokud se používají jako součást anestezie bez opioidů, mohou mít lepší protizánětlivé účinky než klasická anestezie na bázi opioidů, a proto mohou být výhodnější. Navíc vhodné užívání nesteroidních protizánětlivých léků (NSAID) snižuje spotřebu opioidů. Jedním z omezení většiny NSAID je, že se jedná o analgetika s „nízkým stropem“ (low-ceiling analgesics). Paracetamol je bez krvácivých, žaludečních a renálních nežádoucích účinků, které omezují použití NSAID.
Bylo prokázáno, že regionální anestetické techniky jsou vysoce účinné při snižování potřeby opioidů. Epidurální analgezie je na pooperační bolest účinná, ale není vhodná u laparoskopické chirurgie. Ultrazvukem naváděná regionální analgezie TAP blok (transversus abdominis plane block) může snížit skóre bolesti a potřebu opioidů a uspíšit pohyb a chůzi po bariatrické operaci. Infiltrace bupivakainu 0,5 % před incizí vede ke snížení spotřeby opioidů a pooperační bolesti. Dalšími slibnými strategiemi jsou intraperitoneální instilace bupivakainu a regionální analgezie oblasti m. erector spinae.
Ačkoli současné důkazy nedovolují doporučovat konkrétní anestetika nebo techniky, existuje vysoká úroveň důkazů na podporu použití multimodálních analgetik šetřících opioidy ke zlepšení pooperační rekonvalescence (tab. 4).
Zajištění dýchacích cest
Některé studie uvádějí souvislost mezi těžkou obezitou a obtížnou intubací. Faktory spojené s obtížnou intubací byly věk > 46 let, mužské pohlaví, skóre 3–4 podle Mallampattiho hodnocení, thyromentální vzdálenost (vzdálenost od zářezu štítné žlázy ke špičce čelisti s nataženou hlavou) < 6 cm a přítomnost intaktního chrupu. Muži s těžkou obezitou, zejména s BMI > 50 kg/m2 a se syndromem spánkové apnoe (OSA – obstructive sleep apnoa), a také pacienti s obvodem krku > 42 cm měli vyšší riziko obtížné ventilace maskou a intubace. Použití jednoduché nosní nebo vysokoprůtokové nosní kanyly by mělo být zváženo jako doplněk během ventilace maskou u pacientů s podezřením nebo známou obtížnou intubací. Bylo prokázáno, že to pomáhá udržovat oxygenaci prodloužením doby apnoe až o 40 % a může snížit periintubační desaturaci během úvodu do anestezie.
Použití videolaryngoskopu může zlepšit vizualizaci hlasivkové štěrbiny a zvýšit úspěšnost prvního pokusu o intubaci ve srovnání s běžnými lžícemi laryngoskopu, zejména při nálezu obtížných dýchacích cest. Výsledky však zůstávají heterogenní, pokud jde o jeho účinnost. Pokud je třeba provést tracheostomii u pacienta s významnou obezitou, může to trvat mnohem déle, než by tomu bylo u pacienta bez obezity, a tracheostomie je spojena s vyšší mírou komplikací.
Pokud nelze ihned po extubaci udržet adekvátní hladinu kyslíku, doporučuje se použití kontinuální terapie pozitivním tlakem v dýchacích cestách (CPAP – continuous positive airway pressure). Pozitivní tlak v dýchacích cestách by měl pokračovat, dokud se pacientova dechová frekvence a úsilí nevrátí k normálu a po dobu alespoň 1 hod nedojde k epizodám hypopnoe a apnoe (tab. 4).
Strategie ventilace
Zatímco u protektivní ventilace mohou hrát roli různé strategie, navrhovaná opatření k ochraně plic před ventilovaným poškozením plic zahrnují nízké dechové objemy (VT) a nízkou hladinu pozitivního end-exspiračního tlaku (PEEP) bez recruitment manévrů.
U pacientů s obezitou se objem plic nezvyšuje proporcionálně s tělesnou hmotností. Při odhadování VT může být preferováno použití predikované tělesné hmotnosti (PBW – predicted body weight), která bere v úvahu výšku a pohlaví pacienta spíše než skutečnou tělesnou hmotnost. Nízký fyziologický VT může být ochranou plic u pacientů se syndromem akutní respirační tísně (ARDS), stejně jako u pacientů se zdravými plícemi v celkové anestezii. Současné důkazy naznačují, že dechový objem v rozmezí 6–8 mg/kg tělesné hmotnosti může snížit plicní komplikace a měl by být použit u všech pacientů se zdravými plícemi bez ohledu na obezitu.
Pacienti s obezitou jsou predisponováni k rozvoji atelektázy především v dependentních plicních oblastech, což z kombinace recruitment manévrů (RM) a PEEP činí strategii ke zlepšení výměny plynů a mechaniky plic. Existuje mnoho nejasného ohledně optimální úrovně PEEP pro pacienty s obezitou a zdravými plícemi. Požadavky PEEP se mezi pacienty značně liší. Příjem nízkého VT během anestezie a individuální nastavení PEEP mohou snížit pooperační atelektázu a zároveň zlepšit peroperační výměnu plynů a driving pressure (rozdíl mezi tlakem v plateau a PEEP), což naznačuje, že k ochraně plic by mohly být použity individualizované úrovně PEEP zaměřené na fyziologické cíle.
Rozdíl mezi tlakem v plató a PEEP může být spojen se zvýšeným rizikem závažných nežádoucích následků u pacientů se syndromem akutní respirační tísně a také u pacientů podstupujících elektivní operaci. Pacienti s obezitou mohou vyžadovat vyšší mezní hodnoty protektivního driving pressure než pacienti bez obezity kvůli nízké kapacitě plic nebo fyziologickým změnám vyskytujícím se během chirurgického výkonu.
Tlakově řízená ventilace (PCV – pressure-controlled ventilation) může podporovat homogennější ventilaci v různých plicních kompartmentech, což zase zmírňuje nadměrné alveolární roztažení a zlepšuje oxygenaci. Na druhé straně objemově řízená ventilace (VCV – volume-controlled ventilation) umožňuje lepší kontrolu VT během výkonů intermitentně ovlivňujících poddajnost hrudní stěny a může být spojena s nižší incidencí pooperačních plicních komplikací.
Existují středně silné důkazy na podporu použití projektivní plicní ventilace s vyvarováním se vysokým hodnotám PEEP. PCV nebo VCV lze použít s obráceným respiračním poměrem, v ideálním případě se vyhnout zvýšení hnacího tlaku v důsledku úprav PEEP, ale úroveň důkazů zůstává nízká (tab. 4).
Neuromuskulární blokáda
Neuromuskulární blokáda (NMB) je nezbytná pro laparoskopickou nebo roboticky asistovanou operaci pro redukci hmotnosti. I když existují kontroverzní studie, současné údaje naznačují přínos hluboké NMB u pacientů podstupujících bariatrické výkony.
Hluboká NMB vyžaduje její rychlé a úplné zrušení na konci operace. Zatímco účinky reziduálního NMB nebyly v bariatrické chirurgii specificky studovány, mnoho fyziologických nálezů spojených s tímto stavem může mít zvýšený význam pro populaci bariatrické chirurgie. To vystavuje pacienty s těžkou obezitou zvýšenému riziku pooperačních plicních komplikací, jako je plicní atelektáza, pneumonie, a dokonce respirační selhání. NMB by měla být u pacientů úplně ukončena. Pacienti by měli být pečlivě sledováni objektivními metodami hodnocení reziduální neuromuskulární blokády během operace a po reverzi na konci operace.
Hodnota TOF (train of four) ≥ 0,9 se promítá do přínosu pro zotavení tím, že se vyhne rekurarizaci a reintubacím souvisejícím s přetrvávající blokádou. Sugammadex ruší středně závažnou blokádu 6,5krát rychleji než neostigmin a hlubokou neuromuskulární blokádu 16,8krát rychleji než neostigmin a ve srovnání s tradičními reverzními přípravky je spojován s menším počtem nežádoucích účinků.
Dávka sugammadexu by měla být upravena podle hloubky NMB a tělesné hmotnosti, aby byla umožněna úplná a rychlá reverze. Zdá se, že dávka 2 mg/kg tělesné hmotnosti + 40 % poskytuje rovnováhu mezi rychlým a úplným zotavením a příznivým profilem vedlejších účinků. Incidence potvrzené hypersenzitivity se pohybuje kolem 5 % a anafylaxe 0,3 %, přičemž k anafylaxi dochází pouze při dávce 16 mg/kg. Ve skutečnosti se zdá, že výskyt hypersenzitivních reakcí je hlášen mnohem méně a dávka 2 mg/kg tělesné hmotnosti + 40 % se zdá být nejvhodnější pro populaci v bariatrické chirurgii.
Obecně by se měla používat hluboká NMB s tím, že s tradičními reverzními přípravky nemusí být reverzibilní, dokud TOF není ≥ 3, zatímco reverze se sugammadexem by umožnila rychlejší zotavení a optimální dobu na operačním sále (tab. 4).
Operační technika, objem a trénink
Laparoskopická metoda je dnes samozřejmým zlatým standardem bariatrické chirurgie. Většina studií srovnávajících laparoskopickou a otevřenou techniku v bariatrické chirurgii tak byla provedena na počátku laparoskopické éry. Současná úroveň důkazů o srovnání mezi laparoskopickou a otevřenou operací tak stěží odpovídá současné klinické praxi. Ve srovnání s otevřenou operací existují středně kvalitní důkazy o tom, že laparoskopický přístup v bariatrické chirurgii je spojen s kratší hospitalizací a časnější rekonvalescencí. Existují vysoce kvalitní důkazy o souvislosti se sníženým výskytem ranných infekcí a kýl. Pro komplikace obecně, pro dobu trvání operace a pro riziko reoperace jsou omezené důkazy ve prospěch laparoskopie.
V roce 2016 byly třemi nejčastěji prováděnými primárními chirurgickými bariatrickými/metabolickými výkony celosvětově sleeve gastrektomie (SG, 54 %), Roux-en-Y gastrický bypass (RYGB, 30 %) a minigastrický bypass (OAGB – one anastomosis gastric bypass, 5 %) [2].
Neexistují žádné studie, které by porovnávaly proveditelnost zrychleného zotavení mezi různými bariatrickými postupy. Výhody a bezpečnost při použití protokolu ERAS byly prokázány po všech nejběžnějších bariatrických operacích.
K dispozici jsou omezené údaje o vlivu objemu výkonů v nemocnici na perioperační bezpečnost v prostředí ERAS, nicméně vliv počtu operací v tradiční perioperační péči byl aktivně studován pro bariatrickou chirurgii. Nedávná studie hodnotila téměř 40 000 bariatrických chirurgických výkonů provedených v 19 velkoobjemových centrech a uváděla standardní míru komplikací 7,2 % pro RYGB a 6,2 % pro SG [22]. Systematický přehled prokázal zlepšené výsledky pacientů u „velkoobjemových“ chirurgů a institucí [23]. Existují tedy důkazy nízké kvality na podporu lepších výsledků ve velkoobjemových centrech.
Mnoho center uznává metodu fast tracku a současně se podílí také na školení nových bariatrických chirurgů. Během procesu křivky učení lze očekávat delší dobu operace a dokonce vyšší míru komplikací. Předchozí zkušenosti s laparoskopickou operací stejně jako přijetí individualizovaného a komplexního tréninkového programu mohou zlepšit chirurgickou dovednost. Kromě toho může aktivní koučování a mentoring od zkušených bariatrických chirurgů vést ke kratší operační době a nižší míře komplikací během chirurgického tréninku (tab. 4).
Komentář PS: V otázce operační techniky při staplerových resekcích navrhuje pracovní skupina pro kontrolu krvácení užít přechodnou farmakologicky vyvolanou elevaci krevního tlaku po provedení samotné resekce. Jako bezpečnou považuje hodnotu systolického tlaku do 140 mmHg. Na indikaci ke konverzi se skupina shodla, že rozhodující je zkušenost operatéra a zvyklost daného pracoviště.
Břišní drenáž a nazogastrická dekomprese
Senzitivita drenáže břišní dutiny (mezi 0 a 94 %) pro detekci pooperačního leaku po RYGB byla již dříve hodnocena v systematickém přehledu zahrnujícím 18 kohortních studií. Následná observační studie zahrnující více než 140 000 pacientů neprokázala žádné příznivé účinky rutinní abdominální drenáže po bariatrické operaci, ale spíše zvýšenou morbiditu [24]. Existují jen velmi malá data, která nepotvrzují snížení anastomotického prosakování s nazogastrickou dekompresí u pacientů podstupujících bariatrickou operaci. Neexistují žádné důkazy podporující rutinní drenáž břišní dutiny nebo nazogastrickou dekompresi po bariatrické operaci (tab. 4).
Komentář PS: I když velká observační studie neprokázala žádné příznivé účinky rutinní abdominální drenáže po bariatrické operaci, na některých českých bariatrických pracovištích se stále ještě drény zavádějí rutinně. Jejich důvodem je snaha o co nejrychlejší detekci případného časného leaku s rychlou adekvátní reakcí. Proto pracovní skupina nedošla při hlasování k silné shodě s doporučením ERABS, ale jen ke shodě (souhlas 75–90 % hlasujících). Nezbývá tak než konstatovat, že drenáž břišní dutiny po bariatrické operaci by měla být konkrétně zdůvodněna (ošetření většího peroperačího krvácení nebo jeho nedostatečná kontrola, technicky obtížný výkon apod). Rutinní drenáž zůstává na některých pracovištích jejich lokální zvyklostí.
Pooperační položky
Pooperační oxygenace
Obezita je spojena se zvýšenou dechovou námahou a také s vyšším rizikem déle přetrvávající perioperační atelektázy ve srovnání s pacienty s normální hmotností. Navíc častým nálezem u pacientů s těžkou obezitou je syndrom spánkové apnoe (OSA). Syndrom je spojen se zvýšeným rizikem kardiopulmonálních příhod a s významnou mortalitou, zejména v případech s vysokým indexem apnoe-hypopnoe. Dotazník STOP-BANG (chrápání, únava během dne, pozorovaná apnoe, vysoký krevní tlak, BMI, věk, obvod krku, pohlaví) může být použit v předoperačním hodnocení k identifikaci pacientů s vysokým rizikem výskytu touto komorbiditou. Pacienti s OSA byli historicky považováni za osoby s vysokým rizikem perioperačních komplikací, zejména respiračního charakteru. Pacienti s hypoventilačním syndromem obézních mohou vykazovat ještě vyšší riziko kardiopulmonálních komplikací a delší pobyt v nemocnici ve srovnání s pacienty se samotnou OSA.
Moderní minimálně invazivní chirurgické techniky v kombinaci s důrazem na opioidy šetřící analgetické přístupy a použití léčby pomocí CPAP/BiPAP v případě potřeby mohou snížit riziko kardiopulmonálních komplikací u pacientů s OSA, kteří podstoupí bariatrickou operaci. Protože k většině potenciálně nebezpečných hypoxických příhod dochází těsně po přerušení anestezie nebo po podání opioidů, bude pro většinu pacientů postačovat standardní nebo mírně prodloužené pozorování na dospávacím pokoji. Pooperační polohování v polosedě brání dalšímu rozvoji atelektázy a může zlepšit oxygenaci. Suplementace kyslíkem zlepšuje saturaci kyslíkem, ale může prodloužit dobu a čas do detekce apnoe/hypopnoe, stejně jako rozpoznání retence oxidu uhličitého, a proto by měla být používána s opatrností. Léčba pozitivním tlakem v dýchacích cestách může být použita k prevenci hypoxických příhod v pooperační fázi a měla by pokračovat u pacientů užívajících léčbu CPAP/BiPAP před operací, aby se snížilo riziko apnoe a dalších komplikací.
Kromě toho by u pacientů s hypoxemií (definovanou jako saturace kyslíkem < 90 %) během bezprostředního pooperačního období měla být široce používána neinvazivní léčba pozitivním tlakem, jako je CPAP nebo NIPPV (neinvazivní intermitentní ventilace s pozitivním tlakem) (s doplňkovým kyslíkem, nebo bez něj). Standardizovaná kritéria pro propuštění mohou být použita pro rozhodování, kdy je pacient připraven k propuštění z dospávacího pokoje, kromě uspokojivého klinického hodnocení, které zajistí, že pacient má stabilní vitální funkce, včetně adekvátní dechové frekvence a hloubky. Konečně, jak již bylo uvedeno dříve, se doporučuje minimalizovat systémové užívání opioidů, aby se snížily epizody apnoe/hypopnoe (tab. 5).
Tromboprofylaxe
Tromboembolické komplikace nadále představují hlavní příčinu morbidity a mortality po bariatrické operaci. Mezi rizikové faktory kromě obezity samotné patří anamnéza žilního tromboembolizmu, zvýšený věk, kouření, křečové žíly, srdeční nebo respirační selhání, OSA, trombofilie a estrogenní perorální antikoncepce.
V praxi bariatrické chirurgie existují velké rozdíly, zejména pokud jde o délku léčby a výši dávky. V literatuře je nedostatek vysoce kvalitních studií, které by informovaly o klinické praxi.
Cochranův přehled z roku 2018 dospěl k závěru se středně kvalitními důkazy, že kombinace intermitentní pneumatické komprese dolních končetin a farmakologické profylaxe snižuje výskyt hluboké žilní trombózy (DVT – deep venous thrombosis) a plicní embolie [25]. Kromě toho jiný Cochranův přehled s vysoce kvalitními důkazy dospěl k závěru, že jsou stupňované kompresní punčochy samy o sobě účinné při snižování rizika hluboké žilní trombózy u hospitalizovaných pacientů, kteří podstoupili obecný chirurgický zákrok.
Doporučení Americké společnosti metabolické a bariatrické chirurgie (ASMBS) navrhuje tromboprofylaxi, včetně nefrakcionovaného heparinu nebo nízkomolekulárního heparinu (LMWH), podávanou do 24 hod po operaci u všech pacientů po bariatrické operaci [10].
Systematický přehled zahrnující 20 studií naznačil, že pro tromboprofylaxi s LMWH by se u pacientů s BMI ≥ 40 kg/m2 měl zvážit enoxaparin 40 mg dvakrát denně, dalteparin 5 000 IE dvakrát denně nebo tinzaparin 75 IU/kg jednou denně.
Studie se 105 pacienty s použitím stanovení hladiny antiXa prokázala, že tromboprofylaktické dávkování enoxaparinu na základě BMI po bariatrické operaci může být suboptimální u 15 % pacientů a předávkování bylo častější než poddávkování. Pro optimalizaci dávkování bylo navrženo, že u vysoce rizikových pacientů s bariatrickým chirurgickým zákrokem je třeba zvážit vyšetření hladiny antiXa.
Ve velké studii bylo hlášeno 28násobné zvýšení rizika mortality u pacientů s žilními tromboembolickými příhodami a k více než 80 % došlo po propuštění. U vysoce rizikových pacientů by proto měla být zvážena rutinní farmakoprofylaxe po propuštění, která přesahuje standardní léčbu.
Pokud jde o použití vyjímatelných filtrů dolní duté žíly v kontextu bariatrické chirurgie, systematický přehled naznačil, že neexistují žádné důkazy, které by naznačovaly, že potenciální přínosy převažují nad významnými riziky.
Novou tromboembolickou komplikací je portomezentrická trombóza a trombóza slezinné žíly. Systematický přehled naznačil, že je nejčastější po SG a že portální žíla je nejčastěji postiženou cévou s incidencí od 0,37 do 1 %. Jsou zapotřebí další studie o dopadu strategií profylaxe ke snížení této specifické komplikace (tab. 5).
Časná pooperační nutriční péče
V rámci posouzení a přípravy na bariatrickou operaci by měli být pacienti komplexně vyšetřeni nutričním terapeutem. Režim čirých tekutin lze obvykle zahájit několik hodin po operaci před přechodem na výživné tekutiny (sipping). Dietetické konzultace by měly zahrnovat rady ohledně postupného zahušťování stravy, specifické pro daný chirurgický zákrok a obvyklou praxi bariatrického centra.
Pacienti budou doma pokračovat v navyšování stravy o různé hustotě. Jsou povzbuzováni, aby jedli pomalu, dobře žvýkali jídlo a vyhýbali se pití současně s jídlem. V prvních pooperačních týdnech jsou pacienti ohroženi rozvojem deficitu thiaminu kvůli relativně malým zásobám v kombinaci s rychlým úbytkem hmotnosti a nedostatečným nutričním příjmem. Toto riziko se dále zvyšuje v přítomnosti zvracení, průjmu nebo nedodržování vitaminových a minerálních doplňků. Pokud je podezření na riziko nedostatku thiaminu, musí být okamžitě substituován.
Dietolog poradí s příjmem bílkovin. Obecně se po bandáži žaludku, SG a RYGB, doporučuje alespoň 60–80 g/den celkového příjmu bílkovin nebo 1,0–1,5 g/kg ideální tělesné hmotnosti (IBW). Nicméně malabsorpční postupy, jako je biliopankreatická diverze s duodenálním switchem, minigastrický bypass a single anastomosis duodenoileální bypass (SADIS), zvyšují riziko protein-energetické malnutrice. V důsledku toho se pak doporučuje příjem bílkovin alespoň 90 g/den nebo až 2,1 g/kg ideální tělesné hmotnosti (tab. 5).
Komentář PS: Všichni pacienti by měli podstoupit komplexní vyšetření svého nutričního stavu a diety s následným doporučením obsahu makro- a mikronutrientů v dietě na základě typu chirurgického výkonu a nutričního stavu pacienta. V českých podmínkách při stravě bohaté na obiloviny je nedostatek thiaminu raritní.
Suplementace vitaminů a minerálů
Nezbytné je pooperační dietetické sledování. Po bariatrické operaci je zvýšené riziko nedostatku železa, kyseliny listové, vitaminu B12, vitaminu D a stopových prvků zinku, mědi a selenu. Malabsorpční výkony mohou dále zvýšit riziko nedostatku vitaminů A, E a K. V důsledku toho jsou pacienti povinni dodržovat režim celoživotního doplňování vitaminů a minerálů a nutriční biochemické monitorování. Doplňky a biochemické monitorování se liší podle chirurgického postupu a úplné podrobnosti lze nalézt ve výživových doporučeních pro bariatrickou chirurgii (tab. 5) [26,27].
Komentář PS: Pracovní skupina ve shodě s adaptovaným doporučením ERABS zdůrazňuje nezbytné celoživotní pooperační sledování pacienta s trvalou suplementací vitaminů a minerálů po kombinovaných a malabsorpčních výkonech na podkladě pravidelného laboratorního a nutričního sledování. U restriktivních výkonů není suplementace nezbytná. Pacient by měl být o tomto aspektu předoperačně podrobně informován.
Pooperační profylaxe
Inhibitory protonové pumpy
Celkový výskyt vředů v anastomóze se pohybuje od 0,6 do 25 % [28]. Několik studií uvádí významné snížení těchto vředů, pokud jsou inhibitory protonové pumpy (PPI – proton pump inhibitors) používány profylakticky v perioperační fázi, zejména pokud jsou používány déle než 3 měsíce. Při použití standardizované chirurgické techniky s malým žaludečním pouchem však byla potřeba profylaxe PPI zpochybněna. I když se uznávají slabé důkazy o podpoře, profylaktické použití PPI je bezpečné a bez významných nákladů. Tyto léky lze tedy zvážit pro pooperační profylaxi po RYGB. Pokud jsou použity, měly by být po operaci bypassu žaludku podávány vyšší dávky než standardní kvůli snížené absorpci. Kromě toho by otevření kapslí mohlo zlepšit pooperační vstřebávání, a mělo by být proto zváženo.
Neexistují žádné studie zabývající se přínosy použití PPI po sleeve gastrektomii. Zatímco v některých studiích se uvádí vysoká míra refluxu a komplikací souvisejících s refluxem, neexistuje dostatek důkazů, které by daly nějaká silná doporučení ohledně použití PPI po sleeve gastrektomii (tab. 5).
Prevence žlučníkových kamenů
Pět RCT (čtyři zaměřené na RYGB a jedna na SG), zahrnujících celkem 616 pacientů, uvádělo významné snížení pooperační tvorby žlučových kamenů užíváním kyseliny ursodeoxycholové u pacientů bez žlučových kamenů v době operace. Zatímco optimální dávka zůstává kontroverzní, tyto studie naznačují, že 500–600 mg může být dostačující. Výsledky jsou dále posíleny metaanalýzou zaměřenou na tři studie pro RYGB a tři pro SG různých designů, ukazující přínos pro pacienty, kterým byla předepsána kyselina ursodeoxycholová k pooperační profylaxi. Placebem kontrolovaná RCT s 985 pacienty 24 měsíců sledovala vliv profylaktického podávání kyseliny ursodeoxycholové v dávce 900 mg po dobu 6 měsíců po operaci [29]. Studie sice nepotvrdila profylaktický účinek na pooperační výskyt symptomatických žlučníkových kamenů po bariatrických operacích všeobecně, ale u RYGB k redukci výskytu kamenů došlo. Výsledky této studie nebyly známy do ukončení doporučení Stenbergovy skupiny (studie byla publikována v prosinci 2021).
Nejsou k dispozici žádné údaje o potenciálním účinku kyseliny ursodeoxycholové na prevenci zvýšeného výskytu žlučníkových kamenů obecně, ale u RYGB k redukci pooperačního výskytu symptomatických žlučníkových kamenů dochází (tab. 5).
Systematický přehled observačních studií dospěl k závěru, že současnou cholecystektomii u pacientů se symptomatickým onemocněním žlučových kamenů lze považovat za bezpečnou. Sekvenční přístup s cholecystektomií před bariatrickou operací však může být stejně bezpečný a účinný. I když stupeň důkazů zůstává nízký, důrazně se doporučuje zvážit cholecystektomii před bariatrickou operací nebo v době bariatrické operace u pacientů se symptomatickým onemocněním žlučníkových kamenů.
Specifické úvahy u pacientů s diabetem
Úvaha o diabetu je dodatkem k těmto doporučením.
Ve většině zpráv o pacientech podstupujících bariatrickou operaci má 15–20 % pacientů diabetes 2. typu. Sacharidová zátěž je spojena s výraznou hyperglykemií u pacientů s diabetem. V několika studiích u pacientů podstupujících nebariatrické operace se také uznává, že hyperglykemie je spojena s horšími výsledky, včetně zvýšených komplikací a mortality v těžkých případech diabetu. Potřeba zaměřit se na péči o tyto pacienty je proto zásadní a potřeba doporučení je naléhavá.
Na rozdíl od jiných typů operací zlepšuje bariatrická chirurgie glukózovou homeostázu u pacientů s diabetem 2. typu díky různým mechanizmům již v bezprostředním pooperačním období. Proto je často potřeba upravit dávku předepsaných léků snižujících hladinu glukózy. To by mělo být zváženo co nejdříve, protože vhodné plánování může usnadnit časné propuštění a snížit dobu hospitalizace. Pacienti s diabetem, kterým je předepsána předoperační LCD/VLCD dieta, by si také měli být vědomi rizika hypoglykemie během tohoto období, a proto mohou potřebovat také úpravy dávek antidiabetik.
Je třeba poznamenat, že některé poznatky získané z péče ERAS u pacientů s diabetem podstupujících bariatrickou operaci mohou být relevantní pro jiné typy operací trávicího traktu, zejména pro resekci jícnu pro karcinom.
Závěrečná zhodnocení
Proces ERAS zahrnují položky založené na důkazech navržené ke snížení perioperačního stresu a udržení pooperačních fyziologických funkcí. Tyto cesty byly poprvé přijaty pro kolorektální chirurgii v roce 2005, ale dnes jsou k dispozici pokyny ERAS pro celou řadu oblastí chirurgie. Dodržování aktualizovaného protokolu ERAS bylo spojeno se sníženou krátkodobou a dlouhodobou morbiditou, stejně jako se zlepšenou rekonvalescencí, zkrácením doby hospitalizace v nemocnici a sníženými náklady na léčbu po velké břišní operaci [30,31]. V moderní bariatrické chirurgii bylo široce akceptováno použití několika položek protokolu ERAS a ukázalo se, že je spojeno s nízkou mírou perioperačních komplikací a rychlejší rekonvalescencí. Kvalita důkazů pro mnoho intervencí ERAS je však v bariatrickém prostředí relativně nízká a pro praxi založenou na důkazech bude možná nezbytné extrapolovat z jiných operací. Vyšší kvalita důkazů by vyžadovala další potvrzení ze strany RCT nebo velkých registrů. Protože některé důkazy často nemusí být odůvodněné z etického hlediska nebo nemusí být jinak proveditelné, lze předpokládat, že kvalita důkazů zůstane nízká. Chybí také studie, které by se zabývaly ukazateli výsledků hlášenými pacienty a také nákladovou efektivitou některých intervencí. Ačkoli takové studie nemusí zlepšit kvalitu důkazů na podporu konkrétních položek, mohou rozšířit znalosti a poskytnout více komplexní pochopení vlivu specifických intervencí, stejně jako vlivu klinických protokolů.
Výhody dodržování protokolu ERAS v bariatrické chirurgii bylo tedy možné prokázat vysokou kvalitou důkazů pouze pro funkční zotavení a nemocniční délky hospitalizace [3,4].
Od zveřejnění první verze pokynů ERAS pro bariatrickou chirurgii v roce 2016 [5] ovlivnily výsledky nových studií úroveň důkazů pro určitá doporučení, zatímco jiná zůstávají stejná. Další pozornost si zaslouží ERAS u pacientů se specifickými komorbiditami, kteří mohou mít potenciálně složitější perioperační průběh, jako jsou pacienti s diabetem či s kardiovaskulárními a psychiatrickými komorbiditami. S dobře zdokumentovaným účinkem ERAS na snížení peri- operačního stresu lze očekávat, že přínos ve smyslu snížení perioperační morbidity bude zvláště patrný u těchto skupin pacientů.
ORCID autorů
I. Satinský ORCID 0000-0002-7790-410X,
M. Hrubý ORCID 0000-0002-6549-2937,
M. Čierný ORCID 0000-0002-4925-4621,
M. Haluzík ORCID 0000-0002-0201-6888.
Doručeno/Submitted: 31. 8. 2023
Přijato/Accepted: 31. 10. 2023
MUDr. Igor Satinský, Ph.D.
Mezioborová jednotka intenzivní péče
Centrum pro chirurgickou léčbu obezity
Nutriční ambulance
Nemocnice Havířov, p. o.
Dělnická 1132/24
736 01 Havířov
igor.satinsky@nemhav.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Satinský I, Hrubý M, Šrámková P et al. Praktické klinické doporučení pro perioperační péči v bariatrické chirurgii 2023. Rozh Chir 2023; 102(7): 283–297. doi: 10.33699/PIS2023.102.7.283-297.
2. Angrisani L, Santonicola A, Iovino P et al. IFSO Worldwide survey 2016: primary, endoluminal, and revisional procedures. Obes Surg 2018; 28(12): 3783–3794. doi: 10.1007/s11695-018-3450-2.
3. Parisi A, Desiderio J, Cirocchi R et al. Enhanced recovery after surgery (ERAS): a systematic review of randomised controlled trials (RCTs) in bariatric surgery. Obes Surg 2020; 30(12): 5071–5085. doi: 10.1007/s11695-020-05000-6.
4. Geubbels N, Evren I, Acherman YIZ et al. Randomized clinical trial of an enhanced recovery after surgery programme versus conventional care in laparoscopic Roux-en-Y gastric bypass surgery. BJS Open 2019; 3(3): 274–281. doi: 10.1002/bjs5.50143.
5. Thorell A, MacCormick AD, Awad S et al. Guidelines for perioperative care in bariatric surgery: enhanced recovery after surgery (ERAS) society recommendations. World J Surg 2016; 40(9): 2065–2083. doi: 10.1007/s00 268-016-3492-3.
6. Stenberg E, Falcão LF, O‘Kane M et al. Guidelines for Perioperative Care in Bariatric Surgery: Enhances Recovery After Surgery (ERAS) Society Recommandations: A 2021 Update. World J Surg 2022; 46(4): 729–751. doi: 10.1007/s00268-021-06394-9.e.
7. Guyatt GH, Oxman AD, Kunz R et al. Going from evidence to recommendations. BMJ 2008; 336(7652): 1049–1051. doi: 10.1136/bmj.39493. 646875.AE.
8. Guyatt GH, Oxman AD, Kunz R et al. What is „quality of evidence“ and why is it important to clinicians? BMJ 2008; 336(7651): 995–998. doi: 10.1136/bmj.39490.551019.BE.
9. German Association of the Scientific Medical Societies (AWMF) – Standing Guidelines Commission. AWMF guideline manual and rules for guideline development. 2012 [online]. Dostupné z: https: //www.awmf.org/regelwerk/.
10. Mechanick JI, Apovian C, Brethauer S et al. Clinical practice guidelines for the perioperative nutrition, metabolic, and nonsurgical support of patients undergoing bariatric procedures – 2019 update: cosponsored by american association of clinical endocrinologists/American college of endocrinology, the obesity society, american society for metabolic & bariatric surgery, obesity medicine association, and american society of anesthesiologists – executive sum- mary. Endocr Pract 2019; 25(12): 1346–1359. doi: 10.4158/GL-2019-0406.
11. NIH conference (1991) Gastrointestinal surgery for severe obesity. Consensus Development Conference Panel. Ann Intern Med 1991; 115(12): 956–961.
12. NICE. Obesity: identification, assessment and management. 2014 [online]. Dostupné z: www.nice.org.uk/guidance/cg189.
13. Rubino F, Nathan DM, Eckel RH et al. Metabolic Surgery in the Treatment Algorithm for Type 2 Diabetes: A Joint Statement by International Diabetes Organizations. Diabetes Care 2016; 39(6): 861–877. doi: 10.2337/dc16-0236.
14. Eisenberg D, Shikora SA, Aarts E et al. 2022 American Society of Metabolic and Bariatric Surgery (ASMBS) and International Federation for the Surgery of Obesity and Metabolic Disorders (IFSO) Indications for Metabolic and Bariatric Surgery. Surg Obes Relat Dis 2022; 18(12): 1345–1356. doi: 10.1016/j.soard.2022.08.013.
15. Šrámková P, Fried M. Antiobezitika před bariatrickou operací a po ní – jak je využít co nejlépe. Čas Lék čes 2022; 161(3–4): 107–113.
16. Hughes MJ, Hackney RJ, Lamb PJ et al. Prehabilitation before major abdominal surgery: a systematic review and meta-analysis. World J Surg 2019; 43(7): 1661–1668. doi: 10.1007/s00268-019-04950-y.
17. Singh PP, Srinivasa S, Lemanu DP et al. Statins in abdominal surgery: a systematic review. J Am Coll Surg 2012; 214(3): 356–366. doi: 10.1016/j.jamcollsurg.2011.11.008.
18. Ljungqvist O, Jonathan E. Rhoads lecture 2011: Insulin resistance and enhanced recovery after surgery. JPEN J Parenter Enteral Nutr 2012; 36(4): 389–398. doi: 10.1177/0148 607112445580.
19. Gan TJ, Belani KG, Bergese S et al. Fourth consensus guidelines for the management of postoperative nausea and vomiting. Anesth Analg 2020; 131(2): 411–448. doi: 10.1213/ANE.0000000000004833.
20. Bamgbade OA, Oluwole O, Khaw RR. Perioperative antiemetic therapy for fast-track laparoscopic bariatric surgery. Obes Surg 2018; 28(5): 1296–1301. doi: 10.1007/s11695-017-3009-7.
21. Reiterer C, Kabon B, Zotti O et al. Effect of goal-directed crystalloid – versus colloid-based fluid strategy on tissue oxygen tension: a randomised controlled trial. Br J Anaesth 2019; 123(6): 768–776. doi: 10.1016/j.bja.2019.08.027.
22. Gero D, Raptis DA, Vleeschouwers W et al. Defining global benchmarks in bariatric surgery: a retrospective multicenter analysis of minimally invasive roux-en-y gastric bypass and sleeve gastrectomy. Ann Surg 2019; 270(5): 859–867. doi: 10.1097/SLA.0000000000003512.
23. Zevin B, Aggarwal R, Grantcharov TP. Volume-outcome association in bariatric surgery: a systematic review. Ann Surg 2012; 256(1): 60–71. doi: 10.1097/SLA.0b013e3182554c62.
24. Doumouras AG, Maeda A, Jackson TD. The role of routine abdominal drainage after bariatric surgery: a metabolic and bariatric surgery accreditation and quality improvement program study. Surg Obes Relat Dis 2017; 13(12): 1997–2003. doi: 10.1016/j.soard.2017.08.019.
25. Kakkos SK, Caprini JA, Geroulakos G et al. Combined intermittent pneumatic leg compression and pharmacological prophylaxis for prevention of venous thromboembolism. Cochrane Database Syst Rev 2016; 9(9): CD005258. doi: 10.1002/14651858.CD005258.pub4.
26. Parrott J, Frank L, Rabena R et al. American society for metabolic and bariatric surgery integrated health nutritional guidelines for the surgical weight loss patient 2016 update: micronutrients. Surg Obes Relat Dis 2017; 13(5): 727–741. doi: 10.1016/j.soard.2016.12.018.
27. O‘Kane M, Parretti HM, Pinkney J et al. British obesity and metabolic surgery society guidelines on perioperative and postoperative biochemical monitoring and micronutrient replacement for patients undergoing bariatric surgery-2020 update. Obes Rev 2020; 21(11): e13087. doi: 10.1111/obr.13087.
28. Ying VW, Kim SH, Khan KJ et al. Prophylactic PPI help reduce marginal ulcers after gastric bypass surgery: a systematic review and meta-analysis of cohort studies. Surg Endosc 2015; 29(5): 1018–1023. doi: 10.1007/s00464-014-3794-1.
29. Haal S, Gurman MS, Boerlage TC et al. Ursodeoxycholic acid for the prevention of symptomatic gallstone disease after bariatric surgery (UPGRADE): a multicentre, double-blind, randomised, placebo-controlled superiority trial. Lancet Gastroenterol Hepatol 2021; 6(12): 993–1001. doi: 10.1016/S2468-1253(21)00301-0.
30. Tian YL, Cao SG, Liu XD et al. Short- and long-term outcomes associated with enhanced recovery after surgery protocol vs conventional management in patients undergoing laparoscopic gastrectomy. World J Gastroenterol 2020; 26(37): 5646–5660. doi: 10.3748/wjg.v26.i37.5646.
31. Gustafsson UO, Scott MJ, Hubner M et al. Guidelines for perioperative care in elective colorectal surgery: enhanced recovery after surgery (ERAS) society recommendations: 2018. World J Surg 2019; 43(3): 659–695. doi: 10.1007/s00268-018-4844-y.