Překvapivá příčina úmrtí pacienta s krvácením do horního trávicího traktu
Miloš Caha1, Polina Politová1, Radek Vlk2, Josef Kult3, Marcela Kopáčová Orcid.org 4
+ Pracoviště
Souhrn
Kazuistika popisuje případ 68letého muže přijatého na jednotku intenzivní péče pro melénu a hematemézu. Gastroskopicky byla diagnostikována a následně i ošetřena krvácející ulcerace žaludku. Nicméně i přes endoskopickou zástavu krvácení nenastalo u pacienta zlepšení zdravotního stavu, naopak došlo k progresi oběhové nestability a k překvapivému zjištění významného nezastavitelného krvácení do pravého hemithoraxu, vedoucímu až k úmrtí pacienta.
Klíčová slova
fraktura žeber, hemateméza, hemothorax, meléna, ulcerace žaludkuÚvod
Akutní krvácení do horní části trávicí trubice patří mezi nejčastější urgentní stavy v gastroenterologii, ve vyspělých zemích s incidencí kolem 100/100 tisíc obyvatel za rok [1–3]. Nejčastěji se jedná o krvácení z peptických vředů v bulbu duodena a v žaludku (21 a 15 % případů), při Mallory-Weissově syndromu (12 % případů), při ezofagitidě (9 % případů), při krvácení z jícnových varixů (3 % případů) a při malignitě (2 % případů) [1,2].
S rozvojem endoskopických metod a jejich zvýšené dostupnosti dochází u krvácení do horní části trávicí trubice k poklesu mortality [1]. Nicméně i přechodné a úspěšně zastavené gastrointestinální krvácení může způsobit závažné sekundárně vzniklé stavy, které mohou být v úvodu maskovány v jednotném obraze akutního krvácení. Pozdní odhalení těchto komplikací významně zhoršuje celkovou prognózu pacienta. V kazuistice je popsán případ pacienta s akutním krvácením ze žaludečního vředu, jehož stav se komplikoval rozvojem fatálního hemothoraxu.
Popis případu
Muž, 68 let, byl přivezen zdravotnickou záchrannou službou a následně hospitalizován na metabolické jednotce intenzivní péče pro několikahodinovou anamnézu tmavé stolice a zvracení tmavého obsahu. Žádné jiné obtíže pacient neudával, negoval požití dráždivých látek či mechanických předmětů, odmítal předchozí traumatickou příhodu.
V osobní anamnéze se kromě suspektní, alkoholem způsobené cirhózy jater vyskytovala arteriální hypertenze a dna, diabetes mellitus 2. typu bez farmakoterapie a vícečetná cholecystolitiáza. Předchozí vředové onemocnění žaludku či duodena v anamnéze neudával. Pacient nedodržoval zvláštní dietní opatření, přiznával pokračující abúzus alkoholu (3–4 piva denně). Nikotinizmus či abúzus drog negoval. Chronická medikace odpovídala výše zmíněným chorobám – Atram, Kalnormin, Essentiale Forte, Verospiron, Furon, Prenessa, Orcal Neo, Purinol, Tiapridal, Acidum folicum. Nesteroidní antiflogistika, antikoagulancia ani antiagregancia užívána nebyla.
Při vstupním fyzikálním vyšetření měl pacient mírně zpomalené psychomotorické tempo, ale byl plně orientovaný, normotenzní (140/80 mm Hg), bez tachykardie (80 pulzů/min), bez zřejmých hematomů. Bylo přítomno oboustranné čisté sklípkové dýchání, na kaudální části levého hemithoraxu pak byla patrna drobná kožní exkoriace. Břicho bylo palpačně nebolestivé, s přiměřenou peristaltikou. Vyšetření per rectum prokázalo tmavou, řídkou, mazlavou a zapáchající stolici charakteru melény.
Laboratorně byla v úvodu přítomna hyperbilirubinemie (celkový bilirubin 81 a přímý 40 μmol/l), zhoršené renální funkce (urea 12,1 mmol/l, kreatinin 158 μmol/l), hyperglykemie (glukóza 9,5 mmol/l); v krevním obraze leukocytóza (leukocyty 12,4 × 109/l), anémie (hemoglobin 94 g/l, erytrocyty 2,7 × 1012/l) a makrocytóza (střední objem erytrocytů 99,6 fl). Spontánní Quickův test měl hodnotu 1,3 INR (international normalized ratio), aktivovaný parciální tromboplastinový čas (APTT) 28,5 s, MELD skóre 15 bodů, Child-Pugh skóre 7 bodů (B).
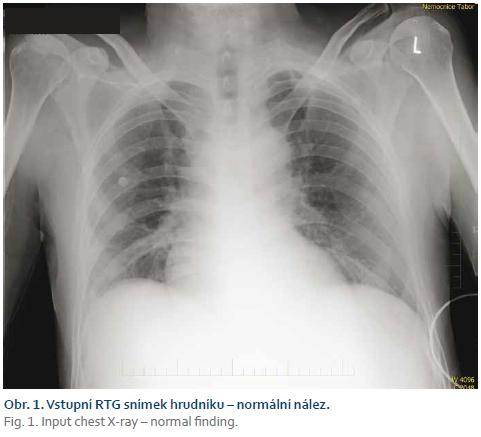
Rentgenový (RTG) snímek hrudníku v předozadní projekci byl bez patologického nálezu (obr. 1). Při urgentně provedené gastroskopii byl nález antrálně v žaludku uloženého, pomalu aktivně krvácejícího akutního vředu Ib dle Forrestovy klasifikace. S pomocí aplikace hemoklipů se krvácení podařilo zastavit, následně byla po úvodním intravenózním (i.v.) bolusu (80 mg pantoprazolu i.v.) zahájena kontinuální terapie inhibitorem protonové pumpy (rychlostí 8 mg pantoprazolu/hod). Jícnové varixy při vyšetření zaznamenány nebyly. Test na přítomnost bakterie Helicobacter pylori v intrahemoragické fázi odebrán nebyl, plánován byl až po zvládnutí akutního stavu.
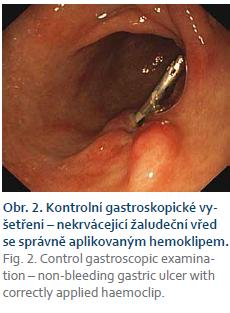
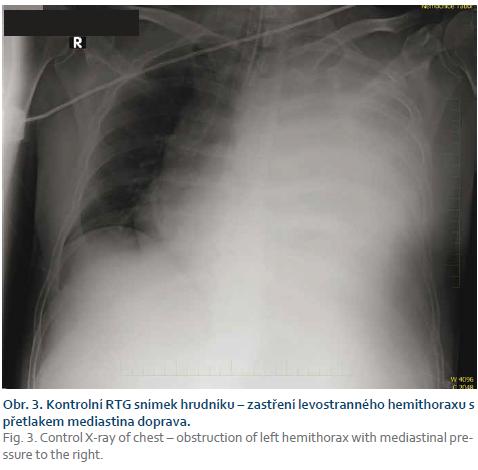
I přes provedenou hemostázu v žaludku se u pacienta v průběhu několika dalších hodin začala rozvíjet hypotenze s tachykardií, s dalším poklesem hemoglobinu v krevním obraze (kontrolní hemoglobin 69 g/l). Byla zahájena hemosubstituce, provedena kontrolní gastroskopie. Endoskopické vyšetření neprokázalo pokračující krvácení, předchozí hemostáza se jevila jako účinná (obr. 2). S hemoterapií došlo ke stabilizaci pacientova stavu, zhoršení bylo přičítáno předchozí krevní ztrátě. Nicméně po dalších 3 hod se pacientův stav znovu začal zhoršovat, opět se objevila hypotenze s tachykardií, oligurií, došlo k rychlému vývoji hemoragického šoku s fibrilací komor a v konečném důsledku i oběhové zástavě. Za asistence resuscitačního týmu byl pacient úspěšně resuscitován (opakovaně aplikován adrenalin i.v., elektrická defibrilace) a přemístěn na anesteziologické oddělení. Dále již byl pacient uměle ventilován. I přes pokračující aplikaci katecholaminů, hemoterapii a tekutinovou resuscitaci však přetrvávala oběhová nestabilita. Znovu byla plánována endoskopická kontrola, nicméně pro nízkou pravděpodobnost pokračujícího krvácení do gastrointestinálního traktu byla rozšířena diferenciální rozvaha, proveden kontrolní RTG snímek hrudníku, kde bylo nově zjištěno zastření celého levého hemithoraxu s pravostranným přetlakem mediastina (obr. 3). Při diagnostické a evakuační punkci levého hemithoraxu bylo potvrzeno podezření na hemothorax, postupně vypuštěno 5 l krve. V této chvíli, i přes pokračující hemoterapii (v průběhu celé hospitalizace podáno 9 jednotek resuspendovaných deleukotizovaných erytrocytů a 6 jednotek čerstvě mražené plazmy), u pacienta došlo k vývoji nekontrolovatelné koagulopatie charakteru diseminované intravaskulární koagulace – v posledním odběru krve hemoglobin 37 g/l, erytrocyty 2,7 ×1012/l, fibrinogen 0,59 g/l, D-dimery 6,72 mg/l, p-antitrombin III 16,3 %, APPT 110 s, INR 2,8. Krvácení se nepodařilo zastavit a pacient zemřel.
Patologicko-anatomická pitva potvrdila mikronodulární jaterní cirhózu, ošetřenou ulceraci žaludku a zlomeninu IX. žebra v levé skapulární čáře s hematomem okolních mezižeberních prostor a levostranným hemothoraxem.
Při zpětném pátrání po příčině žeberního traumatu od rodiny pacienta zjištěno, že před hospitalizací (ale již po začátku obtíží – melény a hematemézy) došlo k pádu na levý hemithorax. Pádu nebyl v daném případě pacientem přičítán větší význam, a tedy nebyl v anamnéze zmiňován.
Diskuze
Krvácení do horní části trávicí trubice nebývá typicky spojováno s akutním hemothoraxem. Přesto se mohou tyto dva zdánlivě nesouvisející stavy spolu vyskytnout, spojené mechanizmem ortostatické synkopy a sekundárně vzniklého traumatu.
Žaludeční a duodenální vředy jsou slizniční defekty dané části trávicí trubice zasahující až pod membránu muscularis mucosae. Primárně vznikají při narušení rovnováhy mezi protektivními a agresivními faktory působícími na žaludeční sliznici. Hlavní ochranná funkce žaludeční sliznice je tvořena mukózním hlenem (společně s regeneračními vlastnostmi epitelu, submukózní mikrocirkulací). Mezi nejvýznamnější agresivní faktory patří infekce H. pylori, nesteroidní antiflogistika a alkohol [4]. Méně často pak vznikají vředy sekundárně, v důsledku jiných, zpravidla chronických onemocnění (hepatogenní, neoplastický vřed). Riziko krvácení z ulcerózních lézí stoupá s užíváním antikoagulancií, antiagregancií, nesteroidních antiflogistik, selektivních inhibitorů zpětného vychytávání serotoninu (zejména při kombinaci těchto preparátů), dále je zvýšeno u některých onemocnění, jako je jaterní cirhóza, renální insuficience, chronické srdeční selhání či diabetes mellitus, a roste i s věkem pacienta [2–6].
Ortostatická synkopa, vzniklá v důsledku významné krevní ztráty, patří mezi časté komplikace akutního krvácení. Navazuje na ortostatickou hypotenzi, která je definována jako posturální pokles krevního tlaku o 20 mm Hg v systole či 10 mm Hg v diastole [7,8], který může nastat již při ztrátě kolem 15–30 % objemu krve (cca 750–1 500 ml u 70kg jedince). Až u třetiny synkopálních stavů pak dále dochází ke vzniku se synkopou asociovaného traumatu, nejčastěji hlavy (80 % ze vzniklých poranění) a hrudníku (14 % ze vzniklých poranění) [9]. O závažnosti tupého poranění hrudníku svědčí až 20% podíl na celkové mortalitě u nemocných s tímto traumatem [10]. Nejčastěji se u tupých poranění hrudníku setkáváme se zlomeninami žeber (dle některých autorů až ve 40 %) [11–13], jejichž samotná přítomnost tvoří důležitý indikátor závažnosti poranění. Celková mortalita pak stoupá s počtem zlomených žeber, věkem a přítomnými komorbiditami [10–13].
Akutní hemothorax je po plicní kontuzi druhou nejčastější komplikací zlomenin žeber [11–13]. Dle lokality, rozsahu a velikosti krevní ztráty bývá doprovázen příslušnou patofyziologickou odpovědí. V časné fázi hovoříme o hemodynamické a respirační kompenzaci, po jejímž vyčerpání se rychle dostavuje hemoragický šok (při ztrátě více než 30 % objemu krve – cca 1 500 ml) a syndrom akutní dechové tísně. Vznik hemothoraxu může být akutní či odložený, způsobený přímo v okamžiku poranění nebo později při další dislokaci zlomeného žebra s lacerací plic, bránice či interkostálních cév. Malý hemothorax s objemem do 500 ml nemusí být při fyzikálním a skiagrafickém vyšetření patrný [14,15]. Časná diagnóza hemothoraxu a jeho léčba jsou velmi důležité v celkové prognóze pacienta. Terapie se pak odvíjí od celkového objemu hemothoraxu – do 300 ml se postupuje konzervativně (dochází k postupné resorpci přítomné krve), při větším množství je pak nutná, po předchozí hrudní drenáži, invazivní intervence. Vedle katetrizační embolizace mezižeberní arterie se užívají přístupy chirurgické – videoasistovaná či akutní thorakotomie [13–16]. V kazuistice je popsáno souběžné krvácení do trávicího traktu a dutiny hrudní. Toto, ač nepatří mezi časté či snadné diagnózy, by mělo mít místo v naší diferenciální rozvaze, zejména u atypicky probíhajícího a endoskopicky již vyřešeného krvácivého stavu. Pozdní diagnóza může mít závažné následky.
Doručeno/Submitted: 6. 11. 2019
Přijato/Accepted: 9. 12. 2019
MUDr. Miloš Caha
Interní oddělení 1 – gastroenterologie Nemocnice Tábor, a. s.
Kpt. Jaroše 2000
390 03 Tábor
iga@nemta.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Gralnek IM, Dumonceau JM, Kuipers EJ et al. Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015; 47 (10): a1–a46. doi: 10.1055/s-0034-1393172.
2. Hreinsson JP, Kalaitzakis E, Gudmundsson S et al. Upper gastrointestinal bleeding: incidence, etiology and outcomes in a population-based setting. Scand J Gastroenterol 2013; 48 (4): 439–447. doi: 10.3109/00365521.2012.763174.
3. Jairath V, Desborough MJ. Modern‐day management of upper gastrointestinal haemor-rhage. Transfus Med 2015; 25 (6): 351–357. doi: 10.1111/tme.12266.
4. Valle JD. Peptic ulcer disease and related disorders. In: Kasper DL, Fauci AS, Hauser SL et al (eds). Harrison’s principles of internal medicine. New York: McGraw Hill Education 2015: 1911–1932.
5. Weil J, Langman MJ, Wainwright P et al. Peptic ulcer bleeding: accessory risk factors and interactions with non-steroidal anti-inflammatory drugs. Gut 2000; 46 (1): 27–31. doi: 10.1136/gut.46.1.27.
6. Søberg T, Hofstad B, Sandvik L et al. Risk factors for peptic ulcer bleeding. Tidsskr Nor Laegeforen 2010; 130 (11): 1135–1139. doi: 10.4045/tidsskr.08.0693.
7. Brignole M, Moya A, de Lange FJ et al. 2018 ESC Guidelines for the diagnosis and management of syncope. Eur Heart J 2018; 39 (21): 1883–1948. doi: 10.1093/eurheartj/ehy037.
8. Ricci F, De Caterina R, Fedorowski A. Orthostatic Hypotension. J Am Coll Cardiol 2015; 66 (7): 848–860. doi: 10.1016/j.jacc.2015.06.1084.
9. Bartoletti A, Fabiani P, Bagnoli L et al. Physical injuries caused by a transient loss of consciousness: main clinical characteristics of patients and diagnostic contribution of carotid sinus massage. Eur Heart J 2008; 29 (5): 618–624. doi: 10.1093/eurheartj/ehm563.
10. Battle CE, Hutchings H, Evans PA. Risk factors that predict mortality in patients with blunt chest wall trauma: a systematic review and meta-analysis. Injury 2012; 43 (1): 8–17. doi: 10.1016/j.injury.2011.01.004.
11. Ziegler DW, Agarwal NN. The morbidity and mortality of rib fractures. J Trauma 1994; 37 (6): 975–979. doi: 10.1097/00005373-199412000-00018.
12. Novakov I, Timonov P, Stefanov C et al. Rib fractures in blunt chest trauma – morbidity and mortality: self-experience study. Trakia J Sci 2014; 3: 272–276. doi: 10.15547/tjs.2014.03. 008.
13. Sirmali M, Türüt H, Topçu S et al. A comprehensive analysis of traumatic rib fractures: morbidity, mortality and management. Eur J Cardiothorac Surg 2003; 24 (1): 133–138. doi: 10.1016/s1010-7940 (03) 00256-2.
14. Mahoozi HR, Volmerig J, Hecker E. Modern management of traumatic hemothorax. J Trauma Treat 2016; 5 (3): 326. doi: 10.4172/2167-1222.1000 326.
15. Talbot BS, Gange CP Jr, Chaturvedi A et al. Traumatic rib injury: patterns, imaging pitfalls, complications, and treatment. Radiographics 2017; 37 (2): 628–651. doi: 10.1148/ rg.2017160100.
16. Boersma WG, Stigt JA, Smit HJ. Treatment of haemothorax. Respir Med 2010; 104 (11): 1583–1587. doi: 10.1016/j.rmed.2010.08.006.