Perkutánní endoskopická gastrostomie – doporučený postup České gastroenterologické společnosti ČLS JEP
Radek Kroupa Orcid.org 1, Pavel Kohout Orcid.org 2, Jiří Cyrany3,4, Milan Dastych Orcid.org 5, Karel Balihar Orcid.org 6, Ivana Mikoviny Kajzrlíková Orcid.org 7, Dita Mlynářová8, Martina Horová9, Milana Šachlová10, Michal Šenkyřík Orcid.org 11, Jan Martínek Orcid.org 12,13, Stanislav Rejchrt Orcid.org 3, Jan Šťovíček Orcid.org 14, Igor Satinský Orcid.org 15,16, Přemysl Falt Orcid.org 17
+ Pracoviště
Úvod
Podávání enterální výživy je preferovaným způsobem zabezpečení nutriční podpory u pacientů s nedostatečným perorálním příjmem a funkčním gastrointestinálním traktem. Aplikace výživy sondou je zvažována v případech, kdy nestačí doplnění perorálního příjmu sippingem. Použití standardní nazogastrické sondy je provázeno sníženým komfortem pacienta a s tím spojenou horší tolerancí sondy i výživy, navíc je zatíženo rizikem komplikací (lokálním drážděním sliznic, otlakovými ulceracemi, krvácením, gastroezofageálním refluxem a aspirační pneumonií, technickým selháním a omezením dodávky výživy) [1,2]. Tenká nazoenterální sonda je lépe tolerována a ve specifických situacích (zejména pro doplňkovou noční výživu, u Crohnovy nemoci (CD – Crohn’s disease) nebo akutní pankreatitidy) je s výhodou využívána i pro výživu dlouhodobou. Zavedení přímého vstupu do žaludku – gastrostomie – je vhodnou alternativou pro dlouhodobou výživu tam, kde je sonda zavedená nosem nevhodná či netolerovaná. Indikace se odvíjí od povahy základního onemocnění. Rozšíření techniky perkutánní endoskopické gastrostomie (PEG) významně omezilo použití jiných způsobů – chirurgické gastrostomie či zavedení gastrostomie pod radiologickou nebo sonografickou kontrolou. Dnes je PEG metodou volby pro většinu pacientů k poskytování dlouhodobé enterální výživy a patří k rutinně prováděným endoskopickým intervencím s vysokou efektivitou a bezpečností. Zajištění výživy cestou PEG zlepšuje laboratorní ukazatele nutričního stavu, hojení defektů a nutnost opakované hospitalizace, i když nemusí vždy vést k nárůstu antropometrických parametrů [3]. Měsíční mortalita po zavedení PEG dosahuje dle publikovaných prací širokého rozmezí 1–22 %, i když není v přímé souvislosti s časnou komplikací endoskopického výkonu [4–7]. Cílem provedení PEG by mělo být zlepšení stavu výživy, kvality života a komfortu pacienta při tolerovatelné míře rizika komplikací spojených s výkonem.
Tento doporučený postup má usnadnit péči o pacienty s PEG poskytnutím informací důležitých pro správnou, odůvodnitelnou a bezpečnou indikaci výkonu, vlastní provedení výkonu, následnou péči o PEG, případně řešení komplikací. Je určen nejen pro endoskopisty – gastroenterology a chirurgy, ale i pro nutricionisty, neurology, onkology a ostatní, kteří se o pacienty s PEG starají. Vychází z konsenzu autorského kolektivu vytvořeného na základě informací dostupných v době jeho tvorby. Pro některé postupy není k dispozici dostatek vědeckých důkazů, vycházejí z doporučení expertů a mohou se v budoucnu vyvíjet. Specifické otázky dlouhodobé enterální výživy a problematiky PEG u dětí jsou předmětem pediatrických doporučení [8].
Poprvé byla PEG provedena v roce 1980 a od té doby její využití dramaticky narostlo. Základním principem metody je endoskopická insuflace žaludku a výběr vhodné lokality v místě, kde jsou žaludeční a břišní stěna v těsné blízkosti. Pak je pod endoskopickou vizuální kontrolou zaveden speciální katetr. Nejčastěji originální tzv. pull metodou pomocí vtažení PEG katetru ústy tahem za vlákno zavedené přes žaludeční stěnu navenek [9]. Variantou je uložení katetru posouváním po vodiči přes ústa, tzv. push technika [10]. Ve specifikovaných případech je výhodné přímé perkutánní zavedení gastrostomie do žaludku jen za optické kontroly endoskopu [11,12]. Při nemožnosti či intoleranci gastrického podání výživy lze použít zavedení jejunální sondy cestou PEG (PEGJ – perkutánní gastro-jejunostomie) nebo perkutánní endoskopickou jejunostomii (PEJ).
Indikace PEG
Indikace – etické poznámky
Provedení PEG je zvažováno při předpokládané době trvání poruchy příjmu potravy a/nebo tekutin delší než 3–4 týdny v kontextu celkového zdravotního stavu, základní diagnózy a prognózy onemocnění. Před zavedením PEG je důležité stanovení léčebného cíle, kterého chceme dosáhnout, a posouzení možností jeho naplnění.
Základní podmínkou k provedení PEG je předpokládaná doba trvání poruchy příjmu potravy a/nebo tekutin delší než 3–4 týdny a funkční trávicí trakt [13–15]. Rozhodnutí o provedení PEG není jen rozhodnutím o technickém provedení výkonu, ale zahajuje často novou životní etapu dlouhodobé/domácí enterální výživy s celou řadou vážných dopadů (sociálních, zdravotních, ekonomických). Proto je nutné každý případ indikace k PEG posuzovat individuálně v kontextu celkové klinické situace, diagnózy a prognózy nemoci. Je nutné zvážit očekávaný vliv zavedení gastrostomie na kvalitu života s přihlédnutím a respektováním přání pacienta, pokud je známo. PEG by neměla být zaváděna terminálně nemocným, umírajícím. Jako invazivní léčebná procedura má zlepšit, resp. minimálně udržet kvalitu života. Obecně je nutné splnit tři podmínky:
- základní indikace;
- stanovení léčebného cíle, kterého chceme dosáhnout, a posouzení možnosti jeho naplnění;
- informovaný souhlas.
Pokud není jedna z podmínek splněna, není možné z etického hlediska PEG zavést [13]. Naopak pokud jsou podmínky splněny, je vhodné endoskopickou gastrostomii provést včas.
Celou řadu indikací zavedení PEG a zahájení domácí enterální výživy neprovázejí etické rozpaky. Jedná se většinou o případy svéprávných lucidních pacientů s chorobou bránící normálnímu příjmu potravy ústy: nádory krku a orofaciální oblasti, degenerativní neurologické nemoci a cévní onemocnění mozku (COM) s pseudobulbárním syndromem. V těchto případech jsou indikace i léčebný cíl jasné. Sporné indikace spojené s eticko-morálními otázkami se týkají polymorbidních geriatrických pacientů, pacientů zbavených svéprávnosti s pokročilou demencí, pacientů v bezvědomí a vigilním kómatu. Přístup primum non nocere může být zastíněn snahou léčit za každou cenu, obavami z právních dopadů nesplněných požadavků příbuzných a také tlakem na rychlé řešení vzniklé situace, bez zřetele na dlouhodobé dopady našeho rozhodnutí. Výsledkem těchto rozhodnutí o invazivních úkonech může být ve své podstatě bránění přirozenému umírání u pacientů s velmi nízkou kvalitou života, kterou nelze zavedením PEG zlepšit.
Informovaný souhlas
K provedení zákroku je nutný informovaný souhlas pacienta po předchozím poučení zdravotnickým pracovníkem, který výkon obvykle provádí. Pokud pacient není schopen informovaný souhlas vyjádřit, vyžaduje se souhlas osoby určené pacientem při přijetí do zdravotnického zařízení nebo osoby blízké. Při splnění zákonných podmínek lze respektovat dříve vyslovené přání pacienta.
Dle platných právních předpisů – úmluvy o lidských právech a biomedicíně [16], zákona o zdravotních službách [17] a nového občanského zákoníku [18] je před provedením jakéhokoli zákroku nutný svobodný a informovaný souhlas pacienta. Pacient musí být před výkonem a vyslovením i podpisem souhlasu informován o účelu a povaze zákroku jakož i o jeho důsledcích a rizicích. U nezletilých osob souhlasí zákonný zástupce, u osob s omezenou svéprávností pak opatrovník.
Zákon nestanoví podmínku písemné formy souhlasu, nemocnice však často tuto formu volí. I pacient může vyžadovat poučení písemné. Velmi důležité je, aby poučení předcházelo souhlasu i jeho podpisu. Poučit by měl pacienta zdravotnický pracovník, který výkon obvykle provádí. Důležitou součástí informovaného souhlasu je srozumitelný popis procedury, její přínos pro pacienta, popis nutné přípravy a stav po výkonu, alternativy, rizika a možné komplikace spojené se zavedením PEG. Velmi vhodné je zavedení písemného poučení s návodem na následnou péči o PEG, který dává možnost pacientovi i rodině si vše v klidu prostudovat.
Vyhodnotí-li lékař zavedení PEG jako neodkladný zákrok a zároveň zdravotní stav pacienta neumožní souhlas získat, může být zákrok proveden bez souhlasu. Podmínkou je, že se jedná o neodkladný zákrok nezbytný k záchraně života nebo zamezení vážného poškození zdraví. U nezletilých a pacientů s omezenou svéprávností lze poskytnout neodkladnou péči bez souhlasu opatrovníka či zákonného zástupce. Zde je velmi důležité pečlivě zaznamenat zdravotní stav pacienta a důvody k poskytnutí péče bez souhlasu do zdravotnické dokumentace.
Při přijetí do nemocnice může pacient pro případ, kdy nemůže s ohledem na svůj zdravotní stav vyslovit souhlas s poskytováním zdravotních služeb, určit osobu, která bude souhlasit s péčí místo něj. Může se však stát, že pacient takovou osobu neurčí nebo určená osoba není dosažitelná, pak může souhlas či nesouhlas s péčí vyslovit manžel, manželka nebo registrovaný partner. Není-li nikdo z těchto osob znám nebo není dosažitelný, vyžaduje se souhlas rodiče, případně jiné osoby blízké.
Pokud pacient výkon odmítá, musí být opakovaně poučen o rizicích odmítnutí. V případě, že i po opakovaném podání informace o nezbytnosti výkonu a možných následcích neprovedení výkonu nadále odmítá vyslovit souhlas, podepíše pacient negativní reverz – písemné prohlášení o odmítnutí. Odmítá-li pacient negativní reverz podepsat a současně odmítá zdravotní péči či příslušný zdravotní výkon, je třeba tuto skutečnost uvést do zdravotnické dokumentace a záznam podepíše příslušný zdravotnický pracovník, který pacientovi podal informace, a jeden svědek.
V souvislosti s indikací zavedení PEG je třeba zmínit i dříve vyslovené přání. Pacient může pro dobu, kdy nebude schopen souhlas nebo nesouhlas vyslovit, využít institutu dříve vysloveného přání. Podmínkou k respektování takového přání je jeho písemná forma s úředně ověřeným podpisem pacienta. Součástí dříve vysloveného přání musí být i písemné poučení pacienta lékařem o důsledcích jeho rozhodnutí. Dříve vyslovené přání má možnost pacient učinit též při přijetí do péče poskytovatelem nebo kdykoli v průběhu hospitalizace. Takto vyslovené přání se zaznamená do zdravotnické dokumentace vedené o pacientovi, záznam podepíše pacient, zdravotnický pracovník a svědek. Zatímco dříve vyslovené přání v písemné podobě má neomezenou platnost, pokud jej pacient vysloví až za hospitalizace, platí pouze pro tuto hospitalizaci. Tento institut není možné využít pro nezletilé a pro pacienty s omezenou svéprávností, zákon to výslovně vylučuje.
Neonkologické indikace
Významnou část indikací zavedení PEG jsou onemocnění vedoucí k dlouhodobé poruše polykání (dysfagii) a omezení perorálního příjmu potravy a tekutin: COM, degenerativní neurologická onemocnění, vigilní kóma a demence. Načasování provedení PEG závisí na charakteru a vývoji onemocnění. PEG je racionálně indikována i u dalších neonkologických onemocnění s potřebou poskytnutí dlouhodobé enterální výživy nebo specifické léčby, případně k dlouhodobé žaludeční drenáži.
K nejčastějším indikacím provedení PEG (cca 50 %) patří neurologická onemocnění, která vedou k poruše polykání a snížení příjmu potravy a tekutin. Jsou to COM, degenerativní neurologická onemocnění: amyotrofická laterální skleróza (ALS), roztroušená skleróza (RS), Parkinsonova nemoc (PN), vigilní kóma a demence. U pacientů s ischemickou cévní mozkovou příhodou (CMP) je uváděn výskyt dysfagie v rozsahu 23–78 %, po 7–14 dnech dysfagie odezní v 80 % případů. Z tohoto důvodu není vhodné ihned po vzniku ischemické CMP zavádět PEG, ale zavedení provést za 2–4 týdny v případě, že dysfagie bude přetrvávat [19]. Naopak u pacientů s COM s nutností plicní ventilace déle než 2 dny je pravděpodobnost dlouhodobého přetrvávání poruchy polykání vysoká a PEG je možné provést v 1. týdnu po vzniku. O časnějším zavedení PEG u CMP lze také uvažovat při vytažení nazogastrické sondy pacientem [19]. U ALS je vhodné provedení PEG ještě před významným hmotnostním úbytkem a při dostatečné plicní kapacitě (> 50 % FVC, pCO2 < 6,5 kPa), pokud tyto podmínky nejsou splněny, je 1měsíční mortalita signifikantně zvýšena [20]. U ventilačně rizikových pacientů s ALS lze zvážit direktní zavedení PEG za asistence nazálně zavedeného endoskopu u sedícího nesedovaného pacienta [21]. U RS a PN je gastrostomie indikována v případě potvrzené dysfagie a hmotnostním úbytku při selhání dysfagické diety. Samostatnou indikací zavedení PEG s PEJ je u PN podávání gelu levodopy kontinuálně do duodena [22].
U pacientů s demencí, kteří odmítají jídlo a tekutiny, je situace složitější a indikace naráží na etické aspekty [23]. Ve většině případů pokročilé demence je k zajištění výživy dostačující krmení a úprava hustoty potravy – comfort feeding [13,24]. Studie, které zkoumaly vliv zavedení PEG u pacientů s pokročilou demencí na přežití a kvalitu života, neprokázaly jeho pozitivní efekt [25,26]. Jako rizikové faktory pro špatné přežití po zavedení PEG byly identifikovány vysoký věk, malignita, nízká hladina albuminu [27]. Z tohoto důvodu je třeba u těchto pacientů k indikaci zavedení PEG vždy přistupovat individuálně s přihlédnutím k celkovému stavu a prognóze nemoci. Je vhodné rozlišit, zda jde o akutní zhoršení stavu způsobené např. infekcí nebo postupné přirozené chátrání vedoucí k důstojnému úmrtí. V prvém případě je nutné spolu s kauzální léčbou zajistit adekvátní příjem živin. K tomuto účelu využíváme tenké výživové sondy a při jejich intoleranci (extrakce pacientem) parenterální výživu. PEG lze provést, pokud při kontrolách shledáváme zlepšování celkového stavu a kognitivních funkcí a zároveň pokud předpokládáme trvání poruchy příjmu potravy více než 3–4 týdny [15].
K vzácnějším indikacím k zavedení PEG patří mentální retardace, tracheoezofageální píštěle, stenózy jícnu u pacientů s epidermolysis bullosa, pokročilá achalázie, divertikly jícnu, vysoké riziko aspirace při perorálním podávání tekutiny a výživy, polytrauma, rozsáhlá obličejová chirurgie, cystická fibróza, katabolické stavy vyžadující dlouhodobou enterální výživu i jiná nenádorová onemocnění s potřebou dlouhodobé enterální výživy nebo zajištění medikace. PEG je využívána též pro symptomatickou drenáž žaludečních šťáv u ileózních stavů neřešitelných chirurgicky nebo při těžké gastroparéze [28,29].
Onkologické indikace
Nutriční podpora je nezbytnou součástí onkologické léčby. Nejčastější indikací PEG v onkologii je zajištění výživy u pacientů s nádory hlavy a krku. Pokud je vysoké riziko vzniku iradiační mukozitidy, doporučuje se PEG zavádět již profylakticky před radioterapií. Profylaktické zavedení PEG umožňuje ve vybraných indikacích pacientovi absolvovat léčbu bez přerušení. Další indikací jsou obturující tumory jícnu během probíhající léčby. Jde o možný způsob zajištění výživy i u některých onkologických pacientů s funkčním trávicím traktem, kdy sipping či sondová výživa nejsou možné či dostatečné.
Nutriční podpora je nezbytnou součástí onkologické léčby. Nejčastější indikací k zavedení PEG v onkologii je zajištění výživy pacientů s nádory hlavy a krku. Řada těchto pacientů přichází s pokročilými nádory a trpí rozvinutou podvýživou již v době stanovení diagnózy. Posouzení celkového stavu, nutričního stavu a zhodnocení polykacích obtíží je součástí terapeutické rozvahy. Již ztráta 5 % hmotnosti před onemocněním představuje negativní prognostický faktor [30]. Vznik iradiační mukozitidy je často limitujícím faktorem pro úspěšné dokončení léčby. Pokud je riziko vzniku iradiační mukozitidy vysoké (polykací cesty v ozařovaném objemu, oboustranné postižení krčních uzlin, konkomitantní léčba), je zavedení PEG doporučeno vždy ještě před zahájením radioterapie. Odkladem rozhodnutí narůstá riziko prohloubení malnutrice a přerušení léčby s rizikem jejího selhání [31]. Je prokázáno, že u více než 80 % pacientů s nádorem hlavy a krku, kteří podstoupí radioterapii, dojde ke vzniku mukozitidy, která vede ke snížení příjmu potravy a k úbytku hmotnosti [32,33]. S preventivně zavedenou PEG je zahájena enterální výživa ihned při vzniku obtíží a nedojde k prodlení. Není-li u méně rizikových pacientů PEG zavedena preventivně, lze ji zavést dodatečně v reakci na problém s příjmem živin [34]. Během výživy cestou PEG by měli pacienti stále trénovat polykání, aby zamezili vzniku dysfagie a zvládli po zhojení mukozitidy přechod na plný perorální příjem. Dysfagie přetrvává u 22 % pacientů 6 měsíců po léčbě, někteří pacienti mají dysfagie nebo xerostomii i déle než rok [35]. Až 10 % pacientů potřebuje trvalou nutriční podporu [36]. S vytažením katetru PEG je vhodné vyčkat na obnovení dostatečného perorálního příjmu, případně na úpravu tělesné hmotnosti. Zavedení PEG v porovnání se sondou má výhodu v tom, že je diskrétní, pacienta neomezuje v běžném životě, je minimální riziko dislokace v průběhu několikatýdenní léčby, nepřekáží v ozařovaném objemu a nepřekáží fixační masce při radioterapii.
Další možnou indikací je zajištění výživy u pacientů s obturujícími tumory jícnu, zejména během probíhající onkologické léčby. Zavedení PEG je vhodné předem konzultovat s chirurgem, aby nekomplikovalo případné operační řešení. Pokud se plánuje radikální operace a náhrada jícnu tubulizovaným žaludkem, je PEG nevhodný. K zajištění výživy je pak zvažována jejunostomie, dle lokálních možností chirurgicky nebo endoskopicky zavedená. V paliativní péči je alternativou PEG s potenciálem lepší kvality života zavedení samoexpandibilního metalického stentu [37]. PEG je preferována u nádorů horní části jícnu, kde je zavedení stentu obtížné a rizikové.
PEG je možný způsob zajištění výživy i u dalších onkologických pacientů s funkčním trávicím traktem, kdy sipping či sondová výživa nejsou možné či dostatečné pro nějakou překážku v polykacích cestách a není šance na zlepšení v nejbližších týdnech.
Raritní komplikací (asi v 1 %) zavedení PEG metodou pull kolem nádoru v orofaryngeální oblasti je vznik implantačních metastáz [38,39]. Variantou je zavedení PEG direktní metodou, které lze použít i u stenozujících tumorů tam, kde jsou cesty průchozí jen pro tenký (nazální) gastroskop a nebylo by možné protáhnout běžný gastrostomický katetr metodou pull.
Podrobnosti o jednotlivých indikacích jsou dostupné v aktuálních doporučeních Evropské společnosti pro klinickou výživu ESPEN (European Society for Clinical Nutrition and Metabolism) na www.espen.org.
Kontraindikace PEG
Kontraindikací PEG je chybění souhlasu, nekorigovatelné koagulační poruchy, hemodynamická nestabilita, závažná onemocnění zasahující do předpokládaného místa zavedení a stavy, u kterých nelze předpokládat zlepšení po zavedení tohoto způsobu výživy. Mnoho kontraindikací je relativních dle aktuálního posouzení situace u konkrétního pacienta.
Bez správné indikace a informovaného souhlasu nelze PEG provádět. Absolutní kontraindikací jsou: nesouhlas pacienta, koagulační poruchy (protrombinový čas, international normalization ratio (INR) > 1,5, aktivovaný parciální tromboplastinový čas > 50 s, trombocyty < 50 × 109/l), absence diafanoskopie s interpozicí orgánu (játra, střevo), hemodynamická nestabilita, sepse, karcinomatóza peritonea, nádorová infiltrace v místě inzerce, velký ascites, gastrické varixy, mentální anorexie, těžká psychóza, terminální fáze onemocnění. Při chybění diafanoskopie je nutné provedení sonografického vyšetření k vyloučení interpozice parenchymatózního orgánu. Relativní kontraindikace jsou stavy po parciální resekci žaludku, stenózy jícnu, které mohou být dilatovány nebo může být využit tenký endoskop a gastrostomie zavedena direktním způsobem. Dále malý ascites, ventrikuloperitoneální shunt, gravidita, aktivní vředová choroba, kožní infekce v předpokládané lokalitě PEG, CD [14]. U pacientů s cirhózou, jícnovými varixy a ascitem lze zavedení PEG individuálně uvážit. Relativní bezpečnosti výkonu lze dosáhnout výběrem optimální lokality dle diafanoskopie, korekce koagulopatie a zvážení použití direktní techniky [40].
Podmínky pro provedení PEG, profylaxe, premedikace
Pro bezpečné provedení PEG je nezbytná úzká spolupráce s nutriční ambulancí, správné načasování PEG vzhledem k aktuálnímu stavu pacienta, vybavený erudovaný endoskopický tým a zajištění edukace pacienta a ošetřujícího personálu pro následnou péči. PEG je výkon s vysokým rizikem krvácení. Úprava antitrombotické terapie před výkonem vychází z aktuálních doporučení odborných společností. Před zavedením PEG je indikována antibiotická profylaxe.
Kromě onemocnění, z něhož vyplývá indikace zavedení PEG a nutričního stavu pacienta, mají na výskyt komplikací a mortality po výkonu důležitý vliv komorbidity a aktuální zdravotní stav. Vysoký C-reaktivní protein byl prokázán jako nezávislý rizikový parametr časné mortality po PEG. Správné načasování zavedení PEG až po odeznění akutního onemocnění (nejčastěji infekce) při zajištění výživy jiným způsobem může zlepšit prognózu pacienta. Pokud pacient akutní stav přečká, stabilizuje se a stále trvá základní indikace k zavedení PEG, lze očekávat, že pro něj bude zavedení PEG prospěšné [4,41].
Nároky na pracoviště
Zavedení PEG je možné na pracovišti digestivní endoskopie disponujícím alespoň dvěma erudovanými lékaři, endoskopickou sestrou a vybavením pro řešení možných komplikací. Pracoviště má být vybaveno základní monitorací vitálních funkcí a možností anesteziologické asistence. Nutností je zázemí lůžkového oddělení interního či chirurgického typu k zajištění observace po výkonu.
Endoskopické pracoviště provádějící PEG by mělo úzce spolupracovat s nutriční ambulancí. Lékař-nutricionista má hlavní roli v indikaci PEG a poskytování následné enterální výživy. Edukace péče o PEG by měla být zabezpečena personálem poskytovatele tak, aby potřebné informace pro pacienta a ošetřování v domácím prostředí byly dostatečně zajištěny při propuštění z hospitalizace. Endoskopista by měl mít možnost v případě pochyb o správné indikaci tuto situaci konzultovat a případně výkon kontraindikovat. Možné dopady z posuzování komplikací výkonu se vždy odvíjejí od správné indikace a provádějící lékař nemůže být z odpovědnosti vyjmut.
Antiagregační a antikoagulační terapie
Krvácivé komplikace u PEG se vyskytují ve zhruba 2,5 %. Současná doporučení Americké společnosti pro gastrointestinální endoskopii (ASGE) a Evropské společnosti pro gastrointestinální endoskopii (ESGE) považují zavedení PEG za proceduru s vysokým procedurálním rizikem [42,43]. Monoterapii kyselinou acetylsalicylovou (ASA – acetylsalicylic acid) nebo clopidogrelem lze považovat za bezpečnou, u nízce rizikových kardiovaskulárně nemocných pacientů je vhodné clopidogrel vysadit 5 dní předem, u vysoce rizikových pacientů lze provést bez přerušení. Duální antiagregační terapii je vhodné převést před zavedením PEG na monoterapii ASA. V individuálních případech u vysoce rizikových kardiologických pacientů lze provést zavedení PEG i na duální antiagregační terapii, pokud benefit z PEG převažuje nad rizikem vysazení [7]. Antikoagulační terapii warfarinem je vhodné vysadit 5 dní předem, před výkonem zkontrolovat INR a u pacientů s vysokým kardiovaskulárním rizikem převést na terapii nízkomolekulárním heparinem, který by měl být vysazen 8 hod před vlastní procedurou. Návrat k antikoagulační terapii je možný obvykle 2. den po zavedení PEG. Léčbu přímými perorálními antikoagulancii je vhodné vysadit 48 hod před procedurou, u pacientů na dabigatranu s clearance kreatininu 30–50 ml/min již 72 hod předem [42,43].
Jedna studie poukazuje na možnou asociaci terapie selektivními inhibitory zpětného vychytávání serotoninu s krvácivými komplikacemi po zavedení PEG, důkazy k vysazení této terapie před zavedením PEG však nejsou [44].
Pro doporučení rutinního podání inhibitorů protonové pumpy v periprocedurálním období není opora ve studiích. Stojí proti sobě teoretický benefit snížení rizika krvácení a prevence ulcerace oproti vyššímu riziku vzniku nozokomiální pneumonie i jiné infekce u rizikových pacientů [45,46]. Rozhodnutí je vždy individualizované (tab. 1).
Antibiotická profylaxe
Pacienti indikovaní k zavedení PEG mají obvykle sníženou imunokompetenci závažnými komorbiditami a malnutricí. Profylaktické podání antibiotik snižuje incidenci peristomální infekce [47]. Optimální volbou k pokrytí mikroorganizmů zodpovědných za infekci v místě vpichu je potencovaný penicilin (např amoxicilin/kyselina klavulanová 1,2 g), cefazolin 1 g, cefuroxim 1,5 g nebo ciprofloxacin 200 mg. Antibiotika by měla být aplikována jednorázově cca 30 min před výkonem intravenózně. Již zavedená antibiotika z jiné indikace není nutno měnit. Podání orálního roztoku cotrimoxazolu (800 + 160 mg) do PEG těsně po zavedení bylo shledáno stejně účinné jako standardní intravenózní profylaxe, s potenciální výhodou pokrytí methicilin rezistentní Staphyloccocus aureus (MRSA) [48]. U pacientů se známou (nebo předpokládanou) kolonizací orofaryngu rezistentními patogeny je vhodné individuálně antibiotikum volit dle známé citlivosti, neboť v závislosti na lokální mikrobiologické situaci je až 50 % peristomálních infekcí způsobeno bakteriemi rezistentními na standardní profylaxi [49,50]. Rezistentní kmeny, zvláště MRSA, se vyskytují u osob dlouhodobě pobývajících ve zdravotnických a sociálních zařízeních [49,51].
Premedikace a monitorace během výkonu
Pacienti indikovaní k zavedení PEG mohou být rizikoví k podání hlubší analgosedace či celkové anestezie pro své základní onemocnění a malnutrici. V naprosté většině případů lze PEG zavést buď pouze v lokální anestezii dutiny ústní, krku a břišní stěny (například Mesocain 1 %) anebo v kombinaci lokální anestezie a celkově podané malé dávky benzodiazepinu a/nebo opiátu [28,52]. Během analgosedace je vždy nutné zajistit min. monitoraci krevního tlaku, tepové frekvence a saturace kyslíkem. Je vhodné mít k dispozici specifická antidota (flumazenil, naloxon) a vybavení k provádění kardiopulmonální resuscitace. Nejvíce rizikoví pacienti k podání celkově působících sedativ jsou pacienti s amyotrofickou laterální sklerózou a jinými neuromuskulárními chorobami spojenými se svalovou slabostí [53]. V selektovaných případech, kdy není možné zavedení PEG v lokální anestezii (např. Huntingtonova chorea, neklidný pacient a jiné), je nutno předem zajistit anesteziologické vyšetření a asistenci anesteziologa během výkonu.
Vlastní provedení PEG
PEG je intervenční výkon při gastroskopii. Po výběru optimální lokality pro punkci žaludku dle diafanoskopie následuje zavedení katetru některou ze tří běžných metod. Volba techniky závisí na indikaci a zkušenostech pracoviště.
Výkon začíná diagnostickou gastroskopií k vyloučení lokální kontraindikace nebo obstrukce distálně od žaludku. Základním principem zavedení PEG je výběr vhodné lokality na břiše v místě, kde je v optimálním kontaktu insuflovaný žaludek a břišní stěna. Endoskopické prosvícení stěny navenek (diafanoskopie) a vizualizace palpace břišní stěny v žaludku je klíčové pro výběr místa punkce. Ideální lokalizace je na přední stěně žaludku v distální části těla, mimo více vaskularizovanou malou a velkou křivinu. Zevně je lokalita punkce obvykle mediálně v epigastriu nebo paramediálně vlevo několik cm kaudálně od okraje žeber, u aktivních pacientů lépe mimo osu přímého břišního svalu. S výhodou lze použít techniku safe tract, kdy po náležité kožní dezinfekci tenkou jehlou napojenou na stříkačku s lokálním anestetikem punktujeme směrem na žaludek za současné aspirace. Nasátí vzduchu do stříkačky současně s vizualizovaným průchodem jehly do žaludku minimalizuje riziko přítomnosti vmezeřeného orgánu. Následně je lokálním anestetikem infiltrován předpokládaný kanál. Dle praxe většiny autorů by kožní incize měla být dostatečně dlouhá (cca 10 mm pro 20F katetr), aby nedocházelo ke kumulaci tkáňové tekutiny a krve v kanále se zvýšením rizika infekce. Nicméně výsledky minima studií na toto téma jsou kontroverzní [54]. Punkce žaludku zaváděcí jehlou s kanylou umožní zavedení vodicího vlákna. To je pak uchyceno kličkou nebo kleštěmi a extrahováno společně s endoskopem před ústa.
Při metodě pull je připojený katetr zaveden do definitivní pozice tahem za vlákno z břišní stěny. Opakování endoskopie ke kontrole polohy vnitřního fixačního disku v žaludku není nezbytné, záleží na posouzení provádějícího lékaře [55]. V úvodních dnech po zavedení by měla být zevní fixace dotažena těsně ke kůži, ale nemělo by dojít k zanoření pod úroveň kůže v okolí.
Metoda push (over a wire) kombinuje zavedení vodiče do žaludku a ven přes ústa pomocí endoskopu stejně jako pull zavedení. Rozdílně se pak implantuje PEG katetr tlakem po vodicím drátě přes ústa do incize v břišní stěně. Je sníženo riziko poranění tkání tahem tenkého vlákna, což lze využít např. u relativních stenóz jícnu a kardie. Konec katetru je pak uchopen a opět je tahem umístěn do výsledné pozice s následnou fixací.
Přímé zavedení PEG do žaludku (push through, direktní PEG) přes břišní stěnu jen při insuflaci žaludku a pod endoskopickou kontrolou je při současném vybavení bezpečnou a plnohodnotnou alternativou pull způsobu zavedení u pacientů, kde by protažení katetru přes ústa a jícen bylo problematické či nemožné. Indikováno je u těsných stenóz jícnu a faryngu, krvácejících nádorů, u pacientů se zavedeným jícnovým stentem nebo z jiných lokálních příčin. Při těsné stenóze lze použít tenký (nazální) gastroskop. Při přímém zavedení je v průběhu výkonu fixován žaludek k břišní stěně pomocí speciální dvojité jehly k naložení stehu. Po založení 2–3 fixačních stehů je mezi nimi v místě incize punktován žaludek trokarem s navlečenou rozlamovací kanylou, kterou je následně zaveden balonkový PEG katetr do žaludku. Jiný systém fixuje žaludek pomocí jehlou zavedených T kotev a následně je po vodiči a postupné dilataci zavedena rozlamovací kanyla a přes ni pak balonkový katetr. Nejzávažnějším problémem může být časná dislokace balonkového katetru s rizikem rozvoje peritonitidy [12].
Péče o pacienta s PEG
Správná péče o PEG po zavedení vede ke snížení výskytu komplikací. Podání výživy lze zahájit již 3 hod po nekomplikovaném výkonu. Rizikové je přílišné utažení katetru. Vhodná ošetřovatelská péče je nezbytnou součástí doporučení po výkonu.
Péče o pacienta a katetr po zavedení PEG je klíčová pro snížení rizika vzniku komplikací. Lokálně by měla být standardizovaná a dobře dokumentovaná, aby byla snadno předatelná do hospitalizační, následné i domácí péče o pacienta. Benefitem pro pracoviště i pacienty může být zřízení specializovaného ošetřovatelského týmu k edukaci péče o PEG a zajištění následných kontrol a výměn.
Mnoho studií hodnotilo bezpečnost časného zahájení používání PEG [56,57]. Po 3–4 hod od zavedení lze většinou bezpečně zahájit 1. dávku výživy. Během aplikace výživy a cca 30 min poté by měl pacient mít zvýšenou horní část těla o 30–45º k prevenci refluxu a aspirace [58]. Po podání výživy by měla být sonda propláchnuta min. 50 ml vody. Rozpis a složení enterální výživy do PEG by mělo být konzultováno s lékařem-nutricionistou. Plnohodnotná (definovaná) enterální výživa zabezpečí dostatečné pokrytí všech nutričních potřeb pacienta. Na možnost podávání jiných potravin (káva, pivo, džus apod.) do PEG nejsou názory jednotné. Do žaludku je výživa aplikována bolusově s noční pauzou, při postpylorickém podání je indikována výživa kontinuální pomocí pumpy. K prevenci ucpání katetru, které nastává v 15–25 % PEG, je podávání léků preferováno v tekutých formách, případně drcených s dostatečným proplachem [59,60].
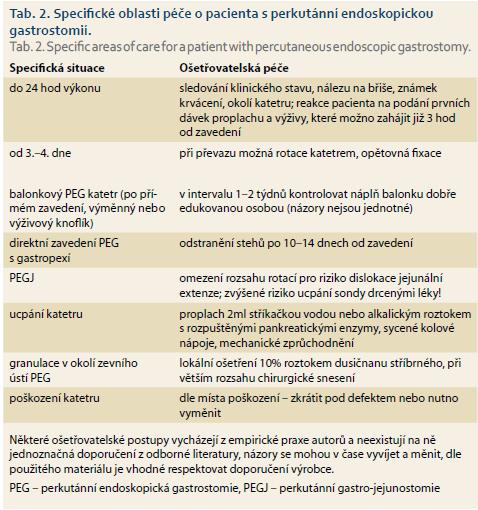
Lokální péče o katetr se liší v čase. V 1. týdnu od zavedení dochází k vyzrávání gastrokutánního kanálu, v dlouhodobém horizontu je smyslem ošetřování a manipulace s katetrem prevence komplikací. Zevní fixátor by měl být umístěn s dostatečnou vůlí (cca 5 mm) od kůže, aby nedocházelo ke kompresi tkání mezi zevním a vnitřním diskem, která zvyšuje riziko ischémie, nekrózy, infekce a dalších komplikací. Peritoneálnímu úniku ihned po zavedení PEG brání iniciální otok tkání, přesto někteří autoři doporučují v prvních 4 dnech umístit fixátor těsněji. Příklad poučení pro pacienta a ošetřující personál v příloze č. 1. Specifické oblasti péče o PEG jsou uvedeny v tab. 2.
Komplikace PEG a jejich řešení
Komplikace PEG jsou relativně časté, většina z nich je lehkých, některé však mohou být i život ohrožující. Časné rozpoznání rizikové situace a komplikace umožní adekvátní terapii. Správná indikace PEG, technika provedení a odpovídající opatření před výkonem, během výkonu a po něm mohou riziko komplikací redukovat.
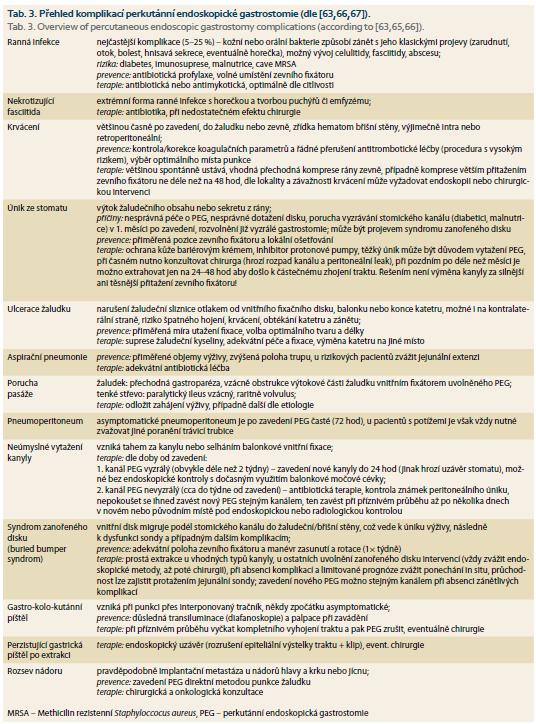
Incidence komplikací po zavedení PEG je odhadována kolem 8–40 %, většina z nich (90 %) lehkých; riziko narůstá s věkem, komorbiditami (především infekcí) a anamnézou aspirace [14,61,62]. Riziko úmrtí v souvislosti s PEG je odhadováno na < 1 %, ačkoli celková 30denní mortalita nemocných s PEG je relativně vysoká. Komplikace je možné rozdělit dle závažnosti na mírné a těžké; dle vztahu k zavedení na peri-a postprocedurální; dle fáze vyzrávání stomického kanálu na časné a pozdní [63]. Stomický kanál je považován za plně vyzrálý po cca 2–4 týdnech (závisí na kondici pacienta), do té doby není jistota o vzájemném přihojení vrstev a při jakékoli manipulaci s PEG či při jeho vytažení hrozí separace vrstev a peritoneální únik. Významná část pacientů indikovaných pro PEG má v důsledku svého onemocnění narušené vědomí, smyslové vnímání a komunikaci. Aktivní dohled časně po zavedení PEG a objektivní kontroly v průběhu dlouhodobé péče hrají v odhalení komplikací důležitou roli. Podezření na případnou komplikaci výkonu vychází z celkového klinického vyšetření pacienta, lokálního nálezu na břiše a výsledků laboratorních testů. Při nejistých potížích a abnormálních nálezech je nutné včasné doplnění sonografie, CT nebo endoskopie. Prostý snímek břicha má jen limitovanou výpovědní hodnotu, navíc časně po zavedení není vzácné asymptomatické pneumoperitoneum, s limitovaným klinickým významem [64]. V tab. 3 [65,66] jsou uvedeny nejčastější komplikace specifické pro PEG; nejsou uvedeny obecné komplikace gastroskopie (vyšší riziko aspirace při poloze na zádech u rizikových nemocných), ani některé spíše raritní komplikace (poranění vnitřních orgánů a podobně), jejichž řešení je velmi individuální. Z pohledu endoskopisty je nejvýznamnější pozdní komplikací syndrom zanořeného disku. Kromě chirurgického zásahu v situacích, kde je disk již zcela mimo žaludeční stěnu, je k dispozici řada technik k pokusu o endoskopické uvolnění [67].
Odstranění PEG
Cílené odstranění PEG je bezpečné až po vyzrání gastrokutánního kanálu, obvykle za 3–4 týdny. Podmínkou k odstranění je zajištění dostatečné výživy jiným způsobem. Gastrokutánní kanál se obvykle spontánně zahojí. Plánovaná výměna PEG katetru závisí na doporučení výrobce, stavu pacienta a technickém stavu katetru.
Odstranění PEG je indikováno, pokud již výživa cestou PEG není potřeba nebo nastane specifická komplikace (nejčastěji neopravitelné poškození katetru PEG, permanentní prosakování žaludečního obsahu, buried bumper syndrom a jiné) [52]. Nechirurgická extrakce PEG je bezpečná až za 3 týdny a déle od zavedení PEG, kdy je již dobře vyzrálý gastrokutánní kanál. Plánovaná výměna PEG katetru závisí na doporučení výrobce, stavu pacienta a technickém stavu katetru. U balonkové vnitřní fixace je to obvykle za 3–6 měsíců, u diskového typu za 1–2 roky. Typ následného PEG katetru záleží na lokálních podmínkách a dostupnosti.
Endoskopická extrakce vnitřního disku endoskopickou cestou pull out method (vnitřní disk je při endoskopii uchycený do polypektomické kličky a po přestřižení hadičky zevně u kůže vytažen orálně) je optimálním přístupem s nejnižším výskytem komplikací a bez potřeby celkové anestezie. V literatuře zmiňovanou perkutánní metodu (silným setrvalým tahem za PEG extrahovat katetr s vnitřním diskem skrze kanál, bez nutnosti endoskopie) nelze považovat za univerzální způsob extrakce. Podmínkou tohoto způsobu je vhodný typ disku dle doporučení výrobce (většinou měkký disk zvonovitého tvaru) a volná pohyblivost katetru [68]. Techniku cut and push s ponecháním vnitřního disku k pasáži per vias naturales lze doporučit pouze v krajním případě, kdy nelze extrahovat PEG endoskopicky a pacient je neúnosný k chirurgické extrakci v celkové anestezii. Tato technika je doporučována některými experty, nicméně je zatížena potenciálním rizikem perforace tenkého střeva či obstrukčního ilea [69,70]. Typy PEG, které mají distálně balonek, jsou po vypuštění balonku snadno extrahovány tahem zevně.
Gastrokutánní kanál se po extrakci PEG hojí obvykle do několika dní spontánně a jen výjimečně přetrvává. Příčinou přetrvávající gastrokutánní píštěle může být lokální infekce, špatné tkáňové hojení, obleněné vyprazdňování žaludku nebo zvýšená produkce žaludečních šťáv. K uzavření traktu píštěle lze použít endoskopické naložení klipů vč. over the scope clip [71], popřípadě při neúspěchu chirurgickou suturu [72,73].
Alternativní postupy k PEG
Alternativou PEG je gastrostomie zavedená chirurgicky nebo pod radiologickou kontrolou. V definovaných případech je možná technika PEGJ nebo přímé perkutánní jejunostomie. V dlouhodobé péči lze místo PEG implantovat výživový knoflík.
Alternativou endoskopického zavedení gastrostomie může být chirurgicky provedená gastrostomie nebo perkutánní gastrostomie navigovaná zobrazovacími metodami – ultrazvukem, skiaskopicky nebo CT. Indikací může být nemožnost endoskopické identifikace správného místa zavedení pro nemožnost provedení gastroskopie (například endoskopicky neprůchodná stenóza jícnu, devastující poranění hlavy a krku), anatomické příčiny (výrazná obezita, změněná anatomie po předchozích chirurgických výkonech) nebo plánovaná operace z jiného důvodu, kde lze současně výživovou stomii zavést. Srovnání jednotlivých technik neukázalo výrazné rozdíly v morbiditě a mortalitě, nicméně snadnost a dostupnost endoskopického zavedení PEG vedly k jeho masivnímu rozšíření [74]. Bližší popis technik alternativních k PEG lze najít v příslušných textech [75,76].
Perkutánní endoskopická gastrostomie s jejunální extenzí, perkutánní endoskopická jejunostomie
PEGJ představuje alternativu k dlouhodobému podávání výživy do jejuna (postpyloricky) při možnosti současné dekomprese žaludku [77]. Technicky se provádí stejně jako PEG, jen je do katetru zavedeného perkutánně do žaludku vložen ještě jeden tenčí, který směřuje přes pylorus do duodena a orálního jejuna. PEGJ je výhodná pro pacienty s těžkým gastroezofageálním refluxem, gastroparézou a vysokým rizikem aspirací při gastrickém podávání výživy. Dlouhodobá jejunální výživa může být indikována u pacientů s chronickou pankreatitidou a jinak neřešitelnou malnutricí. Kompatibilní sety pro jejunální extenzi jsou komerčně dostupné s variabilním uspořádáním enterálního konce katetru k udržení optimální pozice, nicméně malfunkce katetru je poměrně častá [78]. Přímé endoskopické zavedení jejunostomie (PEJ), tj. vyhledání vhodného místa orálního jejuna v blízkosti břišní stěny a punkce lumen pod endoskopickou kontrolou (většinou je použit enteroskop nebo dětský koloskop), je proveditelné u pacientů, u nichž anatomické poměry neumožňují punkci žaludku [79].
Po vyzrání gastrokutánního kanálu lze obvyklý PEG katetr nahradit výživovým knoflíkem (feeding button). Tento krátký, balonkem zakončený katetr, má diskrétní vzhled s minimální prominencí nad břišní stěnu a speciální katetr se do něj napojuje jen při aplikaci. Je výhodný u dětí a aktivních pacientů [80,81].
Závěr
Zajištění výživy pomocí PEG je důležitou součástí dlouhodobé péče o pacienty s nemožností dostatečného perorálního příjmu. Relativní snadnost endoskopického výkonu umožňuje dostupnost pro široké spektrum pacientů. Racionální indikace, technická úspěšnost a znalost souvislostí spojených s výkonem by měla zajišťovat z pohledu pacienta bezpečnou a smysluplnou intervenci. Dlouhodobé výsledky a výskyt komplikací jsou nedílně spojeny s odpovídající ošetřovatelskou péčí. Pro mnoho pacientů je zavedení PEG významnou změnou v jejich životě. Aby to byla změna pozitivní, měli by zdravotníci věnovat pozornost dostatečnému poučení, individuálnímu přístupu k pacientovi a jeho okolí, s povědomím o prevenci a řešení komplikací.
MUDr. Radek Kroupa, Ph.D.
Interní gastroenterologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
kroupa.radek@fnbrno.cz



Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Gomes CA, Andriolo RB, Bennett C et al. Percutaneous endoscopic gastrostomy versus nasogastric tube feeding for adults with swallowing disturbances. Cochrane Database Syst Rev 2015; 5: CD008096. doi: 10.1002/14651858.CD008096.pub4.
2. Prabhakaran S, Doraiswamy VA, Nagaraja V et al. Nasoenteric tube complications. Scand J Surg 2012; 101 (3): 147–155. doi: 10.1177/ 145749691210100302.
3. Cúrdia GT, Marinho C, Magalhães J et al. Percutaneous endoscopic gastrostomy: confirming the clinical benefits far beyond anthropometry. Eur J Gastroenterol Hepatol 2017; 29 (9): 1097–1101. doi: 10.1097/MEG.0000000000000923.
4. Barbosa M, Magalhães J, Marinho C et al. Predictive factors of early mortality after percutaneous endoscopic gastrostomy placement: the importance of C-reactive protein. Clin Nutr ESPEN 2016; 14: 19–23. doi: 10.1016/j.clnesp.2016.04.029.
5. Janes SE, Price CS, Khan S. Percutaneous endoscopic gastrostomy: 30-day mortality trends and risk factors. J Postgrad Med 2005; 51 (1): 23–29.
6. Zopf Y, Maiss J, Konturek P et al. Predictive factors of mortality after PEG insertion: guidance for clinical practice. JPEN J Parenter Enteral Nutr 2011; 35 (1): 50–55. doi: 10.1177/0148607110376197.
7. Lee C, Im JP, Kim JW et al. Risk factors for complications and mortality of percutaneous endoscopic gastrostomy: a multicenter, retrospective study. Surg Endosc 2013; 27 (10): 3806–3815. doi: 10.1007/s00464-013-2979-3.
8. Romano C, van Wynckel M, Hulst J et al. European Society for Paediatric Gastroenterology, Hepatology and Nutrition guidelines for the evaluation and treatment of gastrointestinal and nutritional complications in children with neurological impairment. J Pediatr Gastroenterol Nutr 2017; 65 (2): 242–264. doi: 10.1097/MPG.0000000000001646.
9. Gauderer MW, Ponsky JL, Izant RJ. Gastrostomy without laparotomy: a percutaneous endoscopic technique. J Pediatr Surg 1980; 15 (6): 872–875.
10. Hogan RB, DeMarco DC, Hamilton JK et al. Percutaneous endoscopic gastrostomy – to push or pull. A prospective randomized trial. Gastrointest Endosc 1986; 32 (4): 253–258.
11. Russell TR, Brotman M, Norris F. Percutaneous gastrostomy. A new simplified and cost-effective technique. Am J Surg 1984; 148 (1): 132–137.
12. Schaefer H, Vivaldi C, Herbold T et al. Percutaneous endoscopic gastrostomy in direct puncture technique: when, why and how? Dig Surg 2017; 34 (1): 52–59. doi: 10.1159/000447726.
13. Druml C, Ballmer PE, Druml W et al. ESPEN guideline on ethical aspects of artificial nutrition and hydration. Clin Nutr 2016; 35 (3): 545–556. doi: 10.1016/j.clnu.2016.02.006.
14. Löser C, Aschl G, Hébuterne X et al. ESPEN guidelines on artificial enteral nutrition – percutaneous endoscopic gastrostomy (PEG). Clin Nutr 2005; 24 (5): 848–861.
15. Volkert D, Beck AM, Cederholm T et al. ESPEN guideline on clinical nutrition and hydration in geriatrics. Clin Nutr 2019; 38 (1): 10–47. doi: 10.1016/j.clnu.2018.05.024.
16. Úmluva o lidských právech a biomedicíně. Předpis č. 96/2001 Sb. m. s., Sbírka mezinárodních smluv ročník 2001, částka 44, ze dne 2. 10. 2001.
17. Zákon č. 372/2011 Sb., o zdravotních službách.
18. Zákon č. 89/2012 Sb., občanský zákoník.
19. Burgos R, Bretón I, Cereda E et al. ESPEN guideline clinical nutrition in neurology. Clin Nutr 2018; 37 (1): 354–396. doi: 10.1016/j.clnu.2017.09.003.
20. ProGas Study Group. Gastrostomy in patients with amyotrophic lateral sclerosis (ProGas): a prospective cohort study. Lancet Neurol 2015; 14 (7): 702–709. doi: 10.1016/S1474-4422 (15) 00104-0.
21. McCulloch A, Roy O, Massey D et al. Nasal unsedated seated percutaneous endoscopic gastrostomy (nuPEG): a safe and effective technique for percutaneous endoscopic gastrostomy placement in high-risk candidates. Frontline Gastroenterol 2018; 9 (2): 105–109. doi: 10.1136/flgastro-2017-100894.
22. Antonini A, Poewe W, Chaudhuri KR et al. Levodopa-carbidopa intestinal gel in advanced Parkinson’s: final results of the GLORIA registry. Parkinsonism Relat Disord 2017; 45: 13–20. doi: 10.1016/j.parkreldis.2017.09.018.
23. Gil E, Agmon M, Hirsch A et al. Dilemmas for guardians of advanced dementia patients regarding tube feeding. Age Ageing 2018; 47 (1): 138–143. doi: 10.1093/ageing/afx161.
24. Volkert D, Chourdakis M, Faxen-Irving G et al. ESPEN guidelines on nutrition in dementia. Clin Nutr 2015; 34 (6): 1052–1073. doi: 10.1016/j.clnu.2015.09.004.
25. Candy B, Sampson EL, Jones L. Enteral tube feeding in older people with advanced dementia: findings from a Cochrane systematic review. Int J Palliat Nurs 2009; 15 (8): 396–404.
26. Sampson EL, Candy B, Jones L. Enteral tube feeding for older people with advanced dementia. Cochrane Database Syst Rev 2009; 2: CD007209. doi: 10.1002/14651858.CD007209.pub2.
27. Mitchell SL, Tetroe JM. Survival after percutaneous endoscopic gastrostomy placement in older persons. J Gerontol A Biol Sci Med Sci 2000; 55 (12): M735–739. doi: 10.1093/gerona/55.12.m735.
28. Balihar K, Janská E, Zdrhová L et al. Percutaneous endoscopic gastrostomy: analysis of practice at the endoscopic center of tertiary medical care. Vnitr Lek 2016; 62 (6): 435–441.
29. Dittrich A, Schubert B, Kramer M et al. Benefits and risks of a percutaneous endoscopic gastrostomy (PEG) for decompression in patients with malignant gastrointestinal obstruction. Support Care Cancer 2017; 25 (9): 2849–2856. doi: 10.1007/s00520-017-3700-1.
30. Dewys WD, Begg C, Lavin PT et al. Prognostic effect of weight loss prior to chemotherapy in cancer patients. Eastern Cooperative Oncology Group. Am J Med 1980; 69 (4): 491–497.
31. Salas S, Baumstarck-Barrau K, Alfonsi M et al. Impact of the prophylactic gastrostomy for unresectable squamous cell head and neck carcinomas treated with radio-chemotherapy on quality of life: prospective randomized trial. Radiother Oncol 2009; 93 (3): 503–509. doi: 10.1016/j.radonc.2009.05.016.
32. Arends J, Bachmann P, Baracos V et al. ESPEN guidelines on nutrition in cancer patients. Clin Nutr 2017; 36 (1): 11–48. doi: 10.1016/j.clnu.2016.07.015.
33. Paccagnella A, Morello M, Da Mosto MC et al. Early nutritional intervention improves treatment tolerance and outcomes in head and neck cancer patients undergoing concurrent chemoradiotherapy. Support Care Cancer 2010; 18 (7): 837–845. doi: 10.1007/s00520-009-0717-0.
34. McClelland S 3rd, Andrews JZ, Chaudhry H et al. Prophylactic versus reactive gastrostomy tube placement in advanced head and neck cancer treated with definitive chemoradiotherapy: a systematic review. Oral Oncol 2018; 87: 77–81. doi: 10.1016/j.oraloncology.2018.10.028.
35. Mekhail TM, Adelstein DJ, Rybicki LA et al. Enteral nutrition during the treatment of head and neck carcinoma: is a percutaneous endoscopic gastrostomy tube preferable to a nasogastric tube? Cancer 2001; 91 (9): 1785–1790.
36. Schattner MA, Willis HJ, Raykher A et al. Long-term enteral nutrition facilitates optimization of body weight. JPEN J Parenter Enteral Nutr 2005; 29 (3): 198–203. doi: 10.1177/0148607105029003198.
37. Jatoi A, Loprinzi CL. The role of parenteral and enteral/oral nutritional support in patients with cancer. [online]. Available from: https: //www.uptodate.com/contents/the-role-of-parenteral-and-enteral-oral-nutritional-support-in-patients-with-cancer.
38. Cruz I, Mamel JJ, Brady PG et al. Incidence of abdominal wall metastasis complicating PEG tube placement in untreated head and neck cancer. Gastrointest Endosc 2005; 62 (5): 708–711. doi: 10.1016/j.gie.2005.06.041.
39. Ellrichmann M, Sergeev P, Bethge J et al. Prospective evaluation of malignant cell seeding after percutaneous endoscopic gastrostomy in patients with oropharyngeal/esophageal cancers. Endoscopy 2013; 45 (7): 526–531. doi: 10.1055/s-0033-1344023.
40. Baltz JG, Argo CK, Al-Osaimi AM et al. Mortality after percutaneous endoscopic gastrostomy in patients with cirrhosis: a case series. Gastrointest Endosc 2010; 72 (5): 1072–1075. doi: 10.1016/j.gie.2010.06.043.
41. Lang A, Bardan E, Chowers Y et al. Risk factors for mortality in patients undergoing percutaneous endoscopic gastrostomy. Endoscopy 2004; 36 (6): 522–526. doi: 10.1055/s-2004-814400.
42. ASGE Standards of Practice Committee, Acosta RD, Abraham NS et al. The management of antithrombotic agents for patients undergoing GI endoscopy. Gastrointest Endosc 2016; 83 (1): 3–16. doi: 10.1016/j.gie.2015.09.035.
43. Veitch AM, Vanbiervliet G, Gershlick AH et al. Endoscopy in patients on antiplatelet or anticoagulant therapy, including direct oral anticoagulants: British Society of Gastroenterology (BSG) and European Society of Gastrointestinal Endoscopy (ESGE) guidelines. Endoscopy 2016; 48 (4): 385–402. doi: 10.1055/s-0042-102652.
44. Richter JA, Patrie JT, Richter RP et al. Bleeding after percutaneous endoscopic gastrostomy is linked to serotonin reuptake inhibitors, not aspirin or clopidogrel. Gastrointest Endosc 2011; 74 (1): 22–34.e1. doi: 10.1016/j.gie.2011.03.1258.
45. Cook D, Guyatt G. Prophylaxis against upper gastrointestinal bleeding in hospitalized patients. N Engl J Med 2018; 378 (26): 2506–2516. doi: 10.1056/NEJMra1605507.
46. Hamai K, Iwamoto H, Ohshimo S et al. Use of proton pump inhibitors is associated with increased mortality due to nosocomial pneumonia in bedridden patients receiving tube feeding. Geriatr Gerontol Int 2018; 18 (8): 1215–1218. doi: 10.1111/ggi.13450.
47. Lipp A, Lusardi G. Systemic antimicrobial prophylaxis for percutaneous endoscopic gastrostomy. Cochrane Database Syst Rev 2013; 11: CD005571. doi: 10.1002/14651858.
48. Blomberg J, Lagergren P, Martin L et al. Novel approach to antibiotic prophylaxis in percutaneous endoscopic gastrostomy (PEG): randomised controlled trial. BMJ 2010; 341: c3115. doi: 10.1136/bmj.c3115.
49. Kroupa R, Jurankova J, Dastych M et al. Different clinical utility of oropharyngeal bacterial screening prior to percutaneous endoscopic gastrostomy in oncological and neurological patients. Biomed Res Int 2014; 2014: 590891. doi: 10.1155/2014/590891.
50. Tang X, Gong W, Jiang B. Antibiotic prophylaxis for GI endoscopy. Gastrointest Endosc 2015; 81 (6): 1503–1504. doi: 10.1016/j.gie.2015.01.021.
51. Peters C, Dulon M, Kleinmüller O et al. MRSA prevalence and risk factors among health personnel and residents in nursing homes in Hamburg, Germany – a cross-sectional study. PloS One 2017; 12 (1): e0169425. doi: 10.1371/journal.pone.0169425.
52. Rahnemai-Azar AA, Rahnemaiazar AA, Naghshizadian R et al. Percutaneous endoscopic gastrostomy: indications, technique, complications and management. World J Gastroenterol 2014; 20 (24): 7739–7751. doi: 10.3748/wjg.v20.i24.7739.
53. Strijbos D, Hofstede J, Keszthelyi D et al. Percutaneous endoscopic gastrostomy under conscious sedation in patients with amyotrophic lateral sclerosis is safe: an observational study. Eur J Gastroenterol Hepatol 2017; 29 (11): 1303–1308. doi: 10.1097/MEG.0000000000000 959.
54. Fagundes RB, Cantarelli JC Jr, Fontana K et al. Percutaneous endoscopic gastrostomy and peristomal infection: an avoidable complication with the use of a minimum skin incision. Surg Laparosc Endosc Percutan Tech 2011; 21 (4): 275–277. doi: 10.1097/SLE.0b013e318221c3f1.
55. Odelowo OO, Dasaree L, Hamilton Y et al. Is repeat endoscopy necessary after percutaneous endoscopic gastrostomy? J Assoc Acad Minor Phys 2002; 13 (2): 57–58.
56. Bechtold ML, Matteson ML, Choudhary A et al. Early versus delayed feeding after placement of a percutaneous endoscopic gastrostomy: a meta-analysis. Am J Gastroenterol 2008; 103 (11): 2919–2924. doi: 10.1111/j.1572-0241.2008.02108.x.
57. Szary NM, Arif M, Matteson ML et al. Enteral feeding within three hours after percutaneous endoscopic gastrostomy placement: a meta-analysis. J Clin Gastroenterol 2011; 45 (4): e34–38. doi: 10.1097/MCG.0b013e3181eeb732.
58. Friginal-Ruiz AB, Lucendo AJ. Percutaneous endoscopic gastrostomy: a practical overview on its indications, placement conditions, management, and nursing care. Gastroenterol Nurs 2015; 38 (5): 354–366. doi: 10.1097/SGA.0000000000000150.
59. Blumenstein I, Shastri YM, Stein J. Gastroenteric tube feeding: techniques, problems and solutions. World J Gastroenterol 2014; 20 (26): 8505–8524. doi: 10.3748/wjg.v20.i26. 8505.
60. Bourgault AM, Heyland DK, Drover JW et al. Prophylactic pancreatic enzymes to reduce feeding tube occlusions. Nutr Clin Pract 2003; 18 (5): 398–401. doi: 10.1177/0115426503018005 398.
61. Blomberg J, Lagergren J, Martin L et al. Complications after percutaneous endoscopic gastrostomy in a prospective study. Scand J Gastroenterol 2012; 47 (6): 737–742. doi: 10.3109/00365521.2012.654404.
62. Schneider AS, Schettler A, Markowski A et al. Complication and mortality rate after percutaneous endoscopic gastrostomy are low and indication-dependent. Scand J Gastroenterol 2014; 49 (7): 891–898. doi: 10.3109/ 00365521.2014.916343.
63. Hucl T, Spicak J. Complications of percutaneous endoscopic gastrostomy. Best Pract Res Clin Gastroenterol 2016; 30 (5): 769–781. doi: 10.1016/j.bpg.2016.10.002.
64. Wiesen AJ, Sideridis K, Fernandes A et al. True incidence and clinical significance of pneumoperitoneum after PEG placement: a prospective study. Gastrointest Endosc 2006; 64 (6): 886–889. doi: 10.1016/j.gie.2006.06.088.
65. DeLegge MH. Enteral access and associated complications. Gastroenterol Clin North Am 2018; 47 (1): 23–37. doi: 10.1016/j.gtc.2017.09.003.
66. Westaby D, Young A, O’Toole P et al. The provision of a percutaneously placed enteral tube feeding service. Gut 2010; 59 (12): 1592–1605. doi: 10.1136/gut.2009.204982.
67. Cyrany J, Rejchrt S, Kopacova M et al. Buried bumper syndrome: a complication of percutaneous endoscopic gastrostomy. World J Gastroenterol 2016; 22 (2): 618–627. doi: 10.3748/wjg.v22.i2.618.
68. Lee CG, Kang HW, Lim YJ et al. Comparison of complications between endoscopic and percutaneous replacement of percutaneous endoscopic gastrostomy tubes. J Korean Med Sci 2013; 28 (12): 1781–1787. doi: 10.3346/jkms.2013.28.12.1781.
69. Agha A, AlSaudi D, Furnari M et al. Feasibility of the cut-and-push method for removing large-caliber soft percutaneous endoscopic gastrostomy devices. Nutr Clin Pract 2013; 28 (4): 490–492. doi: 10.1177/0884533613486933.
70. Waxman I, al-Kawas FH, Bass B et al. PEG ileus. A new cause of small bowel obstruction. Dig Dis Sci 1991; 36 (2): 251–254.
71. Heinrich H, Gubler C, Valli PV. Over-the-scope-clip closure of long lasting gastrocutaneous fistula after percutaneous endoscopic gastrostomy tube removal in immunocompromised patients: a single center case series. World J Gastrointest Endosc 2017; 9 (2): 85–90. doi: 10.4253/wjge.v9.i2.85.
72. Deen OJ, Parisian KR, Harris C 3rd et al. A novel procedure for gastrocutaneous fistula closure. J Clin Gastroenterol 2013; 47 (7): 608–611. doi: 10.1097/MCG.0b013e3182819c7c.
73. Hameed H, Kalim S, Khan YI. Closure of a nonhealing gastrocutaneous fistula using argon plasma coagulation and endoscopic hemoclips. Can J Gastroenterol 2009; 23 (3): 217–219.
74. Burkitt P, Carter LM, Smith AB et al. Outcomes of percutaneous endoscopic gastrostomy and radiologically inserted gastrostomy in patients with head and neck cancer: a systematic review. Br J Oral Maxillofac Surg 2011; 49 (7): 516–520. doi: 10.1016/j.bjoms.2010.09.005.
75. ASGE Technology Committee, Kwon RS, Banerjee S et al. Enteral nutrition access devices. Gastrointest Endosc 2010; 72 (2): 236–248. doi: 10.1016/j.gie.2010.02.008.
76. Given MF, Lyon SM, Lee MJ. The role of the interventional radiologist in enteral alimentation. Eur Radiol 2004; 14 (1): 38–47. doi: 10.1007/s00330-003-1911-y.
77. Gottfried EB, Plumser AB. Endoscopic gastrojejunostomy: a technique to establish small bowel feeding without laparotomy. Gastrointest Endosc 1984; 30 (6): 355–357. doi: 10.1016/S0016-5107 (84) 72454-0.
78. Ridtitid W, Lehman GA, Watkins JL et al. Short-and long-term outcomes from percutaneous endoscopic gastrostomy with jejunal extension. Surg Endosc 2017; 31 (7): 2901–2909. doi: 10.1007/s00464-016-5301-3.
79. Del Piano M, Ballarè M, Carmagnola S et al. DPEJ placement in cases of PEG insertion failure. Dig Liver Dis 2008; 40 (2): 140–143. doi: 10. 1016/j.dld.2007.09.012.
80. Kohout P. Zkušenosti se zaváděním výživového knoflíku v České republice. Ceska Slov Gastroenterol Hepatol 2004; 58 (1): 11–15.
81. Novotny NM, Vegeler RC, Breckler FD et al. Percutaneous endoscopic gastrostomy buttons in children: superior to tubes. J Pediatr Surg 2009; 44 (6): 1193–1196. doi: 10.1016/j.jpedsurg.2009.02.024.