Možnosti miniinvazivní chirurgie u pacientů s Crohnovu nemocí a ulcerózní kolitidou
Lumír Kunovský1,2, Filip Marek1, Zdeněk Kala Orcid.org 1, Jiří Dolina Orcid.org 3, Petr Moravčík4, Vladimír Čan1, Vladimír Procházka Orcid.org 1
+ Pracoviště
Souhrn
Crohnova nemoc a ulcerózní kolitida jsou řazeny mezi chronická zánětlivá onemocnění střev, u kterých má i v době možnosti biologické terapie chirurgická léčba stále nezastupitelné místo. V článku jsou stručně shrnuty indikace k operačnímu řešení u pacientů s idiopatickými střevními záněty. Dále se zaměřujeme na možnosti miniinvazivních operačních technik od laparoskopicky asistovaných výkonů po relativně nové miniinvazivní metody. V textu jsou zmíněny naše zkušenosti – výhody či úskalí nově zaváděných operačních technik s odkazem na nejnovější současné studie a literaturu. Rozebrán je také vliv chirurgické léčby na kvalitu života u pacientů s nespecifickými střevními záněty.
Klíčová slova
Crohnova choroba, chirurgie, idiopatické střevní záněty, kvalita života, laparoskopie, ulcerózna kolitídaÚvod
Crohnovu nemoc (CD – Crohn’s disease) a ulcerozní kolitidu (UC – ulcerative colitis) řadíme mezi chronická zánětlivá onemocnění střev. Incidence idiopatických střevních zánětů (IBD – inflammatory bowel disease) stále narůstá, a to zvláště ve vyspělých státech světa. Mezi oblasti s nejvyšší incidencí patří Severní Amerika, Austrálie a severozápádní státy Evropy [1–5]. Diagnóza IBD je často stanovena již v mladším věku a zhruba polovina pacientů má stanovenou diagnózu IBD před 30. rokem života [6,7]. Z tohoto důvodu také plyne význam miniinvazivity při chirurgické léčbě a dosažení maximálního kosmetického efektu.
V současnosti však má i při možnostech imunosupresiv a zvláště éry biologické terapie chirurgická léčba IBD stále významnou a nezastupitelnou roli. Zhruba 70–80 % pacientů s CD podstoupí alespoň jedno operační řešení během svého života pro tuto diagnózu [8–10]. U pacientů s UC se toto procento pohybuje v rozmezí 10–20 % [11,12] a některé studie uvádějí až 30% riziko prodělání operace během života pro UC [13–15].
Indikace k chirurgické léčbě u pacientů s CD
Indikace k operaci u pacientů s CD můžeme rozdělit na akutní a elektivní. Mezi akutní indikace patří perforace, krvácení, akutní těžká kolitida (ATK) a akutní porucha pasáže. Perforace do volné dutiny břišní je velmi vzácnou komplikací CD a je vzhledem k rozvoji peritonitidy indikací k akutní operaci [16,17]. Masivní krvácení u pacientů s CD se objevuje také relativně vzácně, uvádí se v rozmezí 0–6 % [18–20]. Další indikací k akutní operaci je ATK u CD při nereagující konzervativní terapii a horšení klinického stavu pacienta [21,22]. Akutní střevní obstrukce vzniká u CD nejčastěji na podkladě zánětu. Snahou je tyto pacienty léčit primárně konzervativně. Symptomatičtí pacienti, které však nelze zvládnout konzervativní léčbou, jsou indikováni k operační revizi [23]. Tito pacienti jsou vystaveni vyššímu riziku vícedobého operačního řešení s primárním založením stomie.
Elektivní operační řešení je indikováno u symptomatických pacientů při nedostatečné odpovědi na konzervativní léčbu či její intoleranci [24]. U pacientů s lokalizovanou CD (např. chronická stenóza či píštěl) připadá v úvahu resekční výkon [25]. V ileocekální oblasti je resekční chirurgický výkon jako metoda první volby u symptomatické stenózy bez předchozí medikamentózní terapie. U stenózy pod 10 cm a bez přítomnosti zánětu stěny je možno provést strikturoplastiku, nejčastěji dle Heineke-Mickulicz [26–28]. U pacientů se zánětlivým pseudotumorem, abscesy či fistulacemi je doporučováno zánětlivý proces zklidnit bowel restem, parenterální výživou, antibiotickou terapií a event. punkcí abscesového ložiska pod ultrazvukem či CT navigovanou kontrolou. Definitivní operační řešení poté plánujeme ve shodě s doporučením ECCO odloženě (ECCO Statement 7B) [29]. Pokud dojde k selhání tohoto postupu, jsme nuceni přistoupit k akutní chirurgické drenáži či resekčnímu výkonu [30–32]. Tyto výkony jsou zatíženy vyšší morbiditou a je doporučeno provádět vícedobé operační výkony. Další indikací k chirurgickému výkonu je malignita v terénu CD nebo podezření na ni. Pacienti s těžkým perianálním postižením, nereagující na konzervativní a chirurgickou léčbu, jsou indikováni k odklonění pasáže založením laparoskopické derivační stomie (ECCO Statement 9M) [23,29].
Jednotlivé chirurgické výkony jsou samozřejmě závislé na lokalizaci CD (oblast ileocekálního přechodu, kolon, perianální fistulující forma CD atd.) a od ní se také odvíjí operační přístup a technika.
Indikace k chirurgické léčbě u pacientů s UC
Podobně jako u CD je základní dělení operací u pacientů s UC na akutní a plánované.
Nejčastější akutní indikací k operačnímu řešení je ATK při selhání či nedostatečnosti konzervativní terapie [33]. ATK postihuje asi 18 % nemocných s UC [34]. Zhruba u 5 % hospitalizovaných pacientů může ATK progredovat do toxického megakolon [35]. Další indikace, které mohou, ale také nemusí souviset s ATK, jsou masivní krvácení (tvoří asi 10 % urgentních kolektomií) a perforace tračníku u 2 % pacientů s UC, často vznikající na podkladě toxického megakolon [33,36].
Indikace k elektivnímu operačnímu řešení je chronická refrakterní UC při neefektivní konzervativní terapii [37] a vznik dysplazie či kolorektálního karcinomu (CRC – colorectal cancer). Kumulativní riziko vzniku CRC narůstá s délkou onemocnění, a to 2 % po 10 letech, 8 % po 20 letech a 18 % po 30 letech trvání UC [38].
Miniinvazivní přístupy v chirurgické léčbě CD
Laparoskopie je dnes již přijímána jako preferovaná metoda u většiny elektivních chirurgických výkonů. Výhody laparoskopie oproti konvenční chirurgii jsou potvrzeny mnoha studiemi. Mezi již obecně uznávané výhody laparoskopie u pacientů s CD patří dřívější obnovení peristaltiky, kratší doba hospitalizace a nižší pooperační morbidita [39–41]. Dále byla prokázána časnější pooperační rekonvalescence [42], lepší kosmetický efekt [43] (obr. 1) a také nižší výskyt vzniku incizionálních hernií [44]. Menší vnímání pooperační bolesti a následně také nižší spotřeba analgetik je popisována u laparoskopické kolorektální chirurgie, nicméně u pacientů s CD nebyl tento přínos ve srovnání s klasickou chirurgií jednoznačně potvrzen [40,42]. Velká výhoda laparoskopie a nově zaváděných miniinvazivních výkonů oproti otevřené chirurgii spočívá také v nižší tendenci tvoření pooperačních srůstů [45]. Následující operace v budoucnu pro pacienta s CD, který vyžaduje reoperaci pro recidivu choroby, je tak lépe technicky proveditelná.
Většina těchto výhod je zatím spíše prokázána u nekomplikované CD a elek-tivních primárních výkonů. U elektivní primární ileocekální resekce pro nekomplikovanou CD je doporučeno provádět výkon laparoskopicky (ECCO Statement 7F) [29,46,42,47] (obr. 2A a 2B). Laparoskopická technika je také doporučena k založení derivační stomie [48].
Jednou z mála nevýhod laparoskopického přístupu je delší operační čas výkonu [40,45]. U erudovaných chirurgů v laparoskopické kolorektální chirurgii se ale operační časy v posledních letech srovnávají.
Zatímco u nepenetrující CD jsou jasně prokázány lepší pooperační výsledky u laparoskopického přístupu, u komplexní neboli komplikované CD (absces, fistula, rekurence nemoci) tak přesvědčivé výsledky nejsou. Přesto řada studií dokládá, že laparoskopie i u komplikované CD se jeví jako možná a bezpečná [47,49]. Pacienty s komplexní formou CD je doporučeno operovat ve specializovaných centrech zabývajících se problematikou IBD a výkon provádět zkušeným operatérem [49,50].
Diskutována je otázka chirurgického přístupu u akutních výkonů. U nejasné příčiny akutního stavu pacientů s CD může být laparoskopie indikována k ověření přesné diagnózy, při příznivém lokálním nálezu muže být příčina akutního stavu laparoskopicky vyřešena, a může tak zabránit vzniku zbytečně rozsáhlé laparotomie [51]. Za nevýhodu je považován delší operační čas, který u pacientů v celkově špatném stavu zvyšuje morbiditu [45,52,53]. U pacientů s CD při akutní operaci, zvláště pro peritonitidu a při oběhové nestabilitě a špatném nutričním stavu, by mělo být zváženo vyvedení dočasné terminální či axiální ileostomie [16,54].
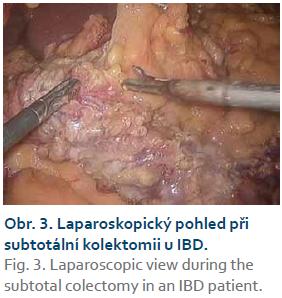
Doporučený operační výkon u ATK u CD nereagující na konzervativní terapii je subtotální kolektomie s terminální ileostomií a slepým uzávěrem pahýlu rekta [21,22]. Laparoskopický přístup u ATK (obr. 3) má srovnatelné nebo dle některých studií i mírně lepší pooperační výsledky než chirurgie otevřená [47]. Hlavní výhodou je nižší výskyt srůstů při dalším operačním obnovení kontinuity.
Malignita v terénu CD i podezření na ni jsou indikací k chirurgickému výkonu. U této indikace je však nutné operovat dle onkologických zásad, tedy s konceptem kompletní mezokolické excize [55].
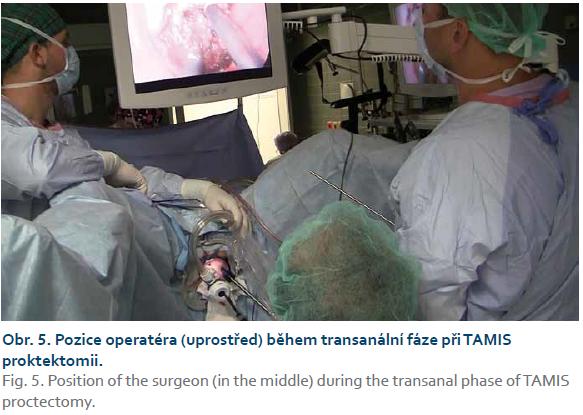
TAMIS (transanal minimally invasive surgery) je relativně nová miniinvazivní technika využívající speciální transanální port (obr. 4). Je to velmi vhodná metoda např. k provedení proktektomie. Operace se skládá jednak z fáze transanální (obr. 5), využívající port pro TAMIS, a jednak z fáze transabdominální (využívající standardních laparoskopických portů, nástrojů a optiky). Výhody této metody jsou v podstatě shodné jako u operací pro UC, které jsou rozebrány níže v textu.
SILS (single incision laparoscopic surgery) je jedna z možností miniinvazivních chirurgických přístupů. Jednou incizí je zaveden speciální laparoskopický port, který má více vstupů, umožňující zavedení více nástrojů do dutiny břišní z jednoho portu, a operaci je tak možné provést z jediné incize. Tuto alternativu provádějí však jen některá pracoviště a metoda není příliš rozšířená. Výhodou je jistě dobrý kosmetický efekt, na druhou stranu je výkon technicky náročný a vyžaduje delší čas operačního výkonu [56–58]. Metodou SILS se na pracovištích, kde je tato metoda preferována v rámci miniinvazivních přístupů, mohou provádět laparoskopické resekce na tenkém střevě i na tračníku. V současnosti v ČR není SILS standardem pro kolorektální operační výkony.
Stejně tak robotická chirurgie není zcela jednoznačným přínosem pro miniinvazivní IBD operativu vzhledem k tomu, že resekční výkony nedoplňujeme o lymfadenektomii ani neprovádíme náročné radikální onkologické resekce. Shodně v případě provedení proktektomie neprovádíme obtížnou mezorektální excizi, kde může být robotický přístup určitou výhodou.
Miniinvazivní přístupy v chirurgické léčbě UC
Uplynulo již více než 30 let, kdy Parks et al [59] publikovali operační postup proktokolektomie s obnovením kontinuity formou ileopouch-anální anastomózy (IPAA). Tento výkon se stal standardem v chirurgické léčbě UC [60]. V současnosti a v době rozvoje kolorektální laparoskopické chirurgie se provádí i laparoskopické či laparoskopicky asistované proktokolektomie s IPAA.
Výhody při užití laparoskopie, jak jsou již zmíněny výše u CD, platí obdobně i u pacientů s UC. U elektivních výkonů mezi ně patří hlavně snížená délka hospitalizace, nižší pooperační morbidita a lepší výsledný kosmetický efekt (ECCO Statement 5A) [61–66].
U klasicky provedené proktokolektomie s IPAA se uvádí až trojnásobné zvýšení rizika sterility [67–69]. Za důvod je považován vznik pooperačních srůstů, které zapříčiní tubární sterilitu [70]. Za jednu z hlavních výhod laparoskopické proktokolektomie s IPAA jsou tak považovány dobré výsledky stran zachování plodnosti u žen s UC. Význam se připisuje hlavně nižší tendenci vzniku pooperačních srůstů po laparoskopickém výkonu [15,70]. Nevýhodou u laparoskopicky prováděného výkonu zůstává delší operační čas [65].
U urgentních operací pro UC je v dnešní době preferována subtotální kolektomie s terminální ileostomií a zaslepením pahýlu rekta [33]. U akutních výkonů u pacientů s UC byly zaznamenány tyto benefity při užití laparoskopické techniky: kratší doba hospitalizace, nižší počet infekčních komplikací ran a intraabdominálních abscesů. Srovnatelná s otevřenou chirurgií byla incidence pooperačního ileu a krvácení [15,71–73]. Pokud je akutní kolektomie prováděna na specializovaném pracovišti zkušeným chirurgem, je dle doporučení ECCO preferován laparoskopický přistup (ECCO statement 5C) [61].
U etapového operačního přístupu má také laparoskopie své výhody, a to zvláště po laparoskopické subtotální kolektomii s terminální ileostomií. Následná rekonstrukční fáze je prováděna snáze, jelikož je operační terén téměř bez srůstů, a je tak i relativně nízké riziko konverze [64,74]. K dokončení proktektomie či resekci rekta je také možné s výhodou použít metodu TAMIS postupem transanálně „down to top“ (obr. 4 a 5). Zejména z ní mohou těžit pacienti s rizikovými faktory, jako jsou mužské pohlaví, úzká pánev a obezita. Lze se tak vyhnout rozsáhlé laparotomii, která je nutná při otevřeném výkonu. Laparoskopicky je možné precizněji preparovat a zachovat tak nervové pleteně ovlivňující sexuální funkce nebo omezit vznik adhezí majících následně vliv na plodnost u žen. Studie s početnějším souborem pacientů však zatím nejsou k dispozici. Metodu TAMIS lze užít u pacientů s UC i z onkologické indikace. Pokud jsou pacienti s UC indikováni k proktokolektomii z důvodu dysplazie či CRC, musí být výkon proveden dle onkochirurgických zásad a s dostatečnou radikalitou, tedy s provedením lymfadenektomie a totální mezorektální excizí (ECCO Statement 9A) [61,75].
Provedení subtotální kolektomie s ileostomií u pacientů s UC je možné také pomocí metody SILS [76]. Pooperační výsledky jsou obdobné jako u pacientů s CD zmíněnými výše. V roce 2010 Geisler et al [77] poprvé provedli restorativní proktokolektomie s IPAA technikou SILS s dobrými pooperačními výsledky. K porovnání metody jsou však zatím jen omezená data a chybí studie s dostatečným souborem pacientů.
Do robotické chirurgie byla vkládána relativně velká očekávání, a to zvláště do náročných výkonů jako IPAA u pacientů s UC. Zatím dostupné studie však ukázaly jen výrazně delší operační čas a cenovou náročnost se stejnou hospitalizační dobou a stejným procentem pooperačních komplikací v porovnání se standardní laparoskopickou chirurgií [15,78]. Velká očekávání tedy tato metoda nesplnila.
Vliv chirurgické léčby na kvalitu života u pacientů s IBD
Řada studií prokázala sníženou kvalitu života (QoL – quality of life) u pacientů s IBD v porovnání se zdravou populací [79–82]. U pacientů s CD prokázaly některé studie krátkodobé zlepšení QoL po operaci [83,84], nicméně s delším časovým odstupem od operace se QoL vrací u pacienta k původním hodnotám [85,86]. Studie u pacientů s CD porovnávající QoL po laparoskopickém výkonu oproti otevřené chirurgii překvapivě nezaznamenaly signifikantní zlepšení dlouhodobé QoL při užití laparoskopické metody [86,87].
QoL u pacientů s UC po proktokolektomii s IPAA je uváděna jako dostatečná, ačkoli výkon bývá relativně často spojen s pooperačními komplikacemi a také s horším kosmetickým efektem [60,88]. Pooperační QoL u pacientů s UC při užití laparoskopické techniky v porovnání s otevřenou chirurgií se zdá být rovnocenná [89–91]. Nejdůležitějším faktorem majícím vliv na QoL u pacientů s IBD se jeví navození dlouhodobé remise onemocnění [80,82,92].
Závěr
U primární ileocekální resekce pro nekomplikovanou stenózu u CD jsou prokázány výhody laparoskopické resekce a je také doporučována. U komplexní CD je laparoskopie možná a ukazuje se i jako bezpečná metoda v rukou zkušeného chirurga na specializovaném pracovišti. Provedení laparoskopické subtotální kolektomie pro ATK u CD či UC v akutním stadiu se jeví také jako možná a bezpečná, pokud je provedena zkušeným laparoskopickým kolorektálním chirurgem. V případě UC byly prokázány i lepší krátkodobé pooperační výsledky a je některými chirurgy preferována. Mezi hlavní výhody laparoskopie a nově zaváděných miniinvazivních výkonů u pacientů s IBD oproti chirurgii otevřené patří zejména dřívější obnovení peristaltiky, kratší doba hospitalizace, nižší pooperační morbidita a lepší kosmetický efekt. Velkou výhodou hlavně u restorativních výkonů u UC nebo u pacientů s CD, u kterých existuje možnost reoperace pro recidivu v budoucnu, je nižší tendence k tvorbě srůstů. Následující operace je tedy o to snadněji proveditelná. U laparoskopické proktokolektomie s IPAA pro UC byla zaznamenána vyšší plodnost u žen ve srovnání s konvenčním přístupem. Benefit laparoskopie v porovnání s otevřenou chirurgií na celkovou pooperační QoL nebyl jednoznačně prokázán.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 10. 1. 2017
Přijato/Accepted: 24. 1. 2017
MUDr. Lumír Kunovský
Interní gastroenterologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
kunovsky.lumir@fnbrno.cz



Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Molodecky NA, Soon IS, Rabi DM et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology 2012; 142 (1): 46–54. doi: 10.1053/j.gastro.2011.10.001.
2. Wilson J, Hair C, Knight R et al. High incidence of inflammatory bowel disease in Australia: a prospective population-based Australian incidence study. Inflamm Bowel Dis 2010; 16 (9): 1550–1556. doi: 10.1002/ ibd.21209.
3. Nørgård BM, Nielsen J, Fonager K et al. The incidence of ulcerative colitis (1995–2011) and Crohn’s disease (1995–2012) – based on nationwide Danish registry data. J Crohns Colitis 2014; 8 (10): 1274–1280. doi: 10.1016/j.crohns.2014.03.006.
4. Vegh Z, Burisch J, Pedersen N et al. Incidence and initial disease course of inflammatory bowel diseases in 2011 in Europe and Australia: Results of the 2011 ECCO-EpiCom inception cohort. J Crohns Colitis 2014; 8 (11): 1506–1515. doi: 10.1016/j.crohns.2014.06.004.
5. Kunovský L, Hemmelová B, Kala Z et al. Crohn disease and pregnancy: a case report of an acute abdomen. Int J Colorectal Dis 2016; 31 (8): 1493–1494. doi: 10.1007/s00384-016-2554-1.
6. Pedersen N, Bortoli A, Duricova D et al. The course of inflammatory bowel disease during pregnancy and postpartum: a prospective European ECCO-EpiCom Study of 209 pregnant women. Aliment Pharmacol Ther 2013; 38 (5): 501–512. doi: 10.1111/apt.12412.
7. Julsgaard M, Nørgaard M, Hvas CL et al. Influence of medical treatment, smoking and disease activity on pregnancy outcomes in Crohn’s disease. Scand J Gastroenterol 2014; 49 (3): 302–308. doi: 10.3109/ 00365521.2013.879200.
8. Aratari A, Papi C, Leandro G et al. Early versus late surgery for ileo-caecal Crohn’s disease. Aliment Pharmacol Ther 2007; 26 (10): 1303–1312.
9. De Cruz P, Kamm MA, Hamilton AL et al. Crohn’s disease management after intestinal resection: a randomised trial. The Lancet 2015; 385 (9976): 1406–1417. doi: 10.1016/S0140-6736 (14) 61908-5.
10. Fornaro R, Caratto E, Caratto M et al. Post-operative recurrence in Crohn’s disease. Critical analysis of potential risk factors. An update. The Surgeon 2015; 13 (6): 330–347. doi: 10.1016/j.surge.2015.04. 002.
11. Targownik LE, Singh H, Nugent Z et al. The epidemiology of colectomy in ulcerative colitis: results from a population-based cohort. Am J Gastroenterol 2012; 107 (8): 1228–1235. doi: 10.1038/ajg.2012.127.
12. Bernstein CN, Ng SC, Lakatos PL et al. A review of mortality and surgery in ulcerative colitis: milestones of the seriousness of the disease. Inflamm Bowel Dis 2013; 19 (9): 2001–2010. doi: 10.1097/MIB. 0b013e318281f3bb.
13. Cosnes J, Gower-Rousseau C, Seksik P et al. Epidemiology and natural history of inflammatory bowel diseases. Gastroenterology 2011; 140 (6): 1785–1794. doi: 10.1053/j.gastro.2011.01.055.
14. Filippi J, Allen PB, Hébuterne X et al. Does anti-TNF therapy reduce the requirement for surgery in ulcerative colitis? A systematic review. Curr Drug Targets 2011; 12 (10): 1440–1447.
15. Buskens CJ, Sahami S, Tanis PJ et al. The potential benefits and disadvantages of laparoscopic surgery for ulcerative colitis: a review of current evidence. Best Pract Res Clin Gastroenterol 2014; 28 (1): 19–27. doi: 10.1016/j.bpg.2013.11.007.
16. Ikeuchi H, Yamamura T. Free perforation in Crohn’s disease: review of the Japanese literature. J Gastroenterol 2002; 37 (12): 1020–1027.
17. Veroux M, Angriman I, Ruffolo C et al. A rare surgical complication of Crohn’s diseases: free peritoneal perforation. Minerva Chir 2003; 58 (3): 351–354.
18. Pardi DS, Loftus EV, Tremaine WJ et al. Acute major gastrointestinal hemorrhage in inflammatory bowel disease. Gastrointest Endosc 1999; 49 (2): 153–157.
19. Veroux M, Angriman I, Ruffolo C et al. Severe gastrointestinal bleeding in Crohn’s disease. Ann Ital Chir 2003; 74 (2): 213–215.
20. Kostka R, Lukáš M. Massive, life-threatening bleeding in Crohn’s disease. Acta Chir Belg 2005; 105 (2): 168–174.
21. Hyman NH, Cataldo P, Osler T. Urgent subtotal colectomy for severe inflammatory bowel disease. Dis Colon Rectum 2005; 48 (1): 70–73.
22. Stewart D, Chao A, Kodner I et al. Subtotal colectomy for toxic and fulminant colitis in the era of immunosuppressive therapy. Colorectal Dis 2009; 11 (2): 184–190. doi: 10.1111/j.1463-1318.2008.01579.x.
23. Šerclová Z, Ryska O, Bortlík M et al. Doporučené postupy chirurgické léčby pacientů s idiopatickými střevními záněty – 2. část: Crohnova nemoc. Gastroenterol Hepatol 2015; 69 (3): 223–238. doi: 10.14735/amgh2015223.
24. Lazarev M, Ullman T, Schraut WH et al. Small bowel resection rates in Crohn’s disease and the indication for surgery over time: experience from a large tertiary care center. Inflamm Bowel Dis 2010; 16 (5): 830–835. doi: 10.1002/ibd.21118.
25. Poritz LS, Gagliano GA, McLeod RS et al. Surgical management of entero and colocutaneous fistulae in Crohn’s disease: 17 year’s experience. Int J Colorectal Dis 2004; 19 (5): 481–485.
26. Tichansky D, Cagir B, Yoo E et al. Strictureplasty for Crohn’s disease: meta-analysis. Dis Colon Rectum 2000; 43 (7): 911–919.
27. Yamamoto T, Fazio VW, Tekkis PP. Safety and efficacy of strictureplasty for Crohn’s disease: a systematic review and meta-analysis. Dis Colon Rectum 2007; 50 (11): 1968–1986.
28. Kala Z, Marek F, Válek V el al. Crohn’s disease surgery. Vnitr Lek 2014; 60 (7–8): 617–623.
29. Gionchetti P, Dignass A, Danese S et al. 3rd European evidence-based consensus on the diagnosis and management of Crohn’s disease 2016: part 2: Surgical management and special situations. J Crohns Colitis 2016; 11 (2): 135–149.
30. Feagins LA, Holubar SD, Kane SV et al. Current strategies in the management of intra-abdominal abscesses in Crohn’s disease. Clin Gastroenterol Hepatol 2011; 9 (10): 842–850. doi: 10.1016/j.cgh.2011.04.023.
31. Xie Y, Zhu W, Li N et al. The outcome of initial percutaneous drainage versus surgical drainage for intra-abdominal abscesses in Crohn’s disease. Int J Colorectal Dis 2012; 27 (2): 199–206. doi: 10.1007/s00384-011-1338-x.
32. de Groof EJ, Carbonnel F, Buskens CJ et al. Abdominal abscess in Crohn’s dis-ease: multidisciplinary management. Dig Dis 2014; 32 (Suppl 1): 103–109. doi: 10. 1159/000367859.
33. Šerclová Z, Ryska O, Bortlík M et al. Doporučené postupy chirurgické léčby pacientů s idiopatickými střevními záněty – 3. část: ulcerózní kolitida, indikace k operaci. Gastroenterol Hepatol 2016; 70 (3): 252–261. doi: 10.14735/amgh2015252.
34. Dignass A, Lindsay JO, Sturm A et al. Second european evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: current management. J Crohns Colitis 2012; 6 (10): 991–1030. doi: 10.1016/j.crohns.2012.09.002.
35. Gan SI, Beck PL. A new look at toxic megacolon: an update and review of incidence, etiology, pathogenesis, and management. Am J Gastroenterol 2003; 98 (11): 2363–2371.
36. Berg DF, Bahadursingh AM, Kaminski DL et al. Acute surgical emergencies in inflammatory bowel disease. Am J Surg 2002; 184 (1): 45–51.
37. Ross H, Steele SR, Varma M et al. Practice parameters for the surgical treatment of ulcerative colitis. Dis Colon Rectum 2014; 57 (1): 5–22. doi: 10.1097/DCR.0000000000000030.
38. Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut 2001; 48 (4): 526–535.
39. Tilney HS, Constantinides VA, Heriot AG et al. Comparison of laparoscopic and open ileocecal resection for Crohn’s disease: a metaanalysis. Surg Endosc 2006; 20 (7): 1036–1044.
40. Maartense S, Dunker MS, Slors JF et al. Laparoscopic-assisted versus open ileocolic resection for Crohn’s disease. Ann Surg 2006; 243 (2): 143–149.
41. Lesperance K, Martin MJ, Lehmann R et al. National trends and outcomes for the surgical therapy of ileocolonic Crohn’s disease: a population-based analysis of laparoscopic vs. open approaches. J Gastro-intest Surg 2009; 13 (7): 1251–1259. doi: 10.1007/s11605-009-0853-3.
42. Makni A, Chebbi F, Ksantini R et al. Laparoscopic-assisted versus conventional ileocolectomy for primary Crohn’s disease: results of a comparative study. J Visc Surg 2013; 150 (2): 137–143. doi: 10.1016/j.jviscsurg.2012.10.006.
43. Shore G, Gonzalez QH, Bondora A et al. Laparoscopic vs conventional ileocolectomy for primary Crohn disease. Arch Surg 2003; 138 (1): 76–79.
44. Duepree H-J, Senagore AJ, Delaney CP et al. Does means of access affect the incidence of small bowel obstruction and ventral hernia after bowel resection? Laparoscopy versus laparotomy. J Am Coll Surg 2003; 197 (2): 177–181.
45. Antoniou SA, Antoniou GA, Koch OO et al. Is laparoscopic ileocecal resection a safe option for Crohn’s disease? Best evidence topic. Int J Surg 2014; 12 (1): 22–25. doi: 10.1016/j.ijsu.2013.11.003.
46. Lee Y, Fleming FJ, Deeb AP et al. A laparoscopic approach reduces short-term complications and length of stay following ileocolic resection in Crohn’s disease: an analysis of outcomes from the NSQIP database. Colorectal Dis 2012; 14 (5): 572–577. doi: 10.1111/j.1463-1318.2011.02756.x.
47. Maggiori L, Panis Y. Laparoscopy in Crohn’s disease. Best Pract Res Clin Gastroenterol 2014; 28 (1): 183–194. doi: 10.1016/ j.bpg.2013.11.004.
48. Örhalmi J, Dušek T, Šerclová Z et al. Minimally invasive surgery in the treatment of inflammatory bowel disease – benefits, risks and perspectives. Gastroenterol Hepatol 2016; 70 (1): 57–60. doi: 10.14735/amgh201657.
49. Tavernier M, Lebreton G, Alves A. Laparoscopic surgery for complex Crohn’s disease. J Visc Surg 2013; 150 (6): 389–393. doi: 10.1016/j.jviscsurg.2013.09.004.
50. Lim JY, Kim J, Nguyen SQ. Laparoscopic surgery in the management of Crohn’s disease. World J Gastrointest Pathophysiol 2014; 5 (3): 200–204. doi: 10.4291/wjgp.v5.i3.200.
51. Sauerland S, Agresta F, Bergamaschi R et al. Laparoscopy for abdominal emergencies. Surg Endosc Interv Tech 2006; 20 (1): 14–29.
52. Agresta F, Ciardo LF, Mazzarolo G et al. Peritonitis: laparoscopic approach. World J Emerg Surg 2006; 1: 9.
53. Tan JJ, Tjandra JJ. Laparoscopic surgery for Crohn’s disease: a meta-analysis. Dis Colon Rectum 2007; 50 (5): 576–585.
54. Parray FQ, Wani ML, Bijli AH et al. Crohn’s disease: a surgeon’s perspective. Saudi J Gastroenterol 2011; 17 (1): 6–15. doi: 10.4103/1319-3767.74430.
55. Procházka V, Zetelová A, Grolich T et al. Kompletní mezokolická excize u pravostranné hemikolektomie. Rozhl Chir 2016; 95 (10): 359–364.
56. Gardenbroek TJ, Verlaan T, Tanis PJ et al. Single-port versus multiport laparoscopic ileocecal resection for Crohn’s disease. J Crohns Colitis 2013; 7 (10): 443–448. doi: 10.1016/j.crohns.2013.02.015.
57. Moftah M, Nazour F, Cunningham M et al. Single port laparoscopic surgery for patients with complex and recurrent Crohn’s disease. J Crohns Colitis 2014; 8 (9): 1055–1061. doi: 10.1016/j.crohns. 2014.02.003.
58. Sangster W, Messaris E, Berg AS et al. Single-site laparoscopic colorectal surgery provides similar clinical outcomes compared to standard laparoscopic surgery: an analysis of 626 patients. Dis Colon Rectum 2015; 58 (9): 862–869. doi: 10.1097/DCR.0000000000000435.
59. Parks AG, Nicholls RJ. Proctocolectomy without ileostomy for ulcerative colitis. Br Med J 1978; 2 (6130): 85–88.
60. Hata K, Kazama S, Nozawa H et al. Laparoscopic surgery for ulcerative colitis: a review of the literature. Surg Today 2015; 45 (8): 933–938. doi: 10.1007/s00595-014-1053-7.
61. Øresland T, Bemelman WA, Sampietro GM et al. European evidence based consensus on surgery for ulcerative colitis. J Crohns Colitis 2015; 9 (1): 4–25. doi: 10.1016/j.crohns.2014.08.012.
62. Polle SW, Dunker MS, Slors JF et al. Body image, cosmesis, quality of life, and functional outcome of hand-assisted laparoscopic versus open restorative proctocolectomy: long-term results of a randomized trial. Surg Endosc 2007; 21 (8): 1301–1307.
63. Wu XJ, He XS, Zhou XY et al. The role of laparoscopic surgery for ulcerative colitis: systematic review with meta-analysis. Int J Colorectal Dis 2010; 25 (8): 949–957. doi: 10.1007/s00384-010-0898-5.
64. Fleming FJ, Francone TD, Kim MJ et al. A laparoscopic approach does reduce short-term complications in patients undergoing ileal pouch-anal anastomosis. Dis Colon Rectum 2011; 54 (2): 176–182. doi: 10.1007/DCR.0b013e3181fb4232.
65. Maggiori L, Panis Y. Surgical management of IBD – from an open to a laparoscopic approach. Nat Rev Gastroenterol Hepatol 2013; 10 (5): 297–306. doi: 10.1038/nrgastro.2013.30.
66. Fajardo AD, Dharmarajan S, George V et al. Laparoscopicversus open 2-stage ileal pouch: laparoscopic approach allows for faster restoration of intestinal continuity. J Am Coll Surg 2010; 211 (3): 377–383. doi: 10.1016/j.jamcollsurg.2010.05.018.
67. Waljee A, Waljee J, Morris AM et al. Threefold increased risk of infertility: a meta-analysis of infertility after ileal pouch anal anastomosis in ulcerative colitis. Gut 2006; 55 (11): 1575–1580.
68. Rajaratnam SG, Eglinton TW, Hider P et al. Impact of ileal pouch-anal anastomosis on female fertility: meta-analysis and systematic review. Int J Colorectal Dis 2011; 26 (11): 1365–1374. doi: 10.1007/s00384-011-1274-9.
69. Cornish JA, Tan E, Teare J et al. The effect of restorative proctocolectomy on sexual function, urinary function, fertility, pregnancy and delivery: a systematic review. Dis Colon Rectum 2007; 50 (8): 1128–1138.
70. Bartels SAL, D’Hoore A, Cuesta MA et al. Significantly increased pregnancy rates after laparoscopic restorative proctocolectomy: a cross-sectional study. Ann Surg 2012; 256 (6): 1045–1048. doi: 10.1097/SLA.0b013e318250caa9.
71. Watanabe K, Funayama Y, Fukushima K et al. Hand-assisted laparoscopic vs. open subtotal colectomy for severe ulcerative colitis. Dis Colon Rectum 2009; 52 (4): 640–645. doi: 10.1007/DCR.0b013e 31819d47b5.
72. Bartels SL, Gardenbroek TJ, Ubbink DT et al. Systematic review and meta-analysis of laparoscopic versus open colectomy with end ileostomy for non-toxic colitis. Br J Surg 2013; 100 (6): 726–733. doi: 10.1002/bjs.9061.
73. Gu J, Stocchi L, Remzi FH et al. Total abdominal colectomy for severe ulcerative colitis: does the laparoscopic approach really have benefit? Surg Endosc 2014; 28 (2): 617–625. doi: 10.1007/s00464-013-3218-7.
74. Pandey S, Luther G, Umanskiy K et al. Minimally invasive pouch surgery for ulcerative colitis: is there a benefit in staging? Dis Colon Rectum 2011; 54 (3): 306–310. doi: 10.1007/DCR.0b013e31820347b4.
75. Farraye FA, Odze RD, Eaden J et al. AGA medical position statement on the diagnosis and management of colorectal neoplasia in inflammatory bowel disease. Gastroenterology 2010; 138 (2): 738–745. doi: 10.1053/j.gastro.2009.12.037.
76. Chatzizacharias NA, Torrente F, Brennan M et al. Single port laparoscopic subtotal colectomy and ileostomy in an adolescent with ulcerative colitis. J Crohns Colitis 2012; 6 (10): 1031–1033. doi: 10.1016/j.crohns.2012.03.011.
77. Geisler DP, Condon ET, Remzi FH. Single incision laparoscopic total proctocolectomy with ileopouch anal anastomosis. Colorectal Dis 2010; 12 (9): 941–943. doi: 10.1111/j.1463-1318.2009.02115.x.
78. Fung AK, Aly EH. Robotic colonic surgery: is it advisable to commence a new learning curve? Dis Colon Rectum 2013; 56 (6): 786–796. doi: 10.1097/DCR.0b013e 318285b810.
79. Mikocka-Walus AA, Turnbull DA, Andrews JM et al. Psychological problems in gastroenterology outpatients: a South Australian experience. Psychological co-morbidity in IBD, IBS and hepatitis C. Clin Pract Epidemiol Ment Health 2008; 4: 15. doi: 10.1186/1745-0179-4-15.
80. Gavrilescu O, Mihai C, Anton-Paduraru DT et al. Impact of inflammatory bowel diseases on quality of life. Revista de Cercetare si Interventie Sociala 2015; 50: 80–95.
81. Love JR, Irvine EJ, Fedorak RN. Quality of life in inflammatory bowel disease. J Clin Gastroenterol 1992; 14 (1): 15–19.
82. Casellas F, López-Vivancos J, Badia X et al. Impact of surgery for Crohn’s disease on health-related quality of life. Am J Gastroenterol 2000; 95 (1): 177–182.
83. Delaney CP, Kiran RP, Senagore AJ et al. Quality of life improves within 30 days of surgery for Crohn’s disease. J Am Coll Surg 2003; 196 (5): 714–721.
84. Kunovský L, Kala Z, Mitáš L et al. Quality of life after bowel resection for Crohn’s disease – first results. Rozhl Chir 2016; 95 (12): 444–448.
85. Cohen RD. The quality of life in patients with Crohn’s disease. Aliment Pharmacol Ther 2002; 16 (9): 1603–1609.
86. Thaler K, Dinnewitzer A, Oberwalder M et al. Assessment of long-term quality of life after laparoscopic and open surgery for Crohn’s disease. Colorectal Dis 2005; 7 (4): 375–381.
87. Scarpa M, Ruffolo C, Bassi D et al. Intestinal surgery for Crohn’s disease: predictors of recovery, quality of life, and costs. J Gastrointest Surg 2009; 13 (12): 2128–2135. doi: 10.1007/s11605-009-1044-y.
88. Wexner SD, Cera SM. Laparoscopic surgery for ulcerative colitis. Surg Clin North Am 2005; 85 (1): 35–47.
89. Maartense S, Dunker MS, Slors JF et al. Hand-assisted laparoscopic versus open restorative proctocolectomy with ileal pouch anal anastomosis. Ann Surg 2004; 240 (6): 984–991.
90. Larson DW, Dozois EJ, Piotrowicz K et al. Laparoscopic-assisted vs. open ileal pouch-anal anastomosis: functional outcome in a case-matched series. Dis Colon Rectum 2005; 48 (10): 1845–1850.
91. Ahmed Ali U, Keus F, Heikens JT et al. Open versus laparoscopic (assisted) ileo pouch anal anastomosis for ulcerative colitis and familial adenomatous polyposis. Cochrane Database Syst Rev 2009; 1: CD006267. doi: 10.1002/14651858.CD006267.pub2.
92. Lix LM, Graff LA, Walker JR et al. Longitudinal study of quality of life and psychological functioning for active, fluctu-ating, and inactive disease patterns in inflammatory bowel disease. Inflamm Bowel Dis 2008; 14 (11): 1575–1584. doi: 10.1002/ibd.20511.