Léčba jaterních metastáz kolorektálního karcinomu
Jiří Pudil Orcid.org 1, Stanislav Batko2, Kateřina Menclová3, Michael Rousek3, Miroslav Ryska4
+ Pracoviště
Souhrn
Úvod: U 60 % nemocných s kolorektálním karcinomem jsou diagnostikovány jaterní metastázy (JMKRK), ať už v době stanovení diagnózy nebo v průběhu léčby. Chirurgická léčba je nejdůležitější metodou léčby s 5letým přežíváním dosahujícím cca 50 %. Jaterní resekci však podstoupí méně než 20 % pacientů s JMKRK. Systémová léčba umožňuje u primárně neresekabilních pacientů resekční výkon, u jiných pacientů významně prodlužuje celkové přežívání. Stanovení léčebné strategie vychází z rozhodnutí multidisciplinárního týmu. Chirurgická léčba: Autoři definují technické i onkologické aspekty resekability, problematiku velikosti zbytkového jaterního parenchymu a možnosti jeho navýšení. Zmiňují možnosti chirurgické léčby – typy resekcí, víceetapové výkony, liver first approach či radiofrekvenční ablaci. Systémová léčba: Zaznamenává dynamický rozvoj, zmíněny jsou současné možnosti chemoterapie i biologické léčby, dále indikace k perioperační léčbě u resekabilních nálezů a konverzní terapii u primárně neresekabilních nálezů. Závěr: I přes pokroky v systémové léčbě představuje jaterní resekce jedinou potenciálně kurabilní metodu léčby JMKRK. Úzká spolupráce mezi chirurgy erudovanými v chirurgii jater a klinickými onkology v multidisciplinárních týmech je podmínkou navýšení resekability u pacientů s JMKRK.
Klíčová slova
jaterní metastázy, kolorektální karcinom, resekce jater, systémová léčbaÚvod
Kolorektální karcinom (KRK) je ve světě třetí nejčastější nádor a jeho celosvětová incidence je rozdílná v závislosti na vyspělosti země [1]. Více než u 60 % nemocných s KRK jsou diagnostikovány jaterní metastázy (JMKRK). V polovině případů již v době stanovení diagnózy nebo v průběhu léčby – nejčastěji do 2 let [2]. Pacienti se synchronními metastázami dosahují horších výsledků v přežívání. Chirurgická léčba je jedinou potenciálně kurabilní metodou s 5letým přežíváním dosahujícím cca 50 % [3]. Obecně se v současnosti za iniciálně resekabilní považuje méně než 25 % pacientů [4]. Vyléčení pacienta s metastatickým onemocněním je spojeno s resekabilním onemocněním, u pacientů léčených pouze systémovou léčbou bylo 10leté přežívání zaznamenáno u méně než 1 % [5]. Společnou snahou onkologů a chirurgů je navýšit počet resekovaných pacientů. Stanovení adekvátní léčby nebo léčebné strategie by mělo vycházet z rozhodnutí multidisciplinárního týmu. Metastatický KRK již dávno nepatří mezi onemocnění, kde by jeden přístup vyhovoval všem pacientům, a proto snaha o co nejlepší léčebné výsledky vyžaduje optimalizaci přístupu.
Chirurgická léčba
Kritéria resekability se významně mění. Resekabilita má totiž aspekt technický, určený chirurgem, a aspekt onkologický definovaný rizikem budoucí recidivy. Komplexnější ESMO klasifikace podle resekability dělí pacienty na:
- iniciálně resekabilní standardním postupem;
- pacienty resekabilní při použití rozšířeného postupu – vícedobé resekce, liver first approach (LFA), metody ovlivňující nárůst zbytkového jaterního parenchymu nebo kombinace resekce a radiofrekvenční ablace (RFA);
- pacienty iniciálně neresekabilní, avšak konvertovatelné při dosažení léčebné odpovědi;
- pacienty nepravděpodobně konvertovatelné nehledě na léčebnou odpověď [6].
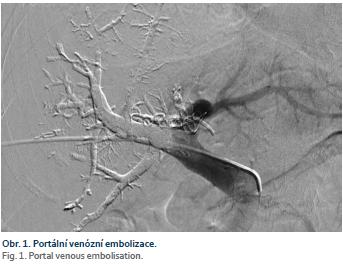
Zaměříme-li se na technický „chirurgický“ aspekt, můžeme vycházet z publikovaného konsenzu doporučení managementu JMKRK [7]. Jako minimální bezpečný okraj resekátu je doporučeno dodržet alespoň 1 mm (dříve 1 cm). Dále je doporučeno zachovat alespoň dva jaterní segmenty s cévním zásobením a biliární drenáží. Není zmiňován počet metastáz, ani jejich velikost. Resekci je možné provést, pokud zůstane zachováno nejméně 30 % zdravého parenchymu. Právě nedostatečný zbytkový objem jater (FLR – future liver remnant) je hlavní příčinou neresekability. Nedostatečný FLR může vést k pooperačnímu jaternímu selhání. Z těchto důvodů se upřednostňují parenchym šetřící resekce (metastasektomie) před velkými resekčními výkony. Máme však i technické možnosti navýšení objemu FLR. Tyto postupy jsou založeny na principu přerušení příslušné větve portálního řečiště, který vede k nárůstu kontralaterální části. Nejčastěji se jedná o portální venózní embolizaci – metoda intervenční radiologie (obr. 1).
Dále existují různé modifikace dvoudobé jaterní resekce. V první době provedeme odstranění metastáz, nejčastěji z levého jaterního laloku, s podvazem pravé větve portální žíly [8]. Ve druhé době po nárůstu FLR doplníme pravostrannou hepatektomii.
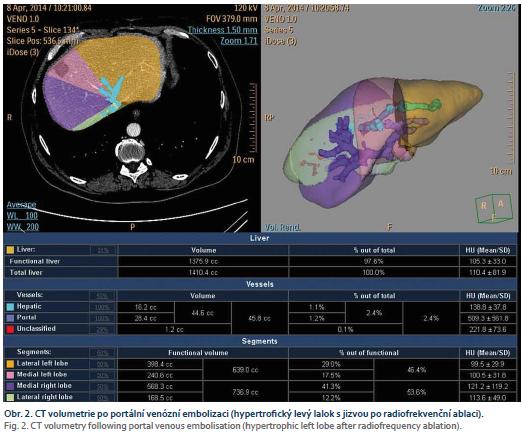
Pouhá chirurgická ligace nevede k dostatečnému nárůstu FLR a je nutné ji doplnit aplikací alkoholu či kmenových mezenchymálních buněk nebo roztětím parenchymu v místě předpokládané resekce [9]. Cílem těchto metod je zvětšení objemu jaterní tkáně, který zůstane po resekci (obr. 2).
Liver first approach
Prognózu pacienta ovlivňuje daleko více generalizace než primární tumor. U mnoha pacientů s pokročilými synchronními JMKRK dochází k progresi během léčby primárního tumoru, která znemožňuje resekci jaterních metastáz. Sdružené výkony v jedné době (především velké jaterní resekce a resekce rekta) jsou zatíženy vyšší morbiditou a mortalitou [10]. V roce 2006 publikovali Mentha et al [11] prospektivní studii o 20 pacientech se synchronními JMKRK. Po iniciační fázi systémové léčby pacienti podstoupili resekci jater a po následné fázi adjuvantní chemoterapie, event. doplněné o radioterapii, resekci primárního nádoru. Daný algoritmus dokončili u 16 pacientů (80 %) s 3letým přežíváním 71 %. LFA je vyhrazen především pro tumory rekta a rektosigmatu, profit této metody musí být prokázán randomizovanými studiemi.
Radiofrekvenční ablace
Nedílnou součástí komplexní léčby pacientů s JMKRK jsou i ablativní metody, zejména RFA. Způsoby provedení jsou dva:
- perkutánní s CT či ultrasonografickou navigací;
- peroperační (laparoskopicky nebo při laparotomii).
RFA je zatížena nižší dobou hospitalizace a nižší morbiditou, ovšem za cenu horších dlouhodobých výsledků – vyšší výskyt lokální rekurence a kratší bezpříznakové přežití (DFS – disease free survival) a celkové přežití (OS – overal survival) [12,13]. Pokud nalezneme srovnatelné dlouhodobé výsledky, jedná se většinou o solitární malé léze (do 3 cm) a peroperační použití RFA (laparotomie) [14]. RFA se jeví jako vhodná u starších či polymorbidních pacientů, u reoperací pro recidivy JMKRK a u bilobárních výkonů, kdy kombinujeme resekci a RFA. Většina autorů nadále favorizuje resekční výkon [12].
Systémová léčba
Za posledních 20 let zaznamenala léčba metastazujícího KRK dynamický rozvoj, jenž vedl k signifikantnímu zlepšení prognózy onemocnění. Monoterapie 5-fluorouracilem s mediánem OS 12 měsíců [15] byla překonána zavedením novějších cytostatik, oxaliplatiny a irinotekanu na konci 90. let minulého století. Nejběžněji používané kombinace představují dublety FOLFIRI a FOLFOX/XELOX. Posunuly medián celkového přežití ke 20 měsícům [16]. Vstup cílené terapie do léčby metastazujícícho KRK v roce 2004 vedl k dalšímu zlepšení výsledků. Pevné místo zaujala léčba založená na inhibici angioneogeneze reprezentovaná bevacizumabem a afliberceptem. Antiangiogenní léčiva cílí na komunikaci mezi nádorovými buňkami a buňkami endotelu, ovlivňují mikroprostředí nádoru. Tuto léčbu je obecně možné použít u všech pacientů. Léčba cílená na receptor pro epidermální růstový faktor (EGFR – epidermal growth factor receptor), zastoupená monoklonálními protilátkami cetuximabem a panitumumabem, naproti tomu působí přímo na nádorových buňkách. Její efekt je však podmíněn neporušenou funkcí signální dráhy EGFR. Mutace, které se nejčastěji objevují v KRAS, event. NRAS a BRAF genech, vedou k přetrvávající aktivaci dráhy, na níž nemá blokáda EGFR vliv, a tudíž ani terapeutický efekt.
Pokrok v porozumění molekulární biologii, často stimulovaný výsledky epidemiologických, ale i klinických studií, ozřejmil neudržitelnost konceptu jednotné léčby pro všechny pacienty. V současnosti lze u obecné populace pacientů s metastazujícím KRK mluvit o mediánu celkového přežití cca 31 měsíců [17]. A právě heterogenita onemocnění společně s individualizovanou léčbou vedou k poměrně rozdílným výsledkům u jednotlivých podskupin onemocnění. Na jedné straně nyní stojí BRAF mutované tumory představující zhruba 7 % [18] všech KRK, které jsou při absenci mikrosatelitové instability spojeny s nejhorší prognózou onemocnění s mediánem celkového přežití 9–17 měsíců. Na druhé straně pacienti s levostrannou lokalizací nádoru wild type RAS + BRAF mohou dosahovat mediánu přežití až 38 měsíců. U resekabilního a resekovaného metastatického onemocnění je přežití srovnatelné jako u lokálně pokročilých KRK III. stadia.
Nejčastější používanou kombinační léčbou jsou dublety na bázi oxaliplatiny a 5-fluorouracilu, nejčastěji FOLFOX/XELOX nebo dublet na bázi irinotekanu a 5-fluorouracilu FOLFIRI. Volba biologické léčby k tomuto dubletu vychází z mutačního stavu RAS a BRAF proteinu – mutace jakéhokoli z nich činí anti-EGFR protilátky neúčinné a volba v 1. linii léčby připadá na bevacizumab, preferenčně kombinovaný s oxaliplatinou a 5-fluorouracilem [19]. U metastatického KRK s RAS + BRAF wild type fenotypem jsou k dispozici pro kombinaci s chemoterapií dvě monoklonální protilátky, chimérický cetuximab a plně humanizovaný panitumumab. Obě je možné použít v kombinaci s režimem FOLFOX [20,21] i FOLFIRI [22,23]. Volbu mezi podáním anti-VEGF (vascular endothelial growth factor) a anti-EGFR léčby v 1. linii léčby metastatického KRK formovaly v roce 2016 publikované výsledky retrospektivní analýzy účinnosti biologické léčby v závislosti na lokalizaci tumoru ve studiích CALGB 80405, FIRE 3, PEAK a PRIME, které ukázaly významné rozdíly v terapeutické odpovědi mezi pravým a levým tračníkem [24–26]. Karcinomy pravého tračníku (cékum až celé kolon transversum do slezinného ohbí) měly horší prognózu přežití v porovnání s levým tračníkem, ale ještě více vynikly rozdíly v účinnosti anti-EGFR protilátek mezi pravým a levým tračníkem, kde dosahovaly významně lepších výsledků. Anti-VEGF léčba dosahovala v porovnání s anti-EGFR terapií lepších výsledků u pravého tračníku a naopak horších výsledků u levého tračníku. Je vhodné poznamenat, že u všech tří studií se jednalo o retrospektivní analýzy, které vyžadují ověření v prospektivní studii, přesto jsou tyto výsledky reflektovány v guidelines NCCN (National Comprehensive Cancer Network) i ESMO (European Society for Medial Oncology).
Neoadjuvance u resekabilních nálezů
Rozhodnutí o tom, zda provést resekci metastáz v 1. době či nejdříve zahájit chemoterapii, nemusí být při zvážení všech relevantních faktorů jednoduché.
Od systémové léčby podané před samotnou resekcí očekáváme, že dokáže negativně ovlivnit populaci nádorových buněk a alespoň potenciálně eradikovat mikrometastatický rozsev, který je pod limitem detekce. V práci Bonneyho et al byl nalezen významný rozdíl v incidenci mikrometastáz (satelitní ložiska nádorových buněk v okolí jaterních metastáz, nejčastěji v 1 cm lemu jaterních metastáz) mezi skupinou pacientů léčených samotnou resekcí (65 %) a pacientů s předchozí chemoterapií (25 %) [27]. V opozici vůči použití neoadjuvantní chemoterapie u resekabilních jaterních metastáz stojí výsledky analýzy dat z mezinárodního registru LiverMetSurvey publikované v roce 2015 [28], v níž nebyl prokázán přínos neoadjuvantní chemoterapie u resekabilních jaterních metastáz a v jejímž rámci nebyla absence adjuvantní chemoterapie spojena s horším OS i DFS. V PloS One byla publikována retrospektivní studie z roku 2014 [29], která naznačila benefit neoadjuvance u rizikové podskupiny charakterizované přítomností více než dvou prognostických faktorů (primární tumor stadia T4, postižení uzlin u primárního nádoru, ≥ 4 jaterní metastázy, největší průměr metastázy ≥ 5 cm a hladina CEA (carcinoembryonic antigen) ≥ 5 ng/ml).
Konverzní léčba
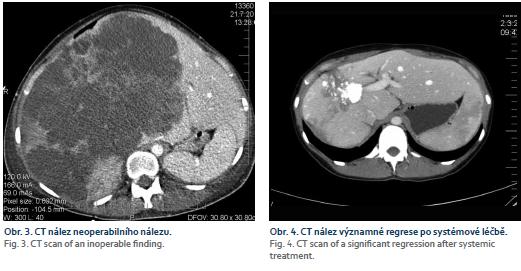
U primárně resekabilních nálezů může vést systémová léčba k významné léčebné odpovědi, tzv. downsizingu, která umožní resekci. Studie PRIME, CELIM, OPUS prokázaly významný efekt při kombinaci chemoterapie a biologické léčby (zejména anti-EGFR léčba). Resekabilita v těchto skupinách primárně neresekabilních pacientů dosahovala 15–55 % [27]. OS a DFS je u těchto pacientů, při srovnání s primárně resekabilními pacienty, bez signifikantního rozdílu [28]. Klíčová role při posouzení resekability u těchto pacientů je jejich opakované prezentování na multidisciplinárních týmech. Resekci indikujeme v okamžiku dosažení operability – s délkou podávání systémové léčby narůstá perioperační morbidita (obr. 3–5) [30].
Závěr
Léčba pacientů s JMKRK nabízí širokou variabilitu postupů. Snažíme se preferovat léčbu šitou na míru (personalizovaná léčba). Chirurgická léčba zůstává zásadní léčebnou modalitou s 5letým přežíváním přes 50 %. Rozvoj technik resekcí i vývoj systémové léčby umožňuje navýšení resekability a zlepšení prognózy pacientů.
K navýšení resekability je však též třeba zlepšit spolupráci mezi chirurgy erudovanými v chirurgii jater a klinickými onkology v multidisciplinárních týmech. Soustředit bychom se měli zejména na skupinu potenciálně resekabilních pacientů.
Práce je podpořena MO 1012.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 21. 9. 2018
Přijato/Accepted: 10. 10. 2018
MUDr. Jiří Pudil
Chirurgická klinika 2. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 02 Praha 6
jiri.pudil@uvn.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Parkin DM, Bray F, Ferlay J et al. Global cancer statistics 2002. CA Cancer J Clin 2005; 55 (2): 74–108.
2. Žaloudík J, Coufal O, Jurajda M et al. Patofyziologie jaterních metastáz kolorektálního karcinomu a důsledky pro terapii. Bull HPB 2001; 9: 27–28. [online]. Dostupné z: http: //www.hpb.cz/cz/akce/loket/index.html.
3. Třeška V. Technika jaterních resekcí – současné možnosti. Rozhl Chir 2007; 86 (7): 335–336.
4. Biasco G, Derenzini E, Grazi G et al. Treatment of hepatic metastases from colorectal cancer: many doubts, some certainties. Cancer Treat Rev 2006; 32 (3): 214–228.
5. Dy GK, Hobday TJ, Nelson G et al. Long-term survivors of metastatic colorectal cancer treated with systemic chemotherapy alone: a North Central Cancer Treatment Group review of 3811 patients, N0144. Clin Colorectal Cancer 2009; 8 (2): 88–93.
6. Van Cutsem E, Cervantes A, Adam R et al. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol 2016; 27 (8): 1386–1422. doi: 10.1093/annonc/mdw235.
7. Wakai T, Shirai Y, Sakata J et al. Histologic evaluation of intrahepatic micrometastases in patients treated with or without neoadjuvant chemotherapy for colorectal carcinoma liver metastasis. Int J Clin Exp Pathol 2012; 5 (4): 308–314.
8. Třeška V. Chirurgie jater pro metastázy kolorektálního karcinomu. Rozh Chir 2018; 97 (4): 149–155.
9. Alvarez FA, Ardiles V, Sanchez Claria R et al. Associating liver partition and portal vein ligation for staged hepatectomy (ALPPS): tips and tricks. J Gastrointest Surg 2013; 17 (4): 814–821. doi: 10.1007/s11605-012-2092-2.
10. Reddy SK, Pawlik TM, Zorzi D et al. Simultaneous resections of colorectal cancer and synchronous liver metastases: a multi-institutional analysis. Ann Surg Oncol 2007; 14 (12): 3481–3491. doi: 10.1245/s10434-007-95 22-5.
11. Mentha G, Roth AD, Terraz S et al. The ‘liver first’ approach in the treatment of colorectal cancer with synchronous liver metastases. Dig Surg 2008; 25 (6): 430–435. doi: 10.1159/000184 734.
12. Minami Y, Kudo M. Radiofrequency ablation of liver metastases from colorectal cancer: a literature review. Gut Liver 2013; 7 (1): 1–6. doi: 10.5009/gnl.2013.7.1.1.
13. Oshowo A, Gillams A, Harrison E et al. Comparison of resection and radiofrequency ablation for treatment of solitary colorectal liver metastases. Br J Surg 2003; 90 (10): 1240–1243. doi: 10.1002/bjs.4264.
14. Abdalla EK, Vauthey JN, Ellis LM et al. Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metastases. Ann Surg 2004; 239 (6): 818–825.
15. Poon MA, O’Connell MJ, Moertel CG et al. Biochemical modulation of fluorouracil: evidence of significant improvement of survival and quality of life in patients with advanced colorectal carcinoma. J Clin Oncol 1989; 7 (10): 1407–1418.
16. Tournigand C, André T, Achille E et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 2004; 22 (2): 229–237. doi: 10.1200/JCO.2004.05.113.
17. Loupakis F, Cremolini C, Masi G et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 2014; 371 (17): 1609–1618. doi: 10.1056/NEJMoa 1403108.
18. Cantwell-Dorris ER, O‘Leary JJ, Sheils OM. BRAFV600E: implications for carcinogenesis and molecular therapy. Mol Cancer Ther 2011; 10 (3): 385–394. doi: 10.1158/1535-7163.
19. Saltz LB, Clarke S, Díaz-Rubio E et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008; 26 (12): 2013–2019. doi: 10.1200/JCO.2007.14.9930.
20. Douillard J, Siena S, Tabernero J et al. Overall survival (OS) analysis from PRIME: Randomized phase III study of panitumumab (pmab) with FOLFOX4 for first-line metastatic colorectal cancer (mCRC). J Clin Oncol 2013; 31 (Suppl) abstr 3620.
21. Qin S, Xu J, Wang L et al. First-line FOLFOX-4 ± cetuximab in patients with RAS wild-type metastatic colorectal cancer: The open-label, randomized, phase 3 TAILOR trial. [online]. Available from: https: //oncologypro.esmo.org/Meeting-Resources/ESMO-Asia-2016-Congress/First-line-FOLFOX-4-cetuximab-in-patients-with-RAS-wild-type-metastatic-colorectal-cancer-The-open-label-randomized-phase-3-TAILOR-trial.
22. Van Cutsem E, Köhne CH, Láng I et al. Cetuximab plus irinotecan, fluorouracil, and leucovorin as first-line treatment for metastatic colorectal cancer: updated analysis of overall survival according to tumor KRAS and BRAF mutation status. J Clin Oncol 2011; 29 (15): 2011–2019. doi: 10.1200/JCO.2010.33.5091.
23. Carrato A, Abad A, Massuti B et al. First-line panitumumab plus FOLFOX4 or FOLFIRI in colorectal cancer with multiple or unresectable liver metastases: A randomised, phase II trial (PLANET-TTD). Eur J Cancer 2018; 81: 191–202. doi: 10.1016/j.ejca.2017.04.024.
24. Khattak MA, Martin H, Davidson A et al. Role of first-line anti-epidermal growth factor receptor therapy compared with anti-vascular endothelial growth factor therapy in advanced colorectal cancer: a meta-analysis of randomized clinical trials. Clin Colorectal Cancer 2015; 14 (2): 81–90. doi: 10.1016/j.clcc.2014.12. 011.
25. Pietrantonio F, Cremolini C, Petrelli F et al. First-line anti-EGFR monoclonal antibodies in panRAS wild-type metastatic colorectal cancer: a systematic review and meta-analysis. Crit Rev Oncol Hematol 2015; 96 (1): 156–166. doi: 10.1016/j.critrevonc.2015.05.016.
26. Heinemann V, Rivera F, O‘Neil BH et al. A study-level meta-analysis of efficacy data from head-to-head first-line trials of epidermal growth factor receptor inhibitors versus bevacizumab in patients with RAS wild-type metastatic colorectal cancer. Eur J Cancer 2016, 67: 11–20. doi: 10.1016/j.ejca.2016.07.019.
27. Bonney GK, Coldham C, Adam R et al. Role of neoadjuvant chemotherapy in resectable synchronous colorectal liver metastasis; an international multi-center data analysis using LiverMetSurvey. J Surg Oncol 2015; 111 (6): 716–724. doi: 10.1002/jso.23899.
28. Adam R, de Gramont A, Figueras J et al. Managing synchronous liver metastases from colorectal cancer: a multidisciplinary international consensus. Cancer Treat Rev 2015; 41 (9): 729–741. doi: 10.1016/j.ctrv.2015.06.006.
29. Zhu D, Zhong Y, Wei Y et al. Effect of neoadjuvant chemotherapy in patients with resectable colorectal liver metastases. PLoS One 2014; 9 (1): e86543. doi: 10.1371/journal.pone.0086543.
30. Karoui M, Penna C, Amin-Hashem M et al. Influence of preoperative chemotherapy on the risk of major hepatectomy for colorectal liver metastases. Ann Surg 2006; 243 (1): 1–7.