Glomerulopatie u pacientů s idiopatickými střevními záněty
Vladimír Teplan Orcid.org 1,2,3, Eva Honsová Orcid.org 4, Milan Lukáš Orcid.org 5
+ Pracoviště
Souhrn
Idiopatické střevní záněty (IBD – inflammatory bowel disease), Crohnova nemoc, ulcerózní kolitida a choroby ledvin probíhají často společně. V současné době se dostává do popředí zájmu také výskyt různých forem glomerulonefritid u těchto nemocných. Nejčastější je mezangioproliferativní glomerulonefritida s depozity imunoglobulinu A, označovaná jako IgA nefropatie – Bergerova nemoc. Poškození ledvin se může projevovat sníženou funkcí a rozvojem proteinurie, někdy až nefrotického charakteru. Specifická situace je u nemocných s IBD na biologické léčbě se současně závažným postižením ledvin imunitního původu ve formě glomerulonefritidy, kteří vyžadují další imunosupresivní léčbu. Současná strategie, která spočívá v podávání imunosupresivní a biologické léčby současně, je empirická a řídí se tíží a aktivitou obou onemocnění. U IBD pacientů s lehčí formou renálního onemocnění obvykle pokračuje nastavená biologická léčba. V případě zhoršení renálního onemocnění s akcentací proteinurie a zhoršením glomerulární filtrace doporučují nefrologové zahájit intenzivní imunosupresivní léčbu např. cyklofosfamidem (Endoxan iv) spolu s kortikoidy (Methylprednisolon iv) a vysazení biologické léčby. Důvodem je obava ze sumace systémového imunosupresivního účinku obou léčebných postupů a zvýšeného rizika systémové infekce. Při zhoršení střevního zánětu je vhodné zvážit biologickou terapii se selektivním působením na gastrointestinální trakt (vedolizumab). Jasná pravidla ani průkazné studie však nejsou k dispozici. Představujeme čtyři klinické případy z praxe.
Klíčová slova
IBD, biologická léčba, glomerulonefritidy, imunosupresivní léčba, ledvinyÚvod
Gastroenterolog se setkává u svých pacientů s různými nefrologickými a urologickými onemocněními relativně často a měl by umět rozhodnout, jaká je jejich etiologie a závažnost s ohledem na další diagnostický a léčebný postup [1]. V klinické praxi nacházíme u nemocných s idiopatickými střevními záněty (IBD – inflammatory bowel disease) nejčastěji urologické komplikace, které se objevují v důsledku anatomických poměrů s vývodnými močovými cestami při postižení pravého tračníku a/nebo terminálního ilea. Rozsáhlý zánětlivý infiltrát v této lokalizaci může způsobit obstrukci pravostranného močovodu nebo vznik enterovezikálních, resp. kolovezikálních píštělí. Až u čtvrtiny pacientů s Crohnovou nemocí (CD – Crohn’s disease), zvláště po opakovaných resekcích tenkého střeva, je prokazatelná enterálně podmíněná hyperoxalurie nebo urolitiáza. Konkrementy jsou u těchto nemocných kalcium-oxalátové nebo urátové a mohou způsobovat blokádu močových cest. Pravidelným doprovodným nálezem je infekce močových cest, jejíž klinické projevy mohou být překryty symptomatologií střevního zánětu [2,3]. U nemocných s ulcerózní kolitidou (UC – ulcerative colitis) se vyskytuje nefrolitiáza méně často (cca 5 %) a je většinou způsobena dehydratací a kalciurií. Chronický zánět se může podílet na vzniku a progresi renální amyloidózy AA typu, se vzestupem sérového amyloidu A proteinu a C-reaktivního proteinu. U nemocných s CD by se mělo pátrat po splenomegalii a proteinurii. Je zajímavé, že po resekci střeva postiženého CD byl pozorován ústup amyloidózy. Sekundární AA amyloidóza se vyskytuje až u 1 % IBD nemocných, je 3× častější u mužů a 10× častější u CD než u UC a může se vyskytovat s dalšími extraintestinálními komplikacemi [4,5]. Dalším postižením ledvin při IBD jsou některé formy tubulointersticiální nefritidy. Je známé riziko vzniku intersticiální nefritidy s akutní renální insuficiencí při léčbě 5-aminosalicylovou kyselinou, které se vyskytuje cca u 1 z 500 léčených pacientů. Je většinou reverzibilní a po vysazení léčby dochází k úplné úpravě renálních funkcí, bohužel u některých nemocných bylo pozorováno trvalé selhání ledvin. Pochopitelně i jiné léčebné postupy se mohou projevit nefrotoxicitou, např. při léčbě cyklosporinem nebo některými antibiotiky [6–8]. V současné době se do popředí odborného zájmu dostaly různé formy glomerulonefritid, které vznikají buď v přímé souvislosti s autoimunitními patofyziologickými mechanizmy společnými s IBD, nebo jde o koincidující postižení ledvin. Podle bioptických nálezů se výskyt glomerulopatií pohybuje u IBD nemocných v rozmezí 1–4 % [9]. Nejfrekventovanější glomerulopatií je mezangioproliferativní glomerulonefritida s depozity imunoglobulinu – tzv. IgA nefropatie (IgA-GN, Bergerova nemoc), která je považována za sekundární glomerulopatii při probíhajícím IBD. První popis pochází z roku 1984 [10,11]. Při jejím vzniku se předpokládají vícečetné imunitní změny při zánětlivém postižení sliznice gastrointestinálního traktu (GIT) s významnou dysfunkcí T lymfocytů. Dalším významným faktorem je fenotyp HLA-DR 1, který byl popsán jak u IgA-GN, tak u IBD [12]. Poškození ledvin se může projevovat sníženou funkcí a rozvojem proteinurie, někdy až nefrotického charakteru [13]. Současný výskyt střevních onemocnění a glomerulopatií je uveden v tab. 1.
Kazuistiky
Kazuistika 1
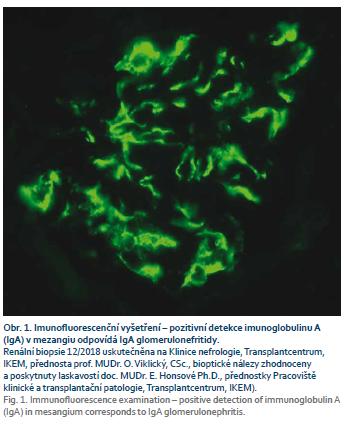
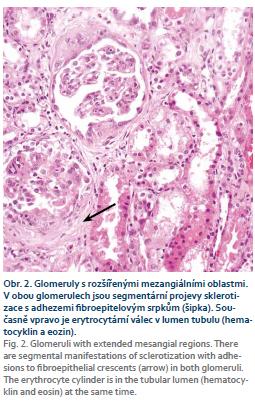
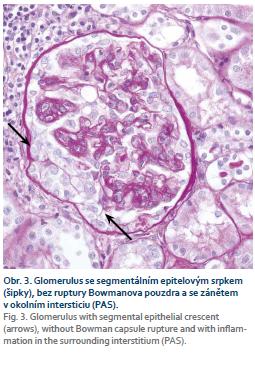
Pacientka, narozená 1974, s diagnózou CD od roku 2005 s postižením ileocékální oblasti a pravého tračníku, byla od roku 2011 léčena infliximabem (5 mg/kg) v intervalu 8, resp. 6 týdnů s dlouhodobě dobrým efektem. V září 2018 v průběhu lázeňského pobytu byla léčena amoxicilinem-klavulanátem pro tonzilitidu s následným rozvojem otoků na obou dolních končetinách. Při kontrolním vyšetření byla zachycena významná proteinurie 14,5 g/24 hod, erytrocyturie 370 ery/zorné pole, závažná hypoalbuminemie 21,9 g/l, hypokalcemie 2,13 mmol/l, celkový cholesterol dosahoval hodnoty 8,32 mmol/l, LDL-cholesterol 5,51 mmol/l, urea 5,6 mmol/l a sérový kreatinin 125 umol/l s odhadovanou glomerulární filtrací (e-GFR) podle výpočtu CKD-EPI 0,73 ml/s. Následně došlo k další progresi snížení renální funkce až na hodnoty kreatininu 162 μmo/l. Klinický závěr byl – nefrotický syndrom při pravděpodobné glomerulopatii typu rychle progredující glomerulonefritidy (RPGN). Imunologické vyšetření podpořilo podezření na diagnózu RPGN. ANCA protilátky: c-ANCA protilátky proti proteináze 3 (anti-PR3) < 0,20, pANCA – protilátky proti myeloperoxidáze (anti-MPO) < 0,20, obojí negativní, protilátky proti bazální membráně glomerulů (anti-GBM) negativní a protilátky na LE (anti-dsDNA) < 1,1 – negativní. Následně byla pacientka hospitalizována na Klinice nefrologie IKEM, kde byla provedena renální biopsie se závěrem – IgA nefropatie se srpky. Byla zahájena intenzivní imunosupresivní léčba, opakované pulzy cyklofosfamidu intravenózně (i.v.) v dávce 900 mg a metylprednisolonu 1,0 g i.v. (celkem 5×) s následnou snižující se dávkou prednisonu. Současně bylo ukončeno podávání biologické léčby infliximabem a bylo pokračováno v monoterapii azathioprinem. Navržený převod na vedolizumab nebyl pacientkou zatím pro klinickou stabilitu CD akceptován. Po zavedení léčby došlo ke zlepšení klinického stavu s ústupem otoků a laboratorních parametrů (kreatinin v oscilaci 135–121–152 μmol/l a proteinurie 4,98–7,69–5,75 g/24 hod). Renální funkce byla zlepšena, stejně jako proteinurie, nicméně závažný nález v renální biopsii (fibroepitelové srpky a sklerotizace) jsou nepříznivými faktory pro další prognózu pacientky a setrvalou úpravu renálních funkcí. Z hlediska základní léčby CD pokračujeme v monoterapii azathioprinem. Při zhoršení aktivity CD v budoucnosti přichází v úvahu léčba vedolizumabem (obr. 1–3).
Kazuistika 2
Pacient, narozený v roce 2000, s diagnózou UC stanovenou již v 5 letech, byl od roku 2006 na biologické léčbě infliximabem s velmi dobrým klinickým efektem. Po interkurentním respiračním virovém onemocnění v roce 2017 se objevila makroskopická hematurie. Provedená renální biopsie (Dětská klinika FN Motol) potvrdila aktivní a fokálně segmentární glomerulonefritidu – IgA nefropatie s extrakapilární proliferací a se spoluúčastí tubulointersticiální nefritidy, velmi pravděpodobně poléková. Proto byl následně vysazen mesalazin a bylo pokračováno v léčbě kortikoidy a v antihypertenzivní medikaci inhibitorem angiotenzin konvertující enzym (ACE). Renální funkce byly v normě, sérový kreatinin se pohyboval okolo 70 μmol/l, byla prokazována minimální proteinurie 0,2 g/24 hod a počet erytrocytů v močovém sedimentu byl nad horní hranicí (120/na zorné pole). Nemocný stále pokračuje v podávání infliximabu. Celkový stav byl uzavřen s tím, že se jednalo o febrilní ataku spojenou s intermitentní makroskopickou hematurií, při minimální proteinurii a zachovalé renální funkci.
Kazuistika 3
Pacient, narozený v roce 1969, měl v minulosti pro významný nefrologický nález proteinurie, erytrocyturie a zvýšené hodnoty kreatininu již 2× provedenou renální biopsii. První byla v roce 1996 se závěrem IgA nefropatie s následnou léčbou pulzy kortikoidy. Pro relaps renálního onemocnění byla o 11 let později, v roce 2017, provedena rebiopsie s nálezem pokročilé IgA nefropatie se sklerotizací, fokálně se známkami pyelonefritidy s fibrózou intersticia. Renální funkce s hodnotami sérového kreatininu oscilovala od 165 do 263 μmol/l (e-GFR CKD EPI 0,369 ml/s), s přetrvávající středně velkou proteinurií 5,25 g/24 hod. V roce 2017 byla nově diagnostikována CD v oblasti ileokolické, progredující průběh choroby byl indikací k biologické léčbě vedolizumabem. V průběhu sledování pacient vykazoval postupnou, ale závažnou progresi renální insuficience až do stadia chronického selhání ledvin CKD4. Výhledově bude připravován do dialyzačně-transplantačního programu. V současné době je po stránce klinické i laboratorní schopen pokračovat v biologické léčbě vedolizumabem při pravidelných gastroenterologických a nefrologických kontrolách. Interkurentní infekce jsou léčeny cíleně antibiotiky, současně je podávána trvalá nutriční podpora formou sippingu.
Kazustika 4
Pacient, narozený v roce 1988, prodělal v dětském věku akutní glomerulonefritidu a v juvenilním věku mu byla stanovena diagnóza Bechtěrevovy choroby, pro kterou byla později provedena náhrada obou kyčelních kloubů. V následujícím období bylo zjištěno postupné zhoršování renální funkce. Renální biopsie v roce 2017 a rebiopsie v roce 2019 potvrdily diagnózu AA amyloidózy se sklerotizací. V roce 1998 byla stanovena diagnóza CD, krátce v letech 2009–2010 byl léčen biologickou terapií infliximabem, poté se podrobil ileokolické resekci pro těsnou stenózu terminálního ilea. Po operaci byla biologická léčba ukončena. V květnu 2018 pro rekurenci CD na neoterminálním ileu byla biologická terapie infliximabem znovu obnovena, avšak pro opožděnou alergickou reakci bylo nutné realizovat switch na adalimumab. Aktuální hodnoty kreatininu se pohybují okolo 430–465 μmol/l, urey 11,5 mmol/l, e-GFR CKD-EPI 0,24 ml/s, hyperkalemií až 6,14 mmol/l a renálně podmíněnou anémií. Pro pokročilou renální insuficienci až selhání ledvin ve stadiu CKD 4 byl indikován k bezprostřední přípravě na dialyzační léčbu a následně k zařazení do programu transplantace ledviny v IKEM. Biologická léčba byla vzhledem ke klinickému stavu a laboratorním nálezům ledvinného selhání ukončena, nicméně CD nevykazuje klinické, ani laboratorní, či ultrasonografické známky aktivity. Vedle toho pokračuje v modifikované nízkoproteinové dietě s ketoanalogy esenciálních aminokyselin.
Diskuze
Malá sestava našich IBD pacientů s koincidujícími nefropatiemi prezentuje několik zajímavých klinických situací. V první kazuistice představujeme pacientku, která byla pro komplikovaný průběh CD indikována k úspěšné biologické terapii monoklonálními protilátkami proti tumor nekrotizujícímu faktoru (anti-TNF). Po několikaleté léčbě došlo k projevům nefrotického syndromu, renální insuficienci na podkladě IgA membranoproliferativní glomerulonefritidy se srpky. Blokáda TNF-α monoklonálními protilátkami může být spojena s řadou vedlejších a nežádoucích efektů, jako jsou bakteriální, virové a mykotické infekce, a také s paradoxní autoimunitní reakcí, jako je vznik psoriázy, revmatoidní artritidy nebo lupus-like syndromu.
Vliv anti-TNF léčby na zhoršení průběhu primární sklerozující cholangitidy (PSC) vedl dokonce k národnímu doporučení u IBD pacientů s prokázanou PSC používat preparáty s jiným mechanizmem účinku, jako je selektivní GIT působící vedolizumab nebo anti-cytokinová léčba ustekinumabem. Vliv biologické léčby (anti-TNF) u IBD pacientů z hlediska indukce nebo potlačení autoimunitní reakce v ledvinách však nebyl zatím systematicky zhodnocen.
Naše pacientka měla potvrzenu IgA-GN s nekrózami a se srpky, což je pro průběh klasické IgA-GN velmi neobvyklé, a proto nelze nepříznivý vliv anti-TNF léčby na vznik nefropatie vyloučit.
V jedné publikované kohortě osmi nemocných s CD se sekundární AA-amy-loidózou došlo po 3letém podávání infliximabu k vymizení proteinurie a zlepšení renálních funkcí [13]. U jiného 16letého pacienta trpícího UC a s diagnostikovaným atypickým hemolytickouremickým syndromem bylo podávání vedolizumabu spojeno se snížením aktivity IBD a se zlepšením renálních funkcí a snížením proteinurie [14].
V další kazuistice byl infliximab podáván nemocnému v hemodialyzační léčbě s IgA nefropatií, u kterého profuzní průjmy zhoršovaly vodní a elektrolytovou bilanci. Po 6týdenní bezpečné léčbě se zlepšil klinický stav a srovnalo se také vnitřní prostředí [15]. Biologická léčba byla podávána současně s imunosupresí také po orgánové transplantaci. Klinické zkušenosti ukazují vyšší riziko vzniku IBD po orgánové transplantaci ve srovnání s běžnou populací. Ve studii zahrnující 1 537 IBD pacientů bylo 31 pacientů transplantováno (22 UC, 9 CD, 2 %), z nichž 24 mělo transplantaci jater, 6 ledviny a 1 transplantaci srdce. Všichni byli léčeni kombinací kalcineurinovými inhibitory (takrolimus či cyklosporin) a mykofenolát mofetilem. Následně byli 2 pacienti s UC a 1 s CD léčeni infliximabem, resp. adalimumabem a steroidy s azathioprinem pro relaps IBD [16–18].
Současné názory na podávání konkomitující imunosupresivní a biologické léčby vycházejí z empirické zkušenosti a jsou založeny na posouzení tíže a aktivity střevního zánětu a ledvin. U IBD pacientů s lehčí formou renálního onemocnění se obvykle pokračuje v původně nastavené biologické léčbě. Samozřejmě i zde musí být dodržována pravidla postupu pro konzervativní nefrologii vč. dobře kontrolované hypertenze za úpravy příjmu proteinů s ohledem na střevní ztráty. V případě relapsu renálního onemocnění s akcentací proteinurie a zhoršení glomerulární filtrace doporučují nefrologové zahájit intenzivní imunosupresivní léčbu cyklofosfamidem spolu s kortikoidy. Pokud je IBD stabilizováno, doporučuje se přerušit krátkodobě biologickou léčbu až do ukončení cyklu imunosupresivní léčby s ponecháním kortikoidů. K vysazení biologické léčby vede obava ze sumace systémového imunosupresivního účinku a zvýšeného rizika systémové infekce. Jasná pravidla ani průkazné studie však nejsou k dispozici.
Poslední námi prezentovaný pacient měl letitý průběh ankylozující spondylitidy s CD, u kterého došlo ke vzniku nevratného renálního selhání na podkladě AA amyloidózy. Léčba adalimumabem byla efektivní na úpravu střevního zánětu a neměla negativní vliv na vznik infekčních komplikací. V situaci pokročilého renálního selhání se již objevují významné metabolické poruchy spojené se sníženou renální funkcí a progrese renálního onemocnění může být akcentována i minerálovým a nutričním rozvratem při neadekvátním hrazení ztrát. Nemocný již musí být připravován na další léčebný postup v dialyzačně-transplantačním programu, a pokud to umožňuje klinický stav, je možné uvážlivě pokračovat při zvýšených laboratorních a klinických kontrolách v podávání biologické léčby. Pokud je IBD dlouhodobě stabilizováno, je vhodné zvážit biologickou léčbu redukovat, event. ukončit.
Přijato/ Accepted: 3. 2. 2020
prof. MUDr. Vladimír Teplan, DrSc.
Klinické a výzkumné centrum pro idiopatické střevní záněty ISCARE. a. s.
Českomoravská 2510/19
190 00 Praha 9
teplan@iscare.cz

Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Teplan V, Marečková O, Lukáš M. Onemocnění gastrointestinálního traktu a choroby ledvin. Gastroent Hepatol 2018; 72 (1): 50–57. doi: 10.14735/amgh201850.
2. Marečková O. Poruchy gastrointestinálního traktu u chorob ledvin. In: Teplan V. Metabolismus a ledviny. Praha: Grada Avicenum 2000: 147–157.
3. Teplan V, Lukáš M. Urolithiasis in patients with inflammatory bowel disease. Gastroent Hepatol 2015; 69 (6): 561–569. doi: 10.14735/ amgh2015561.
4. Serra I, Oller B, Mañosa M et al. Systemic amyloidosis in inflammatory bowel disease: retrospective study on its prevalence, clinical presentation, and outcome. J Crohns Colitis 2010; 4 (3): 269–274. doi: 10.1016/j.crohns.2009.11. 009.
5. Basturk T, Ozagari A, Ozturk T et al. Crohn’s disease and secondary amyloidosis: early complication? A case report and review of the literature. J Ren Care 2009; 35 (3): 147–150. doi: 10.1111/j.1755-6686.2009.00106.x.
6. Lukáš M, Bortlík M, Pospíšilová P et al. Nefrotoxicita mesalazinu při dlouhodobé léčbě ulcerózní kolitidy a Crohnovy nemoci. Čes a Slov Gastroent 1999; 53 (5): 135–139.
7. Oikonomou KA, Kapsoritakis AN, Stefanidis I et al. Drug-induced nephrotoxicity in inflammatory bowel disease. Nephron Clin Pract 2011; 119 (2): 89–94. doi: 10.1159/000326682.
8. Teplan V, Ševela K. Toxické a lékové poškození jater a ledvin. Gastroent Hepatol 2019; 73 (1): 66–74. doi: 10.14735/amgh201966.
9. Pohjonen J, Nurmi R, Metso M et al. Inflammatory bowel disease in patients undergoing renal biopsies. Clin Kidney J 2019; 12 (5): 645–651. doi: 10.1093/ckj/sfz004.
10. Hubert D, Beaufils M, Meyrier A. Immunoglobulin A glomerular nephropathy associated with inflammatory colitis. Apropos of 2 cases. Presse Med 1984; 13 (17): 1083–1085.
11. Makdassy R, Beaufils M, Meyrier A et al. Pathologic conditions associated with IgA mesangial nephropathy: preliminary results. Contrib Nephrol 1984; 40: 292–295. doi: 10.1159/000409764
12. Takemura T, Okada M, Yagie K et al. An adolescent with IgA nephropathy and Crohn’s disease: pathogenetic implications. Pediatric Nephrol 2002; 17 (10): 863–866. doi: 10.1007/s00467-002-0943-x.
13. Tada Y, Ishihara S, Ito T et al. Successful use of maintenance infliximab for nephropathy in patients with secondary amyloidosis complicating Crohn’s disease. Intern Med 2013; 52 (17): 1899–1902. doi: 10.2169/internalmedicine.52.0340.
14. Chiba M, Tsuda S, Tsuji T et al. Crohn’s disease successfully treated with infliximab in a patient receiving hemodialysis: case report and review of the literature. Medicine (Baltimore) 2014; 93 (7): e54. doi: 10.1097/MD.0000000000000 054.
15. Webb TN, Griffiths H, Miyashita Y et al. Atypical hemolytic uremic syndrome and chronic ulcerative colitis treated with eculizumab. Int J Med Pharm Case Reports 2015; 4 (5): 105–112. doi: 10.9734/IJMPCR/2015/18771.
16. Schnitzler F, Friedrich M, Stallhofer J et al. Solid organ transplantation in patients with inflammatory bowel disease (IBD): analysis of transplantation outcome and IBD activity in a large single center cohort. PLoS One 2015; 10 (8): e0135807. doi: 10.1371/journal.pone.0135807.
17. Pittman ME, Jessurun J, Yantiss RK. Differentiating posttransplant inflammatory bowel disease and other colitides in renal transplant patients. Am J Surg Pathol 2017; 41 (12): 1666–1674. doi: 10.1097/PAS.0000000000000921.
18. Primas C, Novacek G, Schweiger K et al. Renal insufficiency in IBD – prevalence and possible pathogenetic aspects. J Crohn’s Colitis 2013; 7 (12): 630–634. doi: 10.1016/ j.crohns.2013.05.001.