Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů
Jiřina Pintová Orcid.org 1, Robert Procházka Orcid.org 2, Vladimír Nosek Orcid.org 2
+ Pracoviště
Souhrn
Úvod: V posledním desetiletí se díky vývoji nových metalických apozičních stentů významně rozšířily indikace pro endosonograficky (EUS) navigované drenážní výkony. Metodika: Cílem zpracování retrospektivního, konsekutivního souboru (listopad 2016–květen 2018) bylo zhodnotit technickou proveditelnost, klinickou úspěšnost a počet periprocedurálních a pozdních komplikací u EUS navigovaných drenáží s použitím metalického apozičního stentu Hot AXIOS. Soubor zahrnoval 20 pacientů s 9 maligními a 11 benigními diagnózami. Bylo provedeno 7 drenáží patologické tekutinové kolekce. V 6 případech byla provedena drenáž žlučníku. Přístup do ductus choledochus byl zajištěn v 6 případech a 1 pacient podstoupil gastroenterostomii. Výsledky: Technická úspěšnost činila 100 %, klinická úspěšnost 95 %. Vyskytly se 2 s výkonem spojené komplikace (10 %), malpozice stentu a mírné krvácení. Reintervencí byla řešena 1 pozdní komplikace – cholangoitida při obturaci stentu (5 %). Průměrná doba zavedení stentů u pacientů s maligní diagnózou činila 103 dní. Závěr: Zhodnocením našeho souboru jsme potvrdili vysokou technickou a klinickou úspěšnost EUS navigovaných drenáží pomocí stentů Hot AXIOS s nízkým procentem komplikací.
Klíčová slova
biliární drenáž, endosonograficky navigovaná transmurální drenáž, enteroenterostomie, metalický apoziční stent, peripankreatické kolekceÚvod
V posledním desetiletí zaznamenaly endosonograficky (EUS) navigované drenážní výkony díky zavedení nových technologií výrazný pokrok. Původně byly drenáže prováděny pomocí instrumentů primárně určených pro endoskopickou retrográdní cholangio-pankreatografii (ERCP). Metalické apoziční stenty (LAMS – lumen apposing metal stent) představují významnou inovaci umožňující bezpečně drénovat pod EUS kontrolou struktury přiléhající k trávicímu traktu.
LAMS jsou plně potahované, samoexpandibilní, nitinolové stenty zaváděné přímo kanálem echoendoskopu. Svým tvarem připomínají činku, kdy k sobě oba rozšířené konce stentu přitahují stěnu zažívacího traktu a drénované struktury. Stenty jsou potaženy silikonovou membránou, která zabraňuje vzniku leaku. Svou radiální silou komprimují stomický kanál a eliminují riziko bezprostředního krvácení po výkonu. Rozšířené konce stentu snižují riziko migrace. Vnitřní průměr stentu dosahující šíře až 15 mm redukuje riziko obturace stentu a dovoluje opakovaný endoskopický přístup do drénované struktury s možností nekrektomie.
Zavádění první generace LAMS (AXIOS), Xlumena Inc., Boston Scientific a Niti-S NAGI a Niti-S SPAXUS, Taewoong Medical, vyžadovalo postup ve více krocích Seldingerovou metodou (punkce aspirační jehlou, zavedení vodiče a vytvoření kanálu pro stent cystotomem nebo balonovou dilatací).
Nová generace stentů používaná od roku 2015 má v zaváděcím systému zabudovanou elektrokauterizační jednotku umožňující jednokrokové zavedení stentu ECE-LAMS (electrocautery-enhanced lumen apposing metal stent), typ Hot AXIOS, Xlumena Inc., Boston Scientific. Po iniciální punkci drénované struktury elektrokauterizačním koncem stentu, který nahrazuje cystotom, je přímo zaveden adjustovaný stent do drénované struktury. Distální konec stentu je rozvinut pod EUS kontrolou a proximální pod endoskopickou nebo EUS kontrolou. Při suboptimální pozici echoendoskopu a předpokládané nejistotě správného zavedení stentu je možné provést drenáž Seldingerovou metodou s pomocí vodiče jako u první generace LAMS [1,2].
Metalické apoziční stenty byly původně konstruovány pro drenáže peripankreatických kolekcí (PPC – pankreatická pseudocysta) a walled-off necrosis (WON). Našly však také uplatnění při vytvoření biliodigestivních spojek (choledocho-duodenostomie při selhání ERCP a drenáže žlučníku u inoperabilních pacientů s akutní cholecystitidou). Využívány jsou k vytvoření entero-enteroanastomózy u pacientů s gastric outlet syndromem a k vytvoření vstupu do exkludovaného žaludku u bariatrických pacientů po gastrickém bypassu. Tento vstup umožňuje provedení ERCP (EDGE – EUS-directed transgastic ERCP) [3].
Bezprostředně s EUS navigovaným výkonem mohou vzniknout komplikace jako akutní krvácení, volná perforace nebo malpozice stentu. Pozdními komplikacemi jsou odložené krvácení z aroze okolních cév stentem nebo vytvořeného pseudoaneuryzmatu v dutině drénované struktury, migrace nebo obturace stentu. Specificky při drenáži žlučových cest může nastat biliární leak, akutní cholangoitida a sump syndrom (syndrom „žumpy“) s tvorbou sludge a choledocholitiázy. V jednotlivých případech byl popsán stent zanořený do stěny žaludku (buried LAMS) [4,5].
Primárním cílem zpracování našeho souboru bylo ověřit technickou a klinickou úspěšnost EUS navigovaného zavedení stentů ECE-LAMS a dále zhodnotit výskyt bezprostředních a odložených komplikací.
Soubor pacientů a metody
Na našem pracovišti bylo v průběhu 18 měsíců provedeno 20 EUS navigovaných drenáží s použitím ECE-LAMS typu Hot AXIOS u 20 pacientů (obr. 1). Jedná se o indikačně heterogenní soubor zahrnující 9 maligních a 11 benigních diagnóz (tab. 1). Klinickou úspěšnost jsme hodnotili v závislosti na indikaci drenáže podle klinické a laboratorní odezvy během 7 dní po výkonu. Odložené komplikace jsme sledovali v min. intervalu 30 dní. Jedná se o retrospektivní, konsekutivní, heterogenní soubor pacientů z období listopad 2016–květen 2018.
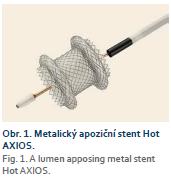
Maligní indikace obsahovaly 5× pokročilý karcinom hlavy pankreatu, 2× Klatskinův tumor, 1× tumor distálního choledochu a 1× generalizovaný neuroendokrinní nádor pankreatu (obr. 2).
Benigní indikace zahrnovaly 1× WON a 3× drenáž PPC. U PPC jsme preferovali zavedení metalického apozičního stentu oproti plastové drenáži z těchto důvodů: 1× rozsáhlé varikózní pleteně ve stěně žaludku a perigastricky, 1× obtížný přístup ke drenáži při nepříznivé lokalizaci PPC v duodenálním okně a 1× širší interpozitum mezi stěnou žaludku a pseudocystou. V jednom případě byl drénován peripankreatický absces u pacienta po akutní exacerbaci pokročilé chronické pankreatitidy s perkutánní drenáží hematomu infarzované sleziny.
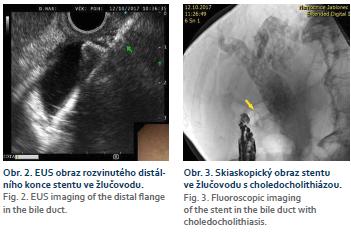
U letité, inoperabilní pacientky byla nalezena neobvyklá kombinace rozsáhlého, plošného adenomu sestupného duodena a vyplňující mnohočetné choledocholitiázy. ERCP bylo neúspěšné pro infiltraci papily adenomem. Byla provedena choledocho-duodenostomie jako zajištění přístupu do žlučových cest, která umožnila další řešení choledocholitiázy (obr. 3).
Dvakrát jsme přistoupili k drenáži žlučníku u letitých pacientů s akutní cholecystitidou neschopných podstoupit chirurgické řešení. Oba výkony byly prováděny v terénu komplikovaného zánětlivého postižení žlučníku (1× dvojitá krytá perforace, 1× objemný subhepatální absces).
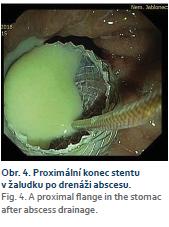
Postchirurgický absces byl drénován 2×. Nejmladší pacient v souboru byl drénován pro vysoko uložený subfrenický absces po sleeve resekci žaludku. Druhý pacient v souboru podstoupil primárně rozsáhlou resekci kaudy pankreatu, sleziny, stěny žaludku a lienální flexury pro generalizovaný neuroendokrinní karcinom G3 o velikosti 10 cm. V pooperačním období prodělal pacient infarkt myokardu (IM) s ST elevacemi se zave-dením dlouhého koronárního stentu s následnou duální antiagregační léčbou. Za 14 dní po IM se objevil septický stav nereagující na kombinovanou antibiotickou terapii (ATB). Příčinou byl 7cm absces retroperitonea při resekční linii pankreatu. EUS navigovaná drenáž abscesu byla provedena z vitální indikace při nevysaditelné duální antiagregaci a progredujícím septickém stavu (obr. 4).
Poslednímu pacientovi v souboru byla v květnu 2018 zavedena EUS-GE (EUS navigovaná gastroenterostomie) pro stenózu duodena jako následek fibrotizace po těžké nekrotizující pankreatitidě proběhlé v listopadu 2017. Pacient neprospíval i při enterální výživě, perkutánní gastrostomie odváděla odpady 8–10 l tekutin denně. Výživovou jejunostomií byla naplněna vodou tenká klička naléhající k žaludku a jednokrokově, přímou metodou byl zaveden stent.
Všechny výkony byly prováděny na rentgenovém (RTG) sále lineárním echoendoskopem (GF-UCT 180, Olympus Medical Systems) s ultrazvukovou jednotkou EU – ME 2 (Olympus Medical Systems) s insuflací oxidem uhličitým jako prevencí vzduchové embolie. Ve všech případech byly použity ECE-LAMS typu Hot AXIOS (Xlumena Inc., Boston Scientific). Výběr velikosti stentu závisel na typu drénované struktury a individuální úvaze provádějícího lékaře. K drenáži tekutinových kolekcí byly voleny vždy stenty o max. dostupném vnitřním průměru, min. 10 mm.
Postup zavedení stentu závisel na dostupnosti drénované struktury. Seldingerova metoda s vodičem byla volena jako pokračování výkonu po neúspěšném pokusu o rendez vous ERCP nebo k bezpečnému zavedení stentu v obtížné pozici. Vždy byla použita 19G aspirační jehla a vodič šíře.035-inch. V ostatních případech byla preferována přímá, jednokroková metoda zavedení stentu bez RTG kontroly. Pálicí jednotka (ERBE ICC 200 EA) byla nastavena v modu čistý, řezací proud, výkon 100 W.
Všechny výkony byly provedeny ve cloně širokospektrých ATB s následným podáváním po dobu 5 dní (pokud nebyl jiný důvod pro delší podávání ATB). Obligátně asistoval anesteziologický tým. Endotracheální intubace byla použita při předpokladu déle trvajícího výkonu (plánované rendez vous ERCP) nebo jako prevence aspirace při drenáži objemné tekutinové kolekce. Pro volbu anestezie byla vždy rozhodující celková kondice pacienta. V případě hraniční kardiopulmonální kompenzace a předpokladu krátkodobého výkonu byla drenáž prováděna jen v analgosedaci (např. akutní cholecystitis).
Výsledky
Soubor 20 pacientů zahrnoval 17 mužů a 3 ženy, věkový průměr činil 66 let (rozmezí 37–85 let). Z hlediska drénované struktury byla provedena 7× drenáž tekutinové kolekce, 6× drenáž žlučníku, 6× přístup do ductus choledochus a 1× GE (tab. 2).
Technická úspěšnost zavedení stentů byla 100 %. V žádném případě nebylo nutno změnit strategii drenáže jiným přístupem. Ve více než 2/3 případů byl ECE-LAMS zaváděn přímou metodou jednokrokově, bez radiologické asistence. Seldingerova metoda byla použita 3× jako pokračování výkonu po neúspěšném rendez vous ERCP a 3× k bezpečnému zavedení stentu při suboptimální pozici.
Bezprostředně po zavedení stentu se vyskytly dvě s výkonem spojené komplikace, tj. 10 %. V jednom případu choledocho-duodenostomie jsme zaznamenali malpozici distálního konce stentu. Komplikace byla řešena zavedením zajišťujícího plastového DPS (double pig tail stentu) přes metalický stent (koaxiální plastová drenáž). Stomie byla dále funkční a nedošlo k rozvoji odložených komplikací. Ve 2. případu se objevilo po zavedení LAMS mírné venózní krvácení z dutiny pseudocysty o velikosti 6 cm. Krvácení během výkonu spontánně ustalo, byl zaveden koaxiální DPS jako prevence obturace metalického stentu. Další den pacientka vyzvrátila cca 100 ml sražené krve, byla oběhově stabilní a bez poklesu v červeném krevním obraze. U žádného výkonu nedošlo k volné perforaci a nevyskytla se komplikace ze vzduchové embolie.
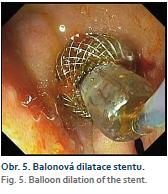
Balonová dilatace vnitřního lumen LAMS byla provedena 5× (CRE dilatační balon, Boston Scientific) z důvodu 3× hutného obsahu kolekce (WON, absces), 1× choledocholitiáza a 1× GE (obr. 5). Zajišťující koaxiální DPS jsme zavedli v 8 případech (2× řešení bezprostřední komplikace po zavedení LAMS, 4× do všech PPC a WON a 2× do hutného obsahu žlučníku).
Klinická úspěšnost drenáží činila 95 % (19/20). U jednoho pacienta došlo k úmrtí 8 dní po choledocho-duodenostomii při maligní diagnóze pokročilého tumoru hlavy pankreatu. Pacient byl extramurální a dle dokumentace bez klinických projevů akutní komplikace související s výkonem. V laboratoři byl zjištěn jen nevýznamný pokles hladiny bilirubinu. Při terapii opiáty pro základní diagnózu došlo k exitu pod obrazem hypostatické pneumonie 8. den po výkonu. Tuto situaci hodnotíme jako nefunkční drenáž, úmrtí bez souvislosti s výkonem.
Během 7 dní došlo u všech zbývajících pacientů k ústupu klinických obtíží a laboratorní odezvě v závislosti na indikaci, GE byla funkční. Tři ze čtyř peripankreatických kolekcí a všechny abscesy se během drenáže kompletně vyprázdnily a v následujících 30 dnech nedošlo k recidivě. U jednoho PPC o velikosti 20 cm zasahujícího do malé pánve bylo patrné po extrakci stentu malé, podélné reziduum, proto bylo pokračováno plastovou drenáží.
Stenty z peripankreatických kolekcí byly extrahovány průměrně za 3,8 týdne (rozmezí 2–7 týdnů), z abscesových kolekcí za 7 týdnů (rozmezí 4–9 týdnů). Extrakce byla vždy prováděna kleštěmi typu „krysí zub“. Konstrukce stentů Hot AXIOS je měkká a ohebná a po extrakci nedošlo ke krvácení ze stomického kanálu (a to ani u pacienta na plné duální antiagregaci) a nedošlo k poranění stěny trávicí trubice v anatomických zúženích. Nevyskytlo se odložené krvácení na podkladě vzniku pseudoaneuryzmatu nebo aroze cévy.
U biliárních drenáží se vyskytla jedna pozdní komplikace po 46 dnech (5 %). Obturace stentu (clogging) hlenovou zátkou s projevy akutní cholangoitidy byla vyřešena endoskopicky jedním výkonem. Ve sledovaném období se nevyskytla žádná migrace stentu nebo biliární leak. U pacientky s kombinací adenomu duodena s choledocholitiázou byl při kontrole po 14 dnech zaznamenán téměř kompletní, spontánní odchod litiázy. Dále bylo pokračováno rendez vouz ERCP cestou ECE-LAMS se zavedením plně potahovaného metalického biliárního stentu (FCSEMS – fully covered selfexpandable metal stent) jako definitivní řešení průchodnosti infiltrované papily a prevence sump syndromu. Oba stenty byly ponechány a po 234 dnech (nejdelší interval zavedení) je pacientka bez obtíží.
Průměrná doba zavedení všech stentů bez ohledu na indikaci činila 84 dní (rozmezí 8–234 dní). U pacientů s maligní diagnózou zůstaly stenty zavedeny až do data úmrtí, v průměru 103 dní (rozmezí 8–191 dní). Celkem á z 9 pacientů v souboru zemřelo při progresi maligního onemocnění. Na konci sledovaného období mělo 5 pacientů zavedený ECE-LAMS (1× maligní diagnóza, 2× definitivně po akutní cholecystitidě, 1× definitivně u choledocholitiázy a 1× EUS-GE).
Diskuze
Zhodnocením našeho souboru jsme ověřili vysokou technickou a klinickou úspěšnost EUS navigovaných drenáží pomocí ECE-LAMS. Výsledky odpovídají obdobným publikovaným studiím. Technická úspěšnost činila v našem souboru 100 %, klinická úspěšnost 95 %. Vyskytly se dvě s výkonem spojené komplikace (10 %) – malpozice stentu a mírné krvácení. Reintervencí jsme řešili jednu pozdní komplikaci – cholangoitidu způsobenou obturací stentu. Jedná se o první publikovaný soubor tohoto typu v ČR. Jeho limitací je heterogenita indikací.
Z hlediska přístupu k řešení peripankreatických kolekcí jsou EUS navigované drenáže považovány za metodu volby. Dle revidovaných Atlanta kritérií z roku 2012 jsou definovány tyto kolekce po více než 4 týdnech od ataky pankreatitidy jako pankreatické pseudocysty (po edematózní pankreatitidě) a WON (po nekrotizující pankreatitidě). Drenáž je indikována jen v případě symptomů (bolest, gastric outlet syndrom, infekce, obstrukce žlučových cest, dlouhodobé neprospívání pacienta). Pseudocysty menší než 4 cm by neměly být drénovány.
EUS intervence má v případě peripankreatických kolekcí stejnou efektivitu jako chirurgický a perkutánní přístup. Ve srovnání s chirurgickým přístupem má nižší počet komplikací a nižší morbiditu. Perkutánní přístup je zatížen větším rizikem vzniku perkutánní fistuly, horší kvalitou života z externí drenáže a nutností častější reintervence. Perkutánní přístup je nadále doporučen u kolekcí v malé pánvi, u kolekcí nedostupných EUS a v případě nutnosti intervence u infikované kolekce v intervalu kratším než 4 týdny od ataky pankreatitidy [6].
Efektivita drenáží peripankreatických kolekcí plastovými a metalickými stenty je srovnatelná. Dle studie Brimhalla et al srovnávající retrospektivně efektivitu drenáží u 249 pacientů pomocí LAMS versus DPS byl technický a klinický úspěch 92,8 vs. 90 %, resp. 97 vs. 96 %. U LAMS se vyskytovalo častěji krvácení z pseudoaneuryzmatu, u DPS bylo více perforací [7]. Rinninella et al v retrospektivní studii s ECE-LAMS u peripankreatických kolekcí referoval taktéž vysokou efektivitu a bezpečnost s pouze 5,4 % závažných komplikací [8].
Dle studie Siddiqui et al měly LAMS signifikantně nižší počet následných procedur do vyřešení WON ve srovnání s FCSEMS a DPS [9]. Drenáže metalickými stenty jsou technicky jednodušší a časově méně náročné, ale podle recentních studií mohou být zatíženy větším rizikem závažného, odloženého krvácení z aroze cév nebo vzniklého pseudoaneuryzmatu [9–11].
Podle recentních ESGE doporučení z roku 2018 by měla být provedena jako první intervenční metoda u infikované WON endoskopická nebo perkutánní drenáž v závislosti na lokalizaci struktury a dostupnosti metody. LAMS by měly být extrahovány do 4 týdnů jako prevence se stentem souvisejících komplikací [12]. Diskutována je vhodnost zavedení koaxiálního plastového stentu do metalického stentu jako prevence migrace a krvácení [13]. Zavedení nazocystického drénu není arbitrárně stanoveno a je prováděno podle zkušeností jednotlivých pracovišť.
Dle našich zkušeností je zavedení plastové drenáže u PPC ve srovnání s LAMS levnějším, ale technicky složitějším přístupem. Použití LAMS při řešení PPC jsme volili v případech předpokládané obtížné drenáže (nepříznivá pozice PPC nebo riziko krvácení z varikózních pletení po balonové dilataci). Při řešení WON používáme LAMS o nejširším dostupném vnitřním průměru. Na podzim 2018 je očekávána dostupnost stentu o šíři 20 mm. Do všech drenáží peripankreatických kolekcí zavádíme koaxiální DPS jako prevenci krvácení a obturace stentu. Nazocystický drén zároveň k DPS již nepřidáváme.
Drenáže postchirurgických abscesů pomocí LAMS referoval recentně Mudireddy et al u 47 pacientů taktéž jako účinnou a bezpečnou alternativu perkutánních a chirurgických výkonů. Retrospektivní studie z 8 center popisuje přístup transgastrický (nejčastější), transduodenální a transrektální. Technický a klinický efekt metody byl 93, resp. 89 % [14].
V našem souboru publikujeme unikátní případ vyřešení postchirurgického abscesu u pacienta léčeného duální antiagregací časně po akutní koronární příhodě. V tomto případě se jednalo o nejbezpečnější možnost léčby. Chirurgický a perkutánní přístup by z našeho pohledu vystavil pacienta vyššímu riziku krvácení po výkonu. Při řešení postchirurgických abscesových kolekcí volíme primárně perkutánní přístup. Při jeho nedostupnosti pak zvažujeme přístup EUS nebo chirurgický.
EUS navigované drenáže žlučových cest představují rescue terapii při selhání ERCP. Příčinou neúspěchu ERCP může být selhání kanylace, nedostupná papila v infiltrátu nebo divertiklu, gastric outlet syndrom, změněná anatomie trávicího traktu a in situ zavedený duodenální stent.
V roce 2001 publikovali Giovannini et al první EUS navigovaná choledocho-duodenostomie (EUS CDS) plastovými stenty, které ale mají tendenci ke vzniku biliárního leaku a ucpávání stentů při jejich malém průměru. FCSEMS častěji migrují. Nová generace LAMS tyto komplikace eliminuje [15,16]. Kunda et al prezentují studii 57 pacientů s EUS-CDS pomocí LAMS u maligní distální biliární obstrukce, kde technická a klinická úspěšnost byla 98, resp. 94,7 %. S výkonem spojené komplikace činily 7 %. Referují 5× reintervenci, z toho 4× pro sump syndrom [17]. Obdobná studie, ale s použitím výhradně ECE-LAMS, byla prezentována japonskými autory Tsuchiya et al, kdy v 5 terciárních centrech bylo zavedeno 19 EUS-CDS s vysokou technickou i klinickou úspěšností, s výkonem spojené komplikace se vyskytly v 15,8 % [18]. Při srovnání délky procedury u obou těchto studií referovali Kunda et al procedurální čas 22,4 min a Tsuchiya et at v téměř 90 % případů čas výkonu pod 10 min.
Provedení EUS-CDS představuje z našeho pohledu technicky jednodušší metodu ve srovnání s rendez vous ERCP. Přesto EUS navigované drenáže žlučových cest vyžadují pokročilé dovednosti provádějícího experta v oblasti EUS a ERCP technik. Jako relativně častou technickou komplikaci jsme zaznamenali chybné rozvinutí distálního konce stentu. Ten se rozvine v prostoru mezi stěnou žlučovodu a duodena při opření zaváděcího konce stentu do protilehlé, vnitřní stěny žlučovodu. Z naší zkušenosti je minimální prostor pro bezpečné rozvinutí alespoň 2 cm a distální konec stentu směřující k junkci.
Z technického hlediska je zajímavá „LAMS cesta“ zpřístupnění žlučových cest umožňující následné ERCP výkony. Toto bylo referováno v našem souboru u pacientky s mnohočetnou choledocholitiázou. V oblasti maligních indikací pro EUS-CDS prezentoval prof. Varadarajulu v Praze v květnu 2018 pozoruhodnou vizi. Nastínil možnost provádění EUS-CDS v případě inoperabilní, distální obstrukce žlučových cest v jedné době s diagnostickým EUS. EUS-CDS je pak definitivním endoskopickým řešením stavu.
EUS navigovaná cholecystostomie (EUS GBD) je indikována jako alternativa perkutánního přístupu u inoperabilních pacientů s akutní cholecystitidou a dále jako dekomprese hydropsu žlučníku při maligní obstrukci ductus cysticus po selhání ERCP drenáže. Laparoskopická cholecystektomie nadále zůstává metodou volby u akutní cholecystitidy. Tradiční perkutánní cholecystostomie má ve srovnání s LAMS stejnou účinnost i počet komplikací. Vnitřní drenáž je pro pacienta komfortnější [19]. Recentní studie Dollhopfa et al prokazuje efektivitu ECE-LAMS u pacientů s akutní cholecystitidou přes 90 %. Všechny komplikace dosahovaly 10,7 % (3 rekurující cholecystitidy, 2 migrace stentu a 1 Bouveretův syndrom) [20].
V klinické praxi představuje perkutánní drenáž stejně efektivní, ale cenově výrazně příznivější postup. V případě dočasné drenáže u inoperabilní, akutní cholecystitidy je perkutánní přístup opodstatněný. Na druhou stranu vnitřní drenáž výrazně zvyšuje kvalitu života pacienta. V našem souboru prezentujeme EUS-GBD u 4 pacientů s maligním hydropsem žlučníku s délkou zavedení, resp. přežití 2–7 měsíců. Z technického hlediska podotýkáme, že pokud je indikováno EUS-GBD jako přemosťující výkon do operace, měl by být preferován transgastrický přístup oproti transduodenálnímu.
EUS-GE představují alternativu chirurgického bypassu a enterálního stentu při řešení gastric outlet syndromu. Recentní multicentrická, retrospektivní studie ze 7 severoamerických a 1 evropského centra prezentuje 74 případů EUS-GE. Studie srovnává efektivitu přímé a balonem asistované EUS-GE, kdy u obou přístupů dosáhl technický i klinický úspěch přes 90 %. Významně kratší byl průměrný čas procedury provedené přímou metodou, tj. 35,7 vs. 89,9 min. Komplikace spojené s výkonem byly zaznamenány v 6,8 %. Všechny se týkaly chybného rozvinutí stentu do peritonea. Komplikace byly vyřešeny 4× přestentováním a 1× chirurgicky [21]. V našem souboru je prezentována první úspěšně provedená EUS-GE v ČR metodou přímého zavedení u pacienta se stenózou duodena na podkladě fibrotizace po nekrotizující pankreatitidě.
EDGE indikované u pacientů s Roux en-Y gastric bypassem nebylo v ČR publikováno.
Z technického hlediska představují drenáže metalickými stenty dle našich zkušeností výrazné zjednodušení výkonu pro provádějícího endoskopistu. Při jednokrokovém zavedení stentu se také snižuje expozice radiačnímu záření. Referovaná bezpečnost a vysoká technická a klinická úspěšnost dosahující ve studiích přes 90 % jsou perspektivní pro budoucí využití. Rozšíření těchto přístupů v současnosti brání vysoká cena akcesoria a absence zařazení metody do systému úhrad.
EUS navigované drenážní výkony pomocí ECE-LAMS jsou stále více používány jako alternativa intervenční radiologie a chirurgie. Představují bezpečnou a efektivní metodu se širokým spektrem možných indikací. Pro standardizaci postupů budou nutná data z prospektivních multicentrických studií.
Autoři J. Pintová a R. Procházka deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy. Spoluautor V. Nosek je konzultantem firmy Boston Scientific.
The authors J. Pintová a R. Procházka declare they have no potential conflicts
of interest concerning drugs, products,
or services used in the study. Coauthor V. Nosek is the cunsultant of the Boston Scientific company.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Doručeno/Submitted: 26. 6. 2018
Přijato/Accepted: 2. 8. 2018 MUDr. Jiřina Pintová
Gastroenterologické oddělení
Nemocnice Jablonec nad Nisou, p. o.
Nemocniční 4446/15
466 01 Jablonec nad Nisou
jirina.pintova@nemlib.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Stier MW, Waxman I. Lumen-apposing metal stents: which one and why? Gastrointest Endosc Clin N Am 2018; 28 (2): 207–217. doi: 10.1016/j.giec.2017.11.008.
2. Bank JS, Adler DG. Lumen apposing metal stents: A review of current uses and outcomes. Gastrointestinal Intervention 2017; 6 (1): 9–14. doi: 10.18528/gii160033.
3. Bang JY, Varadarajulu S. How the experts do it: step-by-step guide. Gastrointest Endosc Clin N Am 2018; 28 (2): 251–260. doi: 10.1016/j.giec.2017.11.011.
4. Amateau SK, Freeman ML. Avoidance, recog-nition, and management of complications associated with lumen-apposing metal stents. Gastrointest Endosc Clin N Am 2018; 28 (2): 219–231. doi: 10.1016/j.giec.2017.11.009.
5. Binmoeller KF, Nett A. The evolution of endoscopic cystgastrostomy. Gastrointest Endosc Clin N Am 2018; 28 (2): 143–156. doi: 10.1016/j.giec.2017.11.003.
6. Giovannini M. Endoscopic ultrasound-guided drainage of pancreatic fluid collections. Gastrointest Endosc Clin N Am 2018; 28 (2): 157–169. doi: 10.1016/j.giec.2017.11.004.
7. Brimhall B, Han S, Tatman PD et al. Increased incidence of pseudoaneurysm bleeding with lumen-apposing metal stents compared to double pigtail plastic stents in patients with peripancreatic fluid collections. Clin Gastroenterol Hepatol 2018. In press. doi: 10.1016/j.cgh.2018.02.021.
8. Rinninella E, Kunda R, Dollhopf M et al. EUS-guided drainage of pancreatic fluid collections using a novel lumen-apposing metal stent on an electrocautery-enhanced delivery system: a large retrospective study (with video). Gastrointest Endosc 2015; 82 (6): 1039–1046. doi: 10.1016/j.gie.2015.04.006.
9. Siddiqui AA, Kowalski TE, Loren DE et al. Fully covered self-expanding metal stents versus lumen-apposing fully covered self-expanding metal stent versus plastic stents for endoscopic drainage of pancreatic walled-off necrosis: clinical outcomes and success. Gastrointest Endosc 2017; 85 (4): 758–765. doi: 10.1016/j.gie.2016.08.014.
10. Bang JY, Hasan M, Navaneethan U et al. Lumen-apposing metal stents (LAMS) for pancreatic fluid collection (PFC) drainage: may not be business as usual. Gut 2017; 66 (12): 2054–2056. doi: 10.1136/gutjnl-2016-312812.
11. Lang GD, Fritz C, Bhat T et al. EUS-guided drainage of peripancreatic fluid collections with lumen-apposing metal stents and plastic double-pigtail stents: comparison of efficacy and adverse event rates. Gastrointest Endosc 2018; 87 (1): 150–157. doi: 10.1016/j.gie.2017.06.029.
12. Arvanitakis M, Dumoceau JM, Albert J et al. Endoscopic management of acute necrotizing pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) evidence-based multidisciplinary guidelines. Endoscopy 2018; 50 (5): 524–546. doi: 10.1055/a-0588-5365.
13. Puga M, Consiglieri CF, Busquets J et al. Safety of lumen-apposing stent with or without coaxial plastic stent for endoscopic ultrasound-guided drainage of pancreatic fluid collections: a retrospective study. Endoscopy 2018. In press. doi: 10.1055/a-0582-9127.
14. Mudireddy PR, Sethi A, Siddiqui AA et al. EUS-guided drainage of postsurgical fluid collections using lumen-apposing metal stents: a multicenter study. Gastrointest Endosc 2018; 87 (5): 1256–1262. doi: 10.1016/j.gie.2017.08.011.
15. Boulay BR, Lo SK. Endoscopic ultrasound-guided biliary drainage. Gastrointest Endosc Clin N Am 2018; 28 (2): 171–185. doi: 10.1016/j.giec.2017.11.00.
16. Khashab MA, Levy MJ, Itoi T et al. EUS guided biliary drainage. Gastrointest Endosc 2015; 82 (6): 993–1001. doi: 10.1016/j.gie.2015.06.043.
17. Kunda R, Pérez-Miranda M, Will U et al. EUS-guided choledochoduodenostomy for malignant distal biliary obstruction using a lumen-apposing fully covered metal stent after failed ERCP. Surg Endosc 2016; 30 (11): 5002–5008. doi: 10.1007/s00464-016-4845-6.
18. Tsuchiya T, Teoh AYB, Itoi T et al. Long-term outcomes of EUS-guided choledochoduodenostomy using a lumen-apposing metal stent for malignant distal biliary obstruction: a prospective multicenter study. Gastrointest Endosc 2018; 87 (4): 1138–1146. doi: 10.1016/j.gie.2017.08.017.
19. Law R, Baron TH. Endoscopic ultrasound-guided gallbladder drainage. Gastrointest Endosc Clin N Am 2018; 28 (2): 187–195. doi: 10.1016/j.giec.2017.11.006.
20. Dollhopf M, Larghi A, Will U et al. EUS-guided gallbladder drainage in patients with acute cholecystitis and high surgical risk using an electrocautery-enhanced lumen-apposing metal stent device. Gastrointest Endosc 2017; 86 (4): 636–643. doi: 1016/j.gie.2017.02.027.
21. Chen YI, Kunda R, Storm AC et al. EUS-guided gastroenterostomy: a multicenter study comparing the direct and balloon-assisted techniques. Gastrointest Endosc 2018; 87 (5): 1215–1221. doi: 10.1016/j.gie.2017.07.030.