The small bowel failure - from parenteral nutrition to the bowel transplantation
Martin Oliverius1, Milan Dastych Orcid.org 2
+ Affiliation
Summary
SUMMARY
Oliverius M, Dastych M. The small bowel failure - from parenteral nutrition to the bowel transplantation
The small bowel failure is a situation when that is not able to provide a nutrition of the organism. The causes of failure are different and the most common is a small bowel syndrom. The small bowel failure had been for many years a fatal condition. Introduction of the parenteral nutrition and its development enabled to survive to many patients. The wide development of the parenteral and later home parenteral nutrition has a result of perpetual increasing number of patients dependent on this type of treatment. The parenteral nutrition provide a standard care for bridging of acute state after short bowel failure appeared. The long term parenteral nutrition application is connected to increasing number of complications which limiting its permanent usage. Life threatening complication is a canule sepsis and thrombotic occlusion of canylated veins and subsequent loss of accesing ways. The other severe complication is a metabolic disorders with dominated liver injury. These complications are evaluated as a parenteral nutrition failure. A life threatening is imminent when these complications and the situations where adequate infusion therapy is not able to provide water and mineral support. The only solving of that problem is a small bowel transplantation. Although a small bowel transplantation was one of the first transplanted organs the first important failures due to increased number of antigen cummulation, lymphatic tissue and microbial contamination which prevented to wide application of that therapy. The new immunosuppresive drugs and regimens during the end of last century made better the surivival of the grafts and patients and the results of the first year is similar to the results of transplanted parenchymal organs. The goal of this article is to summarise the complex view to problems of small bowel fialure, indication and basic principles article of parenteral nutrition and it complications and indication to small bowel transplantation.
Key words: small bowel failure - parenteral nutrition - bowel transplantation.
ÚVOD
Tenké střevo má v organismu mnoho funkcí. Základní funkcí je příjem a zpracování potravy ve smyslu digesce a absorpce. Kromě toho se významně podílí na hospodaření s vodou a minerály. Po dutině ústní a žaludku představuje orgán podílející se významnou měrou na obraně organismu před vnějšími vlivy. Co do množství lymfatické tkáně je střevo považováno za největší imunitní orgán v organismu s vysokým podílem imunitní tkáně (GALT - gut-associated lymphoid tissue). Selhání střeva zejména v oblasti zajištění výživy ohrožuje integritu celého organismu. Zavedení infuzní léčby a následně parenterální výživy představuje přelomový moment umožňující přežívání většiny pacientů. Postupný přechod k domácí parenterální výživě velmi významně zlepšuje jejich kvalitu života. Intenzivní vývoj na poli nutričních preparátů a trvale se zlepšující znalosti týkající se parenterální výživy vedou k narůstajícímu počtu takto léčených lidí. Nutnost trvale zavedeného katétru má za následek vznik komplikací, se kterými se setká prakticky každý pacient. Nepřítomnost enterohepatálního oběhu a přímý vliv některých živin vede v průběhu času k poškození jaterních buněk a vzniku jaterní léze. Velmi krátké střevo má za následek excesivní ztráty tekutin a minerálů, které nelze adekvátně hradit. To vše jsou stavy, které shrnujeme pod pojem selhání parenterální výživy. V této situaci je jediným život zachraňujícím výkonem transplantace tenkého střeva.
SELHÁNÍ STŘEVA A SYNDROM KRÁTKÉHO STŘEVA
Kritická porucha funkce tenkého střeva je vnímána jako selhání střeva. Ta může být akutní nebo chronická, dočasná či trvalá. Existuje mnoho definic charakterizujících selhání střeva, ale žádná přesně nepostihuje složitost celé problematiky. Selháním střeva rozumíme kritickou redukci funkční střevní tkáně nutné k zajištění adekvátní digesce a absorpce živin nezbytných pro potřeby organismu a zároveň udržení minerálové a vodní rovnováhy. O selhání střeva, neslučitelném se životem, lze obecně hovořit tehdy, pokud střevo není schopno zajistit více jak 75 % absorpce živin(1,2).
Nejčastějším důvodem k selhání střeva je jeho fyzická ztráta. To má za následek syndrom krátkého střeva ve vlastním slova smyslu. K selhání střeva ale může dojít vlivem závažné poruchy funkce při zachované délce přítomného střeva. Nejčastěji je to z důvodu poruch motility v důsledku postižení autonomních nervových plexů (příkladem mohou být povšechná visceralní myopatie a/nebo neuropatie, úplná střevní aganglionóza apod.). Poslední příčinou střevní insuficience jsou poruchy funkce střevní sliznice ve smyslu zhoršené absorbce (např. specifické střevní záněty, zejména Crohnova choroba, vzácné onemocnění microvillus inclusion disease, selektivní autoimunitní enteropatie, poradiační enteritis).
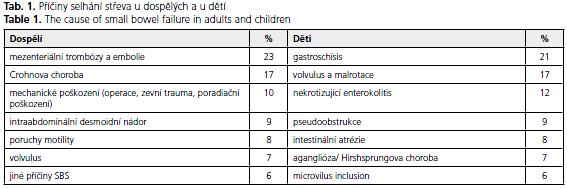
Příčiny ztráty tenkého střeva se svým zastoupením liší u dospělých a u dětí. Zatímco u pediatrických pacientů se nejčastěji setkáváme s gastroschízou či volvulem, u dospělých jednoznačně převažují cévní katastrofy, následované pooperační, postraumatickou nebo poradiační ztrátou střeva. Příčiny selhání střeva a jejich percentuální zastoupení shrnuje tabulka 1.
Nejčastější příčinou selhání střeva je vlastní syndrom krátkého střeva v důsledku jeho ztráty. Pro další osud pacienta je rozhodující několik faktorů. Tím nejdůležitějším je pochopitelně rozsah. Dalším faktorem, který má význam pro adaptaci střeva a případnou trvalou závislost na umělé výživě, je místo postižení (jejunum nebo ileum) a přítomnost či nepřítomnost Bauhinské chlopně a tlustého střeva s konečníkem. Z praktického hlediska lze rozsah resekce rozdělit na resekce ponechávající více jak 50 % tenkého střeva, velké resekce, po kterých zůstává jen 20-50 % kliček, a extenzivní resekce, u kterých nezůstává více jak 20 % střeva. Velké a extenzivní resekce mívají pravidelně za následek selhání střeva. Spolehlivým neinvazivním markerem posouzení velikosti zbylé střevní masy a její funkce je hladina sérového citrulinu(3). Citrulin je aminokyselina, která není součástí proteinů a je téměř exkluzivně produkována enterocyty střevní sliznice. Jejím hlavním prekurzorem je glutamin. Téměř 80 % je v proximálních tubulech ledvin konvertováno na arginin. Z tohoto důvodu je nutno při hodnocení brát v úvahu renální funkce. Po ukončení dvouletého adaptačního procesu je hladina citrulinu pod 20 µmol/l vysoce prediktivní (s 92% senzitivitou a 90% specificitou) pro diagnózu chronického střevního selhání(4).
METABOLICKÉ DŮSLEDKY SELHÁNÍ STŘEVA
Po resekci střeva se setkáváme nejen s ovlivněním stavu výživy ve smyslu vzniku marantické podvýživy s možným rozvojem hypoalbuminémie při absolutním zmenšení resorpční plochy, ale i s dalšími patologickými stavy souvisejícími se ztrátou specifických funkcí střeva, resp. porušením střevní integrity. Metabolické dopady selhání střeva souvisejí jednak s časovým intervalem od provedení resekčního výkonu a jednak s typem a rozsahem resekce.
V akutním pooperačním období jsou pacienti ohroženi dehydratací a minerálovými rozvraty s deficity sodíku, draslíku, hořčíku a fosforu. V tomto období, trvajícím dva až čtyři týdny, jsou pacienti po střevních resekcích závislí na intravenózní (i.v.) substituci vody a krystaloidů. Zároveň je v tomto období využívána plná parenterální výživa, vzhledem k omezenému příjmu potravy a snížené resorpční kapacitě zbývajícího střeva, která redukuje ztrátu svalového proteinu a zlepšuje přežití(5). Dlouhodobá závislost na i.v. hydrataci nebo na částečné či plné parenterální výživě je dána rozsahem resekce a její správná indikace vyžaduje pravidelné sledování nemocných. Pacienti jsou většinou dlouhodobě nezávislí (po osmi týdnech od resekce) na i.v. hydrataci nebo PV při délce zbývajícího tenkého střeva více jak 150 cm(6). V období adaptace (do dvou let od resekce) a následně v období restituce a stabilizace se setkáváme s metabolickými komplikacemi, které souvisejí s místem a rozsahem střevní resekce. V případě resekce Bauhinské chlopně dochází k bakteriálnímu osídlení tenkého střeva se vznikem syndromu bakteriálního přerůstání (dekonjugace žlučových kyselin, malabsorpce tuků, spotřeba vitaminu B12, vitaminu K, průjem, meteorismus). Resekce více jak 60 cm specializovaného ilea vede k malabsorpci vitaminu B12 s nutností jeho parenterální substituce(7). Jestliže je resekováno méně jak 100 cm ilea, dochází k částečné malabsorpci solí žlučových kyselin. Jejich malabsorpce je kompenzována zvýšenou jaterní syntézou, emulgační schopnost žluči zůstává zachována a resorpce tuků je ovlivněna jen částečně (steatorea < 20 g/den). Malabsorbované žlučové kyseliny u pacientů se zachovalým tlustým střevem působí laxativně a vyvolávají tzv. cholereický průjem. Pokud je resekováno více jak 100 cm ilea, dochází k významné malabsorpci žlučových kyselin, jejich koncentrace ve žluči se snižuje, významně se horší emulgační schopnosti žluči a dochází k malabsorpci tuků se vznikem signifikantní steatorey (> 20 g/den) a malabsorpci v tucích rozpustných vitaminů (ADEK).
K pozdním komplikacím, vznikajícím v průběhu roků po střevní resekci patří následující stavy.
Nefrolitiáza se vyskytuje u více jak 25 % pacientů po resekci ilea se zachováním kolon vzhledem k sekundární hyperoxalurii(8). Ke zvýšené resorpci oxalátů dochází z důvodu malabsorpce žlučových kyselin, které vyvazují Ca2+ ve střevě, a nedochází tak k tvorbě nevstřebatelného kalcium oxalátu. Š»avelany se pak resorbují z tlustého střeva do oběhu.
Cholecystolitiáza vzniká u pacientů po resekci ilea. Ke zvýšení litogenity žluči dochází z důvodu snížení žlučové koncentrace solí žlučových kyselin, při jejich malabsorpci. Žluč je zvýšeně saturována cholesterolem, který snadno krystalizuje a dává vzniku cholesterolové litiáze.
D-laktátová acidóza vzniká u méně jak 5 % pacientů se zachovaným kolon. Podstatou vzniku je produkce D-kyseliny mléčné kvasnými procesy bakteriemi tlustého střeva při nadbytku přívodu sacharidů do kolon a střevní kvasné dysmikrobii. D-laktát působí jako falešný neurotransmiter a spolu se změnami acidobázické rovnováhy vyvolává klinický stav podobný ebrietě s různým stupněm poruchy vědomí.
Kostní choroba se u pacientů se syndromem krátkého střeva vyskytuje často a její příčina je multifaktoriální. Na jejím vzniku se podílí deficit vitaminu D, hořčíku, vápníku, snížená fyzická aktivita, hormonální změny a recidivující infekční komplikace v případě nutnosti dlouhodobé parenterální výživy(9,10).
ADAPTACE STŘEVA
V důsledku rozsáhlé střevní resekce nastává období střevní adaptace. To je charakterizováno hyperplazií buněk střevních krypt, prodloužením klků a zvětšení adsorpční schopností. Adaptační proces je multifaktoriální se zapojením mnoha humorálních faktorů (glucagon-like peptid 2, růstový hormon, insulin-like growth faktor 1 a 2, epidermální růstový faktor aj.) a odpovědí zárodečných buněk. Celá problematika byla popsána na řadě experimentálních zvířecích studií a přesahuje rozsah sdělení(11,12).
Proces adaptace střeva je ukončený v průběhu dvou let. Po tomto období nelze očekávat významnější změny. Celý proces významně zhoršuje přetrvávající celkově špatný stav, zejména septické fokusy, přetrvávající střevní píštěle a vyřazené úseky trávicího traktu, ve kterých dochází k dismikrobii a bakterielní translokaci. Jak jsme se opakovaně přesvědčili u mnoha našich pacientů, chirurgická intervence ve smyslu odstranění těchto ložisek spojená s rekonstrukcí trávicího traktu významně přispívá ke zlepšení stavu a urychlení adaptačního procesu a v některých případech může vést k částečné nebo úplné nezávislosti na parenterální výživě. Ke zlepšení situace lze využít chirurgické metody vedoucí ke zvýšení absorpční schopnosti střeva a zpomalení pasáže. Představují je různé prodlužující plastiky - např. STEP plastika nebo Bianchio plastika. Tyto metody jsou však spojeny se signifikantní morbiditou, a proto jsou indikovány v přísně selektivních případech(13,14).
PARENTERÁLNÍ VÝŽIVA (PV)
Zavedení PV do klinické praxe spadá do období druhé poloviny 20. století. Postupně byly vyvinuty stabilní roztoky glukózy, směsi aminokyselin a tukové emulze. V 50. letech minulého století byly standardizovány postupy zajištění vstupu do centrálního žilního řečiště (Aubaniac R. punkce v. subclavia 1952, Seldinger SI katetrizace po vodiči 1953) a PV se stala součástí léčebné péče. Postupnou optimalizací složení roztoků PV a vývojem biokompatibilních materiálů (silikon, polyuretan) bylo umožněno dlouhodobé podávání PV. První podání PV v domácích podmínkách se datuje mezi roky 1967-1968 (Dudrick, Shils, USA). Následovalo zavedení vaků All in One a vznikala centra poskytující domácí parenterální výživu jak v Evropě, tak v Americe. V České republice byla první domácí parenterální výživa podána M. Andělem a jeho kolektivem v roce 1992(14). Výše popsaný rozvoj PV umožnil přežívání pacientů po rozsáhlých resekcích střeva. Obecně lze říci, že po střevní resekci potřebují PV v pooperačním období všichni pacienti. Doba závislosti na PV se liší podle rozsahu střevní resekce a délky zbývajícího střeva, dále podle místa resekce a zachování kontinuity s tlustým střevem. Obecně lze říci, že dlouhodobou parenterální výživu nebudou pravděpodobně vyžadovat pacienti se zachováním 120-150 cm tenkého střeva při jejunostomii, při zachování 60-100 cm tenkého střeva a jejunotransversoanastomóze a pacienti s 30-60 cm terminálního ilea při zachování kolon a ileocekální chlopně. Je třeba ale zdůraznit, že v adaptačních schopnostech střeva jsou značné interindividuální rozdíly a pouze pravidelné sledování klinického stavu pacienta a laboratorních vyšetření umožní určit optimální složení a dobu podávání PV.
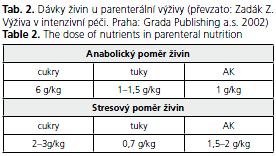
Složení PV u pacientů po střevní resekci vychází ze standardních pravidel provádění PV. V časném pooperačním období volíme vaky se stresovým poměrem živin s energetickou hodnotou 30-35 kcal/kg (tab. 2). K udržení vyrovnané bilance tekutin při velkých ztrátách do stomií využíváme běžné roztoky krystaloidů. Podávání glutaminu v časném pooperačním období může snížit výskyt septických komplikací, ale vliv na zlepšení funkční kapacity střeva a podporu střevní adaptace je stále diskutovaný(15). V následné anabolické fázi upravujeme složení vaků PV do anabolického poměru a dle aktuálního stavu výživy, časového vývoje tělesné váhy, délky zbývajícího střeva a množství perorálně přijaté potravy volíme energetickou hodnotu PV v širokém rozmezí hodnot 20-40 kcal/kg. Podle bilance tekutin upravujeme objem parenterálně podaných roztoků krystaloidů. V prevenci vzniku komplikací PV se osvědčilo cyklické podávání roztoků PV, střídání tukových a beztukových vaků, zachování perorálního příjmu a podávání ursodeoxycholové kyseliny(16). Pacienti po velkých střevních resekcích vyžadují dlouhodobé podávání PV. V České republice jsou pacienti s domácí PV soustředěni do center zabývajících se touto problematikou. V roce 2006 byla založena Pracovní skupina pro domácí parenterální výživu (PSDPV) sestávající z lékařů jednotlivých center. PSDPV vydává doporučené postupy provádění DPV, léčby nejčastějších komplikací a eviduje pacienty na DPV. Kontakty na jednotlivá centra provádějící DPV, doporučené postupy a další informace lze získat na stránkách www.dpv.skvimp.cz. Z registru pacientů na DPV se rekrutují adepti střevní transplantace.
KOMPLIKACE PARENTERÁLNÍ VÝŽIVY
Parenterální a zejména domácí parenterální výživa navzdory limitacím v sociálních a pracovních aktivitách představuje obrovský pokrok v léčbě pacientů se selháním střeva(5).
Bohužel tato léčba není bez rizika a zejména v průběhu dlouhodobého používání vede k významným komplikacím, které jsou pro pacienta limitující a život ohrožující. S postupujícími znalostmi a zdokonalováním přípravků PV ubylo těchto komplikací, přesto představují závažný problém znemožňující trvalé podávání. Na základě dlouhodobých zkušeností a studia literatury stanovil pittsburghský tým jako první definici selhání parenterální výživy, která se stala podkladem pro dokument Medicare k formulování hlavních indikací k transplantaci tenkého střeva(17). Kritéria selhání parenterální výživy jsou:
- 1. poškození jaterního parenchymu;
- 2. ztráta cévních přístupů;
- 3. mnohočetné katétrové infekce;
- 4. časté epizody závažné dehydratace navzdory adekvátnímu intravenóznímu hrazení.
Nejčastější komplikací dlouhodobé parenterální výživy je poškození jaterního parenchymu od prosté steatózy až po cirhózu jater se známkami jaterního selhání. Správně bychom měli tuto komplikaci označovat jako onemocnění jater způsobené podáváním domácí parenterální výživy (Home Parenteral Nutrition Associated Liver Disease - HPNALD). Výskyt HPNALD je až u 40-60 % dětí a 15-40 % dospělých pacientů, kteří vyžadují dlouhodobou parenterální výživu(18).
Patofyziologicky jde o interakci příčin způsobených složením podávané nutrice a klinickými projevy syndromu krátkého střeva. Z prvních jmenovaných jde zejména o hyperalimentaci zvláště při použití polynesaturovaných mastných kyselin (polyunsaturated fatty acids - PUFA). Z příčin souvisejících se stavem pacienta jde zejména o rozsah ztráty střeva a s ním související nepřítomnost enterohepatálního oběhu. Významnou roli zde hraje nepřítomnost ilea a chybění Bauhinské chlopně s kolon. K poškození jaterních buněk přispívá přítomnost terciárních nekonjugovaných „toxických“ žlučových kyselin. Nepochybně významnou roli sehrávají změny v mikrobiální flóře (přítomnost exkludovaných úseků střeva, chybění kolon s jeho mikroflórou, zvýšená bakteriální translokace apod.)(19).
Součástí tohoto multifaktoriálního řetězce je nepřítomnost některých gastrointestinálních hormonů, jako jsou gastrin, motilin, glukóza-dependentní inzulinotropní polypeptid, sekretin, pankreatický polypeptid, glukagon a vazoaktivní intestinální peptid(20).
Nejčastějšími klinickými projevy jaterní léze jsou elevovaný bilirubin, zvýšení jaterních testů, splenomegalie, trombocytopenie a koagulopatie. Na rozdíl od jiných pacientů s pokročilou jaterní lézí zde ale nemusí docházet ke vzniku ascitu a typickým komplikacím portální hypertenze ve smyslu gastroezofageálních varixů s krvácením pro nepřítomnost splanchnického řečiště a zaniklou dutinu břišní po četných chirurgických intervencích. Rozhodující pro diagnostiku je jaterní biopsie(21).
TRANSPLANTACE TENKÉHO STŘEVA
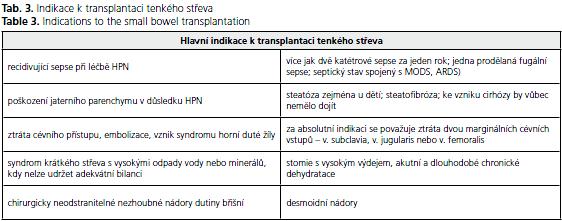
Transplantace tenkého střeva představuje poslední alternativu pro pacienty se selháním tenkého střeva, u kterých dojde k život ohrožujícím komplikacím parenterální výživy. Selhání parenterální výživy, tak jak bylo definováno v předchozí části, je hlavní indikací k transplantaci. Vzácnou indikací jsou některé nezhoubné chirurgicky neodstranitelné novotvary, které obvykle vyžadují multiorgánovou transplantaci(22,23). Indikace k transplantaci shrnuje tabulka 3.
Transplantace tenkého střeva v porovnání s ostatními transplantacemi solidních orgánů je mnohem náročnější díky silné expresi histokompatibilních antigenů, velkému množství přítomné lymfatické tkáně GALT a prezenci mikroorganizmů(24). Z historického hlediska patří střevo k prvním orgánům, u kterých byly prováděny pokusy za účelem jeho přenosu a náhrady. První pokusy se datují do období konce 60. let minulého století, kdy americký chirurg Richard Lillehai z Minnesoty provedl první transplantaci tenkého střeva u psa. První klinická transplantace střeva je přisuzována Ralphu Deterlingovi z Bostonu (1964). První tištěná zpráva přichází o pět let později. V roce 1988 provádí německý chirurg Deltz v Kielu první úspěšnou transplantaci tenkého střeva u člověka. Pacient přežíval 4 roky na plné perorální dietě s funkčním štěpem(25). Vlivem obrovského množství antigenů a přenesené lymfatické tkáně spolu s přítomnými bakteriemi jsou počátky transplantační aktivity spojeny s trvalými neúspěchy. Teprve zavedení imunosuprese v podobě cyklosporinu přineslo první dílčí úspěchy. Přesto v porovnání s trvale se zvyšující délkou dlouhodobého přežívání u ostatních transplantovaných parenchymatózních orgánů jsou výsledky po transplantaci střeva nepříznivé. Zatímco koncem 90. let se počet provedených transplantací za rok pohybuje kolem deseti, na přelomu tisíciletí dosahuje téměř stovky pacientů ročně.
Pětileté přežívání štěpů se pohybuje do roku 1995 mezi 30-40 %(26). Použití monoklonálních protilátek v indukční léčbě následované minimalizací imunosuprese na přelomu tisíciletí vedlo poprvé k dramatickému zlepšení a jednoroční přežívání pacientů po transplantaci střeva tak prvně dosáhlo výsledků srovnatelných s ostatními orgánovými přenosy. Přežívání štěpů v Pittsburghském centru v prvním roce dosahuje 90 %.
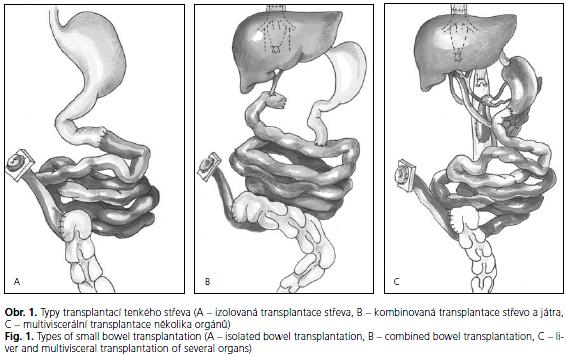
Podle rozsahu postižení je prováděna izolovaná transplantace tenkého střeva. U dětí je nejčastějším výkonem transplantace tenkého střeva spojená s transplantací jater vzhledem k již často přítomné ireparabilní jaterní lézi na podkladě TPN. V některých indikacích rozsáhlého postižení je prováděna transplantace multiviscerální, která zahrnuje kromě střeva a jater i žaludek a dvanáctník se slinivkou (obr. 1).
Zatímco chirurgická problematika transplantace tenkého střeva je prakticky vyřešena, imunosupresivní léčba prodělává stále bouřlivý rozvoj. Je zcela nepochybné, že celkový a zejména dlouhodobý úspěch tohoto složitého výkonu je z větší části vázán na správný způsob imunosuprese tak, aby se na jedné straně zabránilo odmítnutí štěpu příjemcovými imunitními mechanismy a na druhé straně nedošlo k úplnému potlačení imunity, které má za následek rozvoj infekčních komplikací.
V současné době je stěžejním lékem, který se v imunosupresi používá tacrolimus, (Prograf®, Astellas). Druhou hlavní modifikací z poslední doby, která byla zavedena do imunosupresivních režimů po transplantaci tenkého střeva je přidání antagonistů pro receptory IL-2 daclizumab (Zenapax®, Roche Pharmaceutical) a basiliximab (Simulect®, Novartis Pharmaceutical Corporation). Výsledky publikované poslední dobou jsou překvapující a tyto režimy mají za následek nejen dramatické zlepšení výsledků, ale i možnost redukce calcineurinových inhibitorů, a tím i jejich nežádoucích účinků.
Přelomovým okamžikem v imunosupresivní léčbě byla práce Starzla a kolektivu z University v Pittsburghu vycházející z principu navození tolerance mezi imunitním systémem dárce a příjemce(27). Tohoto principu je dosaženo podáním indukční léčby u příjemce, která vede k depleci lymfocytů jak v intravaskulárním prostoru, tak v oblasti lymfatické tkáně. Jedním z takových preparátů je králičí globulin proti T-lymfocytům (Thymoglobulin®, Sangstat Medical Corporation). Vysoké dávky tymoglobulinu v indukci s následnou monoterapii tacrolimem představuje nadějný typ nízkodávkované imunosuprese s dobrým výsledkem. Na stejném principu je založen protokol s monoklonální lidskou protilátkou - alemtuzumab (Campath-1H®, Berlex Laboratories, Montville). Tato humánní lidská protilátka přímo zaměřená proti panlymfocytárnímu markeru CD52, má za následek rapidní depleci T, B a NK lymfocytů až na 6 měsíců.
PŘEŽÍVÁNÍ A KVALITA ŽIVOTA
Jak již bylo naznačeno v předchozích kapitolách přežívání pacientů a štěpů po transplantaci tenkého střeva prodělalo velké změny, které jsou závislé na vývoji a používání nových imunosupresivních léků. Zatímco v prvopočátcích nedosahovalo dlouhodobé přežívání ani 50 %, výsledky zejména z posledních let referují o jednoletém přežívání dosahující 80-90 %. Kvalita života pacientů po úspěšné transplantaci je diametrálně odlišná. Ve většině případů se daří v průběhu 6 týdnů pacienty převést postupně na plnou perorální stravu. Jen nevelké procento z nich vyžaduje trvalejší nutriční podporu. Složitější je situace v raném dětském věku, kdy někteří malí pacienti se díky svému onemocnění v podstatě nikdy nenaučili jíst, a tak je jejich realimentace dlouhodobější. Přesto je kvalita života pacientů v porovnání s TPN významně lepší(28). Většina pacientů je schopna plné sociální a společenské rehabilitace s plným návratem do pracovního života(29).
Na základě multicentrických studií se ukazuje, že celkové výsledky transplantace velmi významně ovlivňuje celkový stav pacienta před transplantací. Významně horší přežívání mají pacienti odesílaní k transplantaci při hospitalizaci - vzhledem k jejich horšímu celkovému stavu - než pacienti, kteří jsou k výkonu přijímáni z domova(30). Z těchto důvodů by měli být pacienti odesíláni do transplantačního centra včas k vyšetření a stanovení vhodnosti indikace k transplantaci. To platí zejména pro dětské pacienty, jejichž úmrtnost na čekací listině je vůbec nejvyšší ze všech. K jaternímu poškození vyžadujícímu kombinovanou transplantaci jater a střeva by dle možnosti u dětí vůbec nemělo dojít.
ZÁVĚR
Syndrom krátkého střeva představuje závažné onemocnění postihující celkovou integritu organismu s bezprostředním ohrožením života. Díky úspěchům parenterální terapie je dnes možné většinu pacientů zachránit a zajistit jim významné prodloužení života se zachováním přijatelné kvality. Probíhá-li léčba v rámci center zabývajících se touto problematikou, lze dosáhnout významného snížení komplikací, které jsou s touto léčbou spojeny. Přesto se téměř každý pacient setká s některou komplikací spojenou s podáváním parenterální výživy. Přesně definované situace (recidivující septické stavy, mykotická infekce, ztráta více jak dvou hlavních cévních přístupů, jaterní poškození nebo neschopnost adekvátního hrazení vody a minerálů) shrnujeme pod pojmem selhání parenterální výživy. Všichni tito pacienti by měli být včas konzultováni s transplantačním centrem a v případě potvrzení diagnózy zařazeni na čekací listinu k transplantaci střeva. Současné výsledky přežívání pacientů po transplantaci jsou srovnatelné s přežíváním pacientů na dlouhodobé parenterální výživě. Vzhledem k trvalému nedostatku vhodných dárců, komplikovanosti a náročnosti celé problematiky je nezbytné, aby byli tito pacienti odesláni včas, dokud jim jejich celkový stav umožní zařazení na čekací listinu a podstoupení výkonu. Navíc jak ukazují celosvětové výsledky, včasné odeslání k transplantaci je spojeno s významně lepším přežíváním jak štěpů, tak pacientů.
Práce je součástí grantu IGA MZ ČR NR/88963/ 2006.
Literatura
- 1. Scott N, Irving M. Intestinal Failure - the clinical problem. Dig Dis 1992; 10(5): 249.
- 2. Irving M. Intestinal failure. J Gastroenterol Hepatol 2000; 15(Suppl): G26-29.
- 3. Crenn P, Messing B, Cynober L. Citruline as a biomarker of intestinal failure due to enterocyte mass reduction. Clin Nutr 2008; 27: 328-339.
- 4. Crenn P, Coudray-Lucas C, Thuillier F, Cynober L, Messing B. Postabsorbtive plasma citruline concentration is a marker of absorbtive enterocyte mass and intestinal failure in humans. Gastroenterology 2000; 119: 1496-1505.
- 5. Messing B, Crenn P, Beau P, Boutron-Ruault MC, Rambaud JC, Matuchansky C. Long-term survival and parenteral nutrition dependence in adult patients with the short bowel syndrome. Gastroenterology 1999; 117: 1043-1050.
- 6. Carbonnel, et al. The role of anatomic factors in nutritional autonomy after extensive small bowel resection. Journal of Parenteral and Enteral Nutrition 1996; 20: 275-280.
- 7. Jeejeebhoy KN. Short bowel syndrome: a nutritional and medical approach. Canadian Medical Association Journal 2002; 166: 1297-1302.
- 8. Nightingale JM, et al. Colonic preservation reduces need for parenteral therapy, increases incidence of renal stones, but does not change high prevalence of gall stones in patients with a short bowel. Gut 1992; 34: 1171-1176.
- 9. Sobotka L, et al. Basics in clinical nutrition. Praha: Galén, 2004; Short bowel syndrome in Bozzeti F, et al. Home parenteral nutrition. UK, CABI, 2006.
- 10. Dowling RH. Cellular and molecular basis of intestinal and pancreatic adaptation Scandinavian J Gastroenterol- Suppl 1992; 193: 64-67.
- 11. Tappenden KA. Mechanisms of enteral nutriet-enhanced intestinal adaptation. Gastroenterology 2006; 130(Suppl 1): S93-99.
- 12. Andres AM, Thompson J, Grant W, Botha J, Sunderman B, Antonson D, Langnas A, Sudan D. Repeat surgical bowel lengthening with the STEP procedure. Transplantation 2008; 85: 1294-1299.
- 13. Sudan D, Thompson J, Botha J, Grant W, Anton- son D, Raynor S, Langnas A. Comparison of intestinal lengthening procedures for patients with short bowel syndrome. Ann Surg 2007; 246: 593-601.
- 14. Andel M, Filip K, Brůcek P. Long-term home parenteral nutrition using a totally implanted cannulation system. Čas Lék čes 1992; 131: 395-398.
- 15. David H. Alpers. Glutamine: do the data support the cause for glutamine supplementation in humans? Gastroenterology 2006; 130: S106-S116.
- 16. Bozzeti F, et al. Home parenteral nutrition. UK, CABI, 2006. In Zadák Z. Výživa v intenzivní péči. Praha: Grada Publishing a.s. 2002.
- 17. Abu-Elmagd K, Bond G, Reyes J, Fung J. Intestinal transplantation: A coming of age. Advances in Surgery 2002; 36: 65-101.
- 18. Martin D, Ezzelarab M, Bond G, Reyes J, Mazariegos G, Abu-Elmagd K. Patient Profile and Candidacy for Intestinal Transplantation at the University of Pittsburgh Transplantation Proceedings 2002; 34: 1897-1898.
- 19. Messing B, Joly F. Guidelines for management of home parenteral support in adult chronic intestinal failure patients. Gastroenterology 2006; 130: S43-S51.
- 20. Greenberg G, Wolman S, Christofides N, Bloom SR, JeeJeedhoy KN. Effect of total parenteral nutrition on gut hormone release in human. Gastroenterology 1981; 80: 988-993.
- 21. Abu-Elmagd K. Intestinal Transplantation for Short Bowel Syndrome and Gastrointestinal Failure: Current Consensus, Rewarding Outcomes, and Practical Guidelines Gastroenterology 2006; 130: S132-S137.
- 22. Moon JI, Selvaggi G, Nishida S, Levi DM, Kato T, Ruiz P, Bejarano P, Madariaga JR, Tzakis AG. Intestinal transplantation for the treatment of neoplastic disease. J Surg Oncol 2005; 92: 284-291.
- 23. Tryphonopoulos P, Weppler D, Levi DM, Nishida S, Madariaga JR, Kato T, Mittal N, Moon J, Selvaggi G, Esquenazi V, Cantwell P, Ruiz P, Miller J, Tzakis AG. Transplantation for the treatment of intra- abdominal fibromatosis. Transplant Proc 2005; 37: 1379-1380.
- 24. Newell KA. Transplantation of the intestine: is it truly different? Am J Transplant 2003; 3: 1-2.
- 25. Deltz E, Schroeder P, Gebhardt A, et al. Successful clinical small bowel transplantation: report of a case. Clin Transplant 1989; 3: 89.
- 26. Intestinal Transplant Registry data. Available at: http://www.intestinaltransplant.org/.
- 27. Starzl TE, Murase N, Abu-Elmagd K, Gray EA, Shapiro R, Eghtesad B, Corry RJ, Jordan ML, Fontes P, Gayowski T, Bond G, Scantlebury VP, Potdar S, Randhawa P, Wu T, Zeevi A, Nalesnik MA, Woodward J, Marcos A, Trucco M, Demetris AJ, Fung JJ. Tolerogenic immunosuppression for organ transplantation. Lancet 2003; 361: 1502-1510.
- 28. Sudan D, et al. Quality of life after pediatric intestinal transplantation: the perception of pediatric recipient and their parents. Am J Transplant 2004; 4: 407-413.
- 29. Rovera GM, DiMartini A, Schoen RE, et al. Evolution of clinical intestinal transplantation improved outcome and cost effectiveness. Transplant Proc 1999; 31: 582.
- 30. Grant D, Abu-Elmagd K, Reyes J, et al. Report of the Intestine Transplant Registry: a new era has dawned. Ann Surg 2005; 241: 607-613.
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users