Nealkoholová steatóza pečene (NAFLD) a inzulínová senzitivita
Ivica Lazúrová Orcid.org , Emil Fraenkel1, Ingrid Dravecká Orcid.org
+ Affiliation
Summary
Summary
Lazúrová I, Fraenkel E, Dravecká L Non-alcoholic fatty liver disease (NAFLD) and insulin sensitivity
Non-alcoholic fatty liver disease (NAFLD) is recently evaluated as a most common cause of pathology liver biochemistry in western countries. Its variation - non-alhoholic steatohepatitis (NASH) is characterised by accumulation of fat into the liver and lobular hepatitis in liver histology. In then pathogenesis of NAFDL an insulin resistance plays the most important role as a non-dependent predictive risk factor for fatty liver and transition into NAFDL and liver fibrosis. The basic therapeutic option for NAFDL is to improve insulin sensitivity by weight reduction, lowering of dietary carbohydrates and insulin sensitisers administration. Metfor-min can lead to improvement of liver biochemistry but most studies of thiazolinindions can also improve liver histology as well.
Key words: insulin resistance - metformin - non-alcoholic fatty liver disease – thiazolidindion.
Úvod
Nealkoholové stukovatenie pečene, resp. steatóza (NAFLD - nonalcoholic fatty liver disease) sa v súčasnosti považuje za najčastejšiu príčinu náhodnej elevácie hepatálnych enzýmov v Európe a v USA. Jej prevalencia v populácii sa pohybuje od 3 do 24 %, pričom tesnejšie odhady udávajú výskyt od 6 do 14 %. Alarmujúce sú štatistiky z USA, kde je postihnutých asi 30 % dospelej populácie a približne 20 % detí(1).
V širšom slova zmysle NAFLD predstavuje klinicko-patologický syndróm, do ktorého sa radia viaceré klinické jednotky ako steatóza, steatohepatitída (nonalcoholic steatohepatitis - NASH) a hepatálna fibróza. V užšom zmysle sa pod skratkou NAFLD rozumie len steatóza pečene. Uvádza sa, že u 50 % chorých prechádza steatóza do steatohepatitídy (NASH), v 15 % do fibrózy a v 3 % prípadov je NAFLD príčinou hepatálneho zlyhania.
Nealkoholová steatohepatitída (NASH) je na rozdiel od steatózy charakterizovaná histologický okrem kumulácie tukov v pečeni aj lobulárnou hepatitídou, t. j. zápalovou aktivitou s lobulárnou distribúciou. Klinicky je charakterizovaná chronicky zvýšenými hladinami ALT v plazme pri súčasne negatívnej anamnéze abúzu alkoholu(2).
Hranica medzi NAFLD a NASH je histologická a doposiaµ nepoznáme exaktné biochemické alebo klinické ukazovatele prechodu do hepatitídy alebo fibrózy. V literatúre sú uvádzané viaceré prediktory, najčastejšie je to pomer AST/ALT > 1, hladiny niektorých cytokínov (tumor necrosis factor alpha -TNF-alfa, interleukín-6, tkanivový rastový faktor a ďalšie), hladiny feritínu a jedna práca poukazuje na takmer 100% senzitivitu plazmatickej hladiny hormónu dehydroepiandrosterónu (DHEA)(1-4).
NAFLD a metabolický syndróm
V doposiaµ publikovaných prácach je viacero údajov o veµmi tesnej asociácii NAFLD s príznakmi metabolického syndrómu. V štúdii Corteza-Pinta et al.(5) sa u chorých s NAFLD vyskytla obezita v 80%, artériová hypertenzia v 50 %, porucha glukózovej tolerancie, resp. diabetes mellitus 2. typu v 69 %, pričom inzulínová rezistencia bola dokumentovaná u 50 % chorých. V našom súbore 57 chorých s NAFLD dokumentovanou ultrasonografickým, resp. CT vyšetrením sme zistili obezitu v 70 %, hypertenziu v 44 % a inzulínová rezistencia definovaná ako zvýšený index HOMA nad 1,4 bola zistená až v 70 % prípadov (nepublikované údaje). Viacerí autori teda radia NAFLD medzi prejavy metabolického syndrómu, resp. ju považujú za hepatálny prejav metabolického syndrómu.
Na základe epidemiologických, ale aj viacerých experimentálnych a klinických štúdií sa v patogenéze NAFLD za hlavný faktor vzniku stukovatenia považuje inzulínová rezistencia. Je to stav, kedy normálna koncentrácia inzulínu nie je schopná vyvola» normálnu metabolickú odpoveď, resp. na jej vyvolanie je potrebná vyššia koncentrácia inzulínu. Na základe klinických štúdií boli potvrdené tieto nezávislé prediktívne ukazovatele ochorenia - hmotnos», vyjadrovaná ako body mass index (BMI), glykémia a inzulinémia nalačno a hodnota systolic-kého krvného tlaku (TK). Všetky uvedené prediktívne ukazovatele sú zároveň úzko spojené s metabolickým syndrómom(6,7).
Okrem inzulínovej rezistencie boli popísané aj ďalšie patogenetické faktory vzniku NAFLD, t.j. centrálny typ obezity, diabetes mellitus 2. typu a dyslipidémia, prevažne hypertriglyceridémia, t.j. faktory tesne naväzujúce na inzulínovú rezistenciu(4).
NAFLD a inzulínová rezistencia
Inzulínová rezistencia sa uplatňuje v patogenéze NAFLD a NASH dvojakým mechanizmom: pri vzniku samotnej steatózy, pri prechode NAFLD do NASH.
Inzulínová rezistencia a vznik NAFLD
Ako bolo uvedené vyššie, inzulínová rezistencia predstavuje základný patogenetický faktor vzniku steatózy, a to prostredníctvom ukladania voµných mastných kyselín do hepatocytov.
Enterocytmi absorbované lipidy sú vo forme chylomikrónov transportované lymfou do pečene a po ich rozštiepení na voµné mastné kysliny a glycerol sú ďalej po reesterifikácii prítomné vo forme tukových zásob organizmu. Počas hladovania sa vplyvom hormón senzitívnej lipázy stimulovanej katecholamínmi, glukagónu a rastového hormónu a v dôsledku inhibície inzulínom oxidujú v mitochondriách, alebo sú použité na syntézu triglyceridov, prípadne fosfolipidov a esterov cholesterolu.
V prípadoch, kedy množstvo voµných mastných kyselín prevyšuje množstvo potrebné k ich mitochondriálnej oxidácii, sú tieto akumulované v parenchýme pečene, čím dochádza k jej stukovateniu. To sa deje prevažne pri hyperinzulinémii, kedy je inzulinorezistentný hepatálny parenchým (tvorba voµných mastných kyselín v hepatocytoch), ale sú inzulinorezistentné aj periférne tkanivá - tukové a svalové (influx voµných mastných kyselín do pečene). Hlavným zdrojom intrahepatálneho tuku sú triglyceridy, ktoré tvoria 62-82 % celkového množstva tuku. Pri NAFLD je až 26 % tukov v pečeni tvorených lipogenézou de novo, zatiaµ čo v normálnej pečeni táto lipogenéza predstavuje len asi 5 %(4,6).
Bolo dokumentované, že inzulínová rezistencia je spojená s NAFLD nezávisle na hmotnosti, glukózovej tolerancii a distribúcii tuku. Niektoré práce totiž zaznamenali u pacientov s NAFLD a normálnym BMI podobný stupeň inzulínovej rezistencie, ako mali chorí s NAFLD a obezitou. Dokonca hyperinzulinémia a inzulínová rezistencia sa potvrdila v patogenéze NAFLD aj u chorých, ktorí ešte nemali poruchu tolerancie glukózy(5).
Inzulínová rezistencia a prechod NAFLD do NASH

V súčasnosti sa v literatúre uvádza niekolko mechanizmov, ktoré môžu potencova» prechod zo steatózy do hepatitídy, resp. hepatálnej fibrózy (tab. 1).
Oxidačný stres v hepatocytoch
Niektoré práce potvrdili, že voµné mastné kyseliny môžu indukova» hepatálny cytochróm CYP2E1, pri aktivácii ktorého sa uvoµňujú kyslíkové radikály schopné peroxidácie bunkových membrán, čo vedie k ich poškodeniu. Peroxidácia lipidov môže by» takto kµúčovým mechanizmom v patogenéze vzniku NASH(2).
Inzulínová rezistencia

Úloha inzulínovej rezistencie pri prechode NAFLD do hepatitídy, resp. fibrózy pečene sa predpokladala na základe údajov viacerých autorov, ktorí zistili podstatne závažnejší histologický obraz u chorých s NASH, a súčasným metabolickým syndrómom v porovnaní s chorými bez metabolického syndrómu(8).
Mechanizmus, ktorým môže zasahova» inzulínová rezistencia do vzniku NASH a fibrózy, je uvedený na obrázku 1.
Voµné mastné kyseliny, ktoré sa ukladajú v pečeni pri inzulínovej rezistencii, aktivujú tzv. proinflamačné adipocytokíny, ktoré majú schopnos» aktivova» zápalové reakcie s následným vznikom fibrotického tkaniva.
Adipocytokíny
Z cytokínov má najvýznamnejšiu úlohu adiponektín, pôsobiaci skôr protektívne v patogenéze NASH. Jeho hladiny negatívne korelujú s množstvom tuku a s inzulínovou rezistenciou a jeho nízke plazmatické hladiny boli potvrdené nielen u chorých s metabolickým syndrómom ale aj u pacientov s NASH. Zároveň nízka hladina adiponektínu odrážala v niektorých štúdiách prítomnos» nekroinflamácie, a tým sa spomínaný cytokín považuje za užitočný marker prechodu steatózy do NASH.
Opačnú úlohu hrajú ostatné, tzv. proinflamačné cytokíny, ktorých hladiny sú pri NASH a fibróze zvýšené. Medzi cytokíny najviac stimulujúce fibrogenézu patria: TNF-alfa, interleukín-6, transformujúci rastový faktor-beta a tkanivový rastový faktor.
V jednej štúdii bol zistený priamy vz»ah medzi hladinou tukového angiotenzínu a jeho inhibícia podávaním blokátorov angiotenzínových receptorov viedla k regresii fibrózy a zlepšeniu histologického nálezu u pacientov s NASH(6,9).
Zvýšené zásoby železa
Nadmerné množstvo železa v organizme môže by» taktiež jedným z mechanizmov prechodu steatózy do cirhózy. Znaky tzv. iron overload boli pozorované asi u 40 % pacientov s NASH, pričom zvýšená hladina feritínu podµa niektorých autorov ukazuje na riziko prechodu do fibrózy. Keďže zvýšená hladina feritínu sa podµa niektorých autorov považuje za marker inzulínovej rezistencie, predpokladá sa, že aj v tomto mechanizme bude ma» prioritnú úlohu práve znížená inzulínová senzitivita(2,4).
Genetické faktory
V súčasnosti je využitie poznatkov o genetike NAFLD a genetických faktoroch prechodu do NASH značne limitované, ak si uvedomíme, že je známych asi 400 génov zahrnutých do patogenézy tukového metabolizmu a viac než 400 génov, ktoré zasahujú do mechanizmu účinku inzulínu. Pravdepodobne viac než 23 génov je zahrnutých do patogenézy NASH. Zatiaµ možno hovori» o tzv. kandidátskych génoch, a to jednak vo vz»ahu k inzulínovej rezistencii (polymorfizmy angiotenzín-konvertujúceho enzýmu, polymorfizmu IRS1, G proteínu, angiotenzínu a pod.) a o kandidátskych génoch pre NASH (napr. polymorfizmus TNF-alfa). Táto oblas» je v posledných rokoch intenzívnym predmetom záujmu, avšak výsledky zatiaµ nepriniesli dôkaz o existencii zjavného genetického markera, ktorý by bol využiteµný v klinickej praxi.
Liečba NAFLD a NASH vo vz»ahu k inzulínovej rezistencii
V súčasnosti nie je známa účinná látka, ktorá by bola v plnom rozsahu efektívna z hµadiska prevencie progresie NAFLD do NASH a fibrózy. Keďže kµúčovým faktorom v patogenéze NAFLD je inzulínová rezistencia, liečba musí by» zameraná na zlepšenie inzulínovej senzitivity a elimináciu faktorov, ktoré ju zhoršujú. Základom je teda redukcia hmotnosti v prípade nadhmotnosti a obezity, aj keď samotný pokles hmotnosti neviedol v doterajších štúdiách k zlepšeniu histologického nálezu.
Ďalším dôležitým opatrením okrem redukcie hmotnosti je obmedzenie sacharidov v strave, ktoré vedie k poklesu inzulinémie, zlepšeniu inzulínovej rezistencie a redukcii triglyceridov(10). Medzi významné faktory redukujúce inzulínovú rezistenciu a zvyšujúce inzulínovú senzitivitu patrí fyzická aktivita, ktorá je pri NAFLD, na rozdiel od iných pečeňových ochorení, odporúčaná.
V posledných rokoch pribúdajú štúdie sledujúce vplyv tzv. inzulínových senzitizérov na regresiu steatózy, resp. steatohepatitídy.
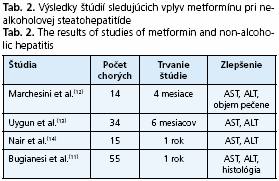
Biguanidy (metformín) redukujú výdaj glukózy pečeňou znižovaním glukoneogenézy. Doposiaµ boli publikované štyri štúdie zaoberajúce sa vplyvom metformínu na hladiny transamináz a histologický obraz NASH, všetky z nich dokumentujú zlepšenie hepatálnych enzýmov - AST a ALT a jedna z nich(11) dokumentovala aj zlepšenie histologického nálezu (tab. 2).
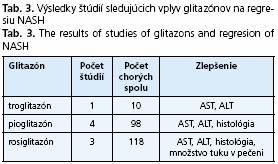
Novšou skupinou inzulínových senzitizérov sú tiazolidindióny, pôsobiace cestou aktivácie PPARgama receptorov v tukovom tkanive, kde znižujú uvoµňovanie mastných kyselín a TNF-alfa. Celkovo bolo publikovaných 8 štúdií, z toho 4 s pioglitazónom a 3 štúdie s rosiglitazónom. Výsledky všetkých potvrdzujú zlepšenie hepatálnych enzýmov, 2 štúdie s pioglitazónom a všetky 3 s rosiglitazónom dokumentovali aj zlepšenie histologického nálezu ako aj redukciu množstva hepatálneho tuku (tab. 3).
Z tohto aspektu sa inzulínové senzitizéry javia ako účinná terapeutická stratégia v liečbe NASH v súvislosti s inzulínovou rezistenciou(15,16).
Literatúra
- 1. Clark JM. The epidemiology of NAFLD in adults. J Clin Gastroenterol 2006; 40(Suppl 1): 17-29.
- 2. McCullough AJ. Pathophysiolog of nonalcoholic steatohepatitis. J Clin Gastroenterol 2006; 40 (Suppl 1): 17-29.
- 3. Choudburry J, Sanyal AJ. Insulin resistance in NASH. Front Biosci 2005; 10: 1520-1533.
- 4. Fraenkel E, Lazúrová I. Nealkoholová steatohepatití-da a inzulínová rezistencia. Interná medicína 2006; 11:606-611.
- 5. Cortez-Pinto H, et al. Nonalcoholic fatty liver: another feature of the metabolic syndrome. Clin Nutr 1999; 6: 353-358.
- 6. Roden M. Mechanisms of disease: hepatic steatosis in type 2 diabetes-pathogenesis and clinical relevance. Nat Clin Pract Endocrinol Metab 2006; 2(6): 335-248.
- 7. Utzschneider KM, Kahns SE. Review: The role of insulin resistance in nonalcoholic fatty liver disease. J Clin Endocrinol Metab 2006; 91(12): 4753-4761.
- 8. Amarapurka DN, et al. Nonalcoholic steatohepatitis (NASH) with diabetes: predictors of liver fibrosis. Ann Hepatol 2006; 5(1): 30-33.
- 9. Baranova A, et al. Gene expression of leptin, resistin and adiponectin in the white adipose tissue of obese patients with non-alcoholic fatty liver disease and insulin resistance. Obes Surg 2006; 16(9): 1118-1125.
- 10. Caldwell SH, Argo CK, Al-Osaimi AM. Therapy of NAFLD: insulin-sensitizing agents. J Clin Gastroenterol 2006; 40(Suppl 1): 61-66.
- 11. Bugianesi E, et al. A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease. Am J Gastroenterol 2005; 100(5): 1082-1090.
- 12. Marchesini G, Bábini M. Nonalcoholic fatty liver disease and the metabolic syndrome. Minerva Cardioangiol 2006; 54(2): 229-239.
- 13. Uygun A, et al. Metformin in the treatment of patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther 2004; 19(5): 537-544.
- 14. Nair S, et al. Metformin in the treatment of non-alcoholic steatohepatitis: a pilot open label trial. Aliment Pharmacol Ther 2004; 20(1): 23-28.
- 15. Belfort R, et al. A placebo controlled trial of pioglita-sone in subjects with nonalcoholic steatohepatitis. N Engl J Med 2006; 355(22): 2297-2307.
- 16. Wang Ch, et al. Safety and effectiveness of rosiglitasone in type 2 diabetes patients with nonalcoholic fatty liver disease. J Formos Med ssoc 2006; 105(9): 743-752.
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users