Bioeliminace v léčbě akutního selhání jater v experimentu na velkém laboratorním zvířeti
Miroslav Ryska1, Eva Kieslichová Orcid.org , Tomáš Pantoflíček Orcid.org , Ondřej Ryska Orcid.org 2, Eva Koblihová Orcid.org 3, Ekaterina Tcherentsová
+ Affiliation
Souhrn
Ryska M, Kieslichová E, Pantoflíček T, Ryska O, Koblihová E, Tcherentsová E. Bioeliminace v léčbě akutního selhání jater v experimentu na miniprasatech.
Úvod: V posledních letech dochází k rozvoji biologických i nebiologických eliminačních metod, které by umožňovaly efektivně léčit nemocného s akutním jaterním selháním (ASJ) v době, kdy čeká na transplantaci, či po dobu, než dojde ke spontánní regeneraci jaterního parenchymu.
Cíl studie: Zhodnotit účinek biologické eliminanační metody - perfúzi plazmy přes izolované živé hepatocyty (BAL = biologická »umělá játra«) u akutního selhání jater v experimentu na minipraseti.
Metodika: 10 miniprasat váhy 25-30 kg, u kterých jsme navodili ASJ chirurgickou devaskularizací jater s vytvořením portokavální anastomózy, jsme napojili na BAL. Měřili jsme hodnotu indikátorů ASJ včetně intrakraniálního tlaku. Výsledky jsme porovnali s dříve provedenou kontrolní skupinou miniprasat s ASJ bez léčby.
Výsledky: Při srovnání léčené a neléčené skupiny jsme pozorovali rozdíl pouze v sérových koncentracích bilirubinu, kdy ve 3. hodině ASJ byl statisticky významný (p < 0,05) v neprospěch skupiny s BAL (9,8 vs 17,7 mmol/l), v 6. a 9. hodině byl statisticky významný (p < 0,05) ve prospěch skupiny BAL (18,1 vs 13,1, 22,9 vs 13,2) a rozdíl hodnot ve 12. hodině byl statisticky nevýznamný (22,8 vs 16,2). Hodnoty intrakraniálního tlaku (ICP) ve skupině léčené BAL a ve skupině kontrolní se v průběhu experimentu statisticky významně nelišily.
Závěry: Prokázali jsme funkčnost zapojení eliminační metody - biologických »umělých jater« (BAL) - v perfúzi plazmy. Dosáhli jsme iniciální 85% viability čerstvých izolovaných prasečích hepatocytů a jejich přežívání po celou dobu, kdy byl bioreaktor použit k léčbě. Kromě koncentrace bilirubinu naše výsledky neprokázaly signifikantní změny hodnot laboratorních ukazatelů ASJ. Naměřené hodnoty nitrolebního tlaku se statisticky významně nelišily ve skupině s léčbou akutního selhání jater napojením na BAL a v kontrolní skupině.
Získané zkušenosti umožňují v experimentální práci s BAL pokračovat. Provedený experiment považujeme za studii pilotní.
Klíčová slova: akutní jaterní selhání - miniprase - bioartificial liver - monitorace - intrakraniální tlak.
Summary
Ryska M, Kieslichová E, Pantoflíček T, Ryska O, Koblihová E, Tcherentsová E. Bioartificial liver (BAL) in the treatment of experimental acute liver failure in minipigs
Introduction: During waiting time to liver transplantation or time for spontanoues regeneration of liver tissue for treatment of acute liver failure (ALF) the development of eliminatory methods of biologic or non-biologic origin has been established recently.
The aim of the study: Assesment of a biological eliminatory method of plasma perfusion over living hepatocytes - BAL (bioartificial liver) in acute liver failure in experiment on minipigs.
Methods: The model of acute liver failure caused by surgical liver devascularisation and portocaval by-passs was performed on 10 minipigs of 25-30 kg weight which were tretaed by BAL. Indicators of ALF and intracranial pressure (ICP) were measured. The results were compared to control group without treatment
Results: The diference was seen only in serum bilirubin level, when statistically significant difference was seen only in 3rd hour (p mensinez 0.05) favourable in a group of nontreated pigs (9.8 vs 17.7 mmol/l), in 6th and 9th hour (p mensinez 0.05) favourable for BAL group (18.1 vs 13.1, 22.9 vs 13,2 mmol/l) and the diference in 12th hour was not statistically significant (22.8 vs 16.2 mmol/l). ICP values in both groups were not statistically significant.
Conclusion: Our study proved the effectivity of eliminatory method - bioartificial liver (BAL) in plasma perfusion. 85% initial viability of fresh isolated porcine hepatocytes and their survival during the time of experiment when bioreactor was used has been established . Our results did not proved any significant changes of laboratory tests for ALF except serum bilirubin. Also ICP was not statistically significant different in both groups. Our experience enables to follow in BAL experimental work. Our experiment can be asessed as a pilot study.
Key words: acute liver failure - minipig - bioertificial liver - monitoring - intracranial pressure.
ÚVOD

Přežívání nemocných s akutním selháním jater (ASJ) dosahuje v závislosti na progresi encefalopatie a výskytu fatálních infekčních komplikací při konzervativní terapii pouhých 10-40 %(1). Ortotopická transplantace jater (TJ) je v současné době nejefektivnější metodou, která zlepšuje přežití nemocného s ASJ. V době, kdy pacient čeká na vhodného dárce jaterního štěpu, či během které může dojít nebo dochází k spontánní regeneraci jaterního parenchymu, je pacient akutně ohrožen na životě.
Současné možnosti, jak pacienta přes toto období převést (tzv. bridging), jsou limitovány. V posledních letech proto dochází k rozvoji biologických i nebiologických eliminačních metod, které by umožňovaly efektivnější bridging, a tím zlepšily šanci nemocného s ASJ přežít.
Jednou z možností, která byla vyzkoušena jak experimentálně(2,3), tak i klinicky(4,5,20-22), je použítí tzv. bioarteficiálních jater (BAL), která využívají perfúzi plazmy pacienta přes izolované živé hepatocyty.
Randomizovaná multicentrická studie provedená týmem profesora Demetrioua(6)s využitím BAL v léčbě ASJ prokázala potenciální léčebný benefit u nemocných s ASJ. Neprokázala však jednoznačný pozitivní léčebný dopad na prodloužení života nemocných s ASJ. Mnohými oponenty je poukazováno na nesourodost skupiny nemocných a malou zkušenost jednotlivých týmů, nesrovnatelnost kontrolní skupiny se skupinou s BAL(6). Obdobně vyznívá hodnocení ostatních provedených studií(7).
Cílem naší studie je seznámit čtenáře s vlastními počátečními zkušenostmi s bioreaktorem s izolovanými živými porcinními hepatocyty na vývoj ASJ v experimentu na velkém laboratorním zvířeti.
METODIKA

V experimentu jsme použili chirurgický model ASJ u miniprasete váhy 25-30 kg. Metodu, kterou jsme použili k vyvolání ASJ (provedení chirurgické devaskularizace jater s portokavální anastomózou, monitoraci hemodynamiky i laboratorních parametrů), jsme popsali v našich předchozích publikacích(8-11).
Izolace hepatocytů a naplnění bioreaktoru
Pro izolaci hepatocytů jsme zvolili metodu jaterní perfúze(12) s následnou centrifugací. Při odběru jater jsme vypreparovali a kanylovali portální žílu. Jaterní arterii jsme spolu s celým hepatoduodenálním ligamentem ligovali. Těsně před odběrem jsme punkcí vypustili obsah žlučníku. Játra jsme in vivo perfundovali celkem 4000 ml fyziologického roztoku o teplotě 37 °C.
Vyjmutá játra jsme postupně perfundovali třemi iontovými roztoky, pracovně nazvanými A, B, C, které byly syceny směsí karbogenu (95% O2 a 5% CO2). Jejich pH jsme následně upravili na 7,4. Perfúzi iontovým roztokem A stabilizovaným ethylenglykoltetraoctovou kyselinou (EGTA), v celkovém objemu 1500 ml, jsme již prováděli in vitro ve vodní lázni zahřáté na teplotu 37 °C. Následovala 30minutová perfúze roztokem B s uzavřeným okruhem pod tlakem 30 mm vodního sloupce. Tento roztok obsahoval kolagenázu (Colagenasa cruda, aktivita 1000). Poté jsme játra perfundovali 1000 ml roztoku C (Krebsovo-Henseleitovo medium), který byl zchlazen na 4 °C a obsahoval spolu s glukózou i rozpuštěný bovinní sérový albumin. Tím došlo k deaktivaci kolagenázy. Teplá ischémie celkově nepřesahovala 55 minut.
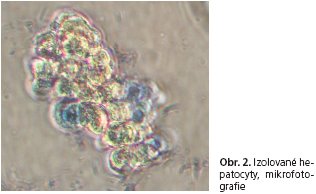
Po poslední perfúzi jsme mechanicky rozrušili jaterní pouzdro tak, aby se parenchym lépe uvolnil do média. Vzniklou suspenzi hepatocytů jsme následně filtrovali a postupně třikrát centrifugovali rychlostí 500 otáček za minutu při stálém chlazení na 4 °C (obr. 1.).
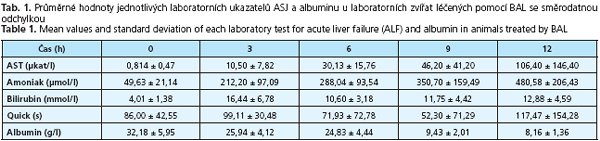
Mezi jednotlivými cykly jsme suspenzi promývali roztokem C. Tímto postupem jsme získali 80 g buněčné suspenze zředěné v celkovém objemu 200 ml. Po obarvení methylenovou modří jsme pod mikroskopem při zvětšení 150-300krát změřili a zhodnotili viabilitu hepatocytů v suspenzi (obr. 2.).
Poté jsme suspenzí hepatocytů naplnili bioreaktor, který jsme předtím promyli 2000 ml fyziologického roztoku a důkladně odvzdušnili. Bioreaktor jsme po naplnění uložili do termoboxu při teplotě 4 °C až do doby jeho zapojení do přístroje.
Zapojení bioreaktoru a monitorace
Po chirurgické devaskularizaci jater jsme miniprase uložili na bok, zahřívali a ventilovali směsí kyslíku se vzduchem s FiO2 0,5. Intravenózně jsme podávali analgosedaci s využitím farmak s převážně mimojaterní cestou eliminace: kombinaci propofolu v úvodní dávce 6 mg/kg/h (Recofol, Leiras, Finsko), remifentanilu v úvodní dávce 1 µg/kg/min (Ultiva,Glaxo Group, Velká Británie) a medetomidinu v úvodní dávce 3 µg/kg/h (Domitor, Pfizer, USA). Podle potřeby jsme podávali krystaloidní a koloidní roztoky a noradrenalin (Noradrenalin, Léčiva, ČR), k forsírování diurézy eventuálně bolusově furosemid (Furosemid, Hoechst - Biotika, SR). Monitorovali jsme parametry hemodynamiky, SpO2, ETCO2, tělesnou teplotu a hodinovou diurézu. V pravidelných intervalech jsme odebírali krevní vzorky na stanovení vnitřního prostředí, hodnot iontů, glykémie, krevního obrazu, parametrů hemokoagulace, jaterních testů a sérového kreatininu(10). Monitoraci intrakraniálního tlaku (ICP) jsme zahájili ihned po operaci zavedeným čidlem (fy Codman, Johnson and Johnson, USA). Nástup ASJ jsme zaznamenali v čase poklesu glykémie pod hodnoty 3,5 mmol/l. Tento moment byl počátkem otevření tzv. terapeutického okna a napojením bioreaktoru.
Bioreaktor, naplněný suspenzí živých hepatocytů, jsme umístili do terciálního okruhu přístroje O. liver Performer firmy Rand, Itálie (obr. 3.).
Monitoraci hodnot jednotlivých laboratorních ukazatelů ASJ a hodnot ICP jsme prováděli po celou dobu operace, rozvoje ASJ a léčby BAL až do doby exitu zvířete.
Získané hodnoty laboratorních vyšetření v průběhu léčby ASJ připojením na BAL jsme porovnali s parametry kontrolní skupiny, tedy skupiny zvířat, u které bylo vyvoláno ASJ a která nebyla na BAL napojena(7).
Statistické zpracování výsledků
Získané údaje jsme statisticky zpracovali pomocí T-testu a Mannovým-Whitneyho neparametrickým testem použitím tabulátoru EXCEL a QUATRO.
Předoperační přípravu, operaci a pooperační péči jsme prováděli v souladu se zákonem: § 12 vyhlášky č. 311/97 Sb., o chovu a využití pokusných zvířat, s povolením etické komise IKEM pro experimenty na zvířatech.
VÝSLEDKY
BAL jsme použili k léčbě 14 miniprasat váhy 25-30 kg, u kterých jsme vyvolali ASJ chirurgickou devaskularizací. Z tohoto celkového množství byla 4 zvířata nehodnotitelná a ze studie jsme je proto vyřadili: jedno pro významné krvácení do dutiny břišní po provedeném operačním zákroku, dvě pro kardiopulmonální dekompenzaci při předoperačně nepoznané konstriktivní perikarditidě a jedno pro problémy s monitorací ICP při jeho prudkém vzestupu.
U skupiny 10 zařazených zvířat se ASJ rozvinulo v průměru za 2 h 7 min od provedené devaskularizace jater (48 min-3 h 16 min) a korespondovalo s nástupem hypoglykémie pod hodnoty 3,5 mmol/l. Léčba ASJ napojením zvířete na BAL byla zahájena v průměru po 2 h 21 min (1 h-3 h 45 min) a trvala v průměru 5 h 43 min (3 h 25 min-8 h 10 min).
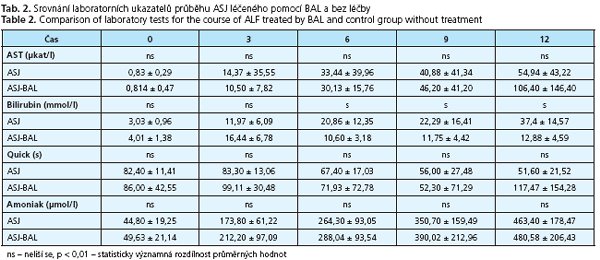
Získané průměrné hodnoty vybraných laboratorních vyšetření v průběhu experimentu jsou uvedeny v tab. 1.
V tab. 2. je uvedeno srovnání vybraných hodnot laboratorních ukazatelů ASJ zvířat s ASJ léčených pomocí BAL s průměrnými hodnotami laboratorních ukazatelů kontrolní skupiny, tedy historické skupiny s ASJ bez napojení na BAL(8).
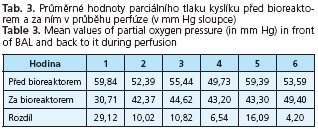
Počáteční viabilita hepatocytů při plnění bioreaktoru dosahovala v průměru 85 % ± 4,5. Viabilitu izolovaných hepatocytů v bioreaktoru v průběhu léčby jsme posuzovali ze změřené průměrné hodnoty parciálního tlaku kyslíku při průchodu bioreaktorem (tab. 3.).
Rozdíl je signifikantně významný v 1.-3. a 5. hodině perfúze (p < 0,05), ve 4. a 6. hodině je signifikantně nevýznamný.
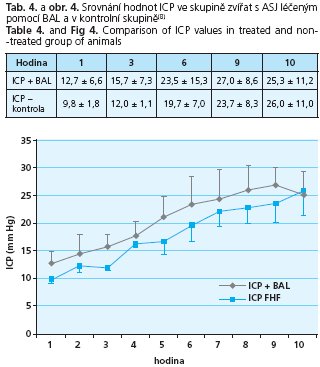
Srovnání ICP v obou skupinách je znázorněno v tab. 4. a na obr. 4. Rozdíl v průběhu ASJ je statisticky nevýznamný.
Ze statistického zpracování hodnot jednotlivých laboratorních ukazatelů ASJ v obou skupinách, tj. ve skupině léčené pomocí BAL a ve skupině kontrolní bez léčby, vyplývá, že významného rozdílu bylo dosaženo pouze v koncentraci bilirubinu, kdy v 0. hodině jsou průměrné hodnoty v obou skupinách prakticky totožné (3,1 vs 3,8 mmol/l), ve 3. hodině je rozdíl statisticky významný (p < 0,05) v neprospěch skupiny s BAL (9,8 vs 17,7 mmol/l), rozdíl hodnot v 6. a 9. hodině je statisticky významný (p < 0,05) ve prospěch skupiny BAL (18,1 vs 13,1, 22,9 vs 13,2) a rozdíl hodnot ve 12. hodině je opět statisticky nevýznamný (22,8 vs 16,2).
Hodnoty ICP ve skupině léčené BAL a ve skupině kontrolní se v průběhu experimentu statisticky významně nelišily.
DISKUSE
Modely BAL a jejich využití v rámci experimentu na zvířeti nebo při klinických experimentech sestávají ze čtyř částí(14):
- 1. zdroje hepatocytů (normální či transformované linie lidských nebo zvířecích buněk, čerstvé nebo zmražené);
- 2. bioreaktoru (dvou- nebo třídimenzionálního);
- 3. extrakorporálního systému cirkulace;
- 4. monitorace.
V našem případě jsme použili izolované čerstvé porcinní hepatocyty, třídimenzionální bioreaktor s extrakorporálním podpůrným systémem přístroje O. liver performance fy Rand(15) s plazmafiltrací, hemofiltrací a integrovaným oxygenátorem. Bioreaktor byl naplněn 200 ml suspenze obsahující 80 g izolovaných hepatocytů v souladu s výrobcem. V průběhu pokusu jsme monitorovali laboratorní ukazatele ASJ, parametry hemodynamiky a nitrolebeční tlak stejný způsobem, jaký jsme použili v předchozích experimentech(8,11).
K volbě uvedených komponentů BAL nás nutily především následující důvody:
- snadná dostupnost živých čerstvých porcinních hepatocytů;
- relativní jednoduchost jejich izolace s dosažením vysoké viability;
- provedení pilotního pokusu, který by byl srovnatelný s již publikovanými výsledky experimentálních studií;
- volba metody, která by mohla být srovnávána s již publikovanými klinickými studiemi a potenciálně aplikovatelná v klinickém experimentu.
Použitý experimentální model u miniprasete prokázal standardní nástup ASJ po provedené jaterní devaskularizaci a portokavální anastomóze(8). V praxi to znamenalo předvídatelnost doby, do které bylo nutno provést přípravu suspenze izolovaných hepatocytů a naplnění bioreaktoru. Celý postup s vytvořením modelu ASJ a napojením zvířete na extrakorporální cirkulaci s bioreaktorem tak bylo možné jednoduše časově rozvrhnout.
Po provedení izolace dosahovala průměrná viabilita hepatocytů 85 %. Tuto hodnotu jsme považovali v souladu s literárními údaji za dostatečnou(12,13). Životaschopnost hepatocytů v průběhu perfúze jsme ověřovali pomocí měření konzumpce kyslíku v krvi při průchodu bioreaktorem. Získaná data potvrzují, že v průběhu perfúze, tj. po dobu 5 h 43 min (3 h 25 min-8 h 10 min), si hepatocyty životaschopnost uchovaly v průměru prvních 5 hodin, potom (soudě podle výrazně snížené konzumpce kyslíku) se jejich viabilita rychle se snižovala.
Z naměřených hodnot laboratorních ukazatelů ASJ ve skupině BAL a z jejich srovnání s kontrolní skupinou lze učinit následující závěry:
- 1. aktivita AST, koncentrace amoniaku a hodnota Quickova testu se signifikantně nelišily v obou skupinách;
- 2. koncentrace bilirubinu byla signifikantně nižší ve skupině léčené pomocí BAL, a to v 6. a 9. hodině ve prospěch skupiny s BAL, ve 3. hodině naopak v její neprospěch;
- 3. naměřené hodnoty ICP se v obou skupinách signifikantně nelišily, i když po 9. hodině nelze trend naměřených hodnot posuzovat pro blížící se ukončení experimentu.
Naše výsledky je možné srovnat s výsledky některých experimentálních studií na velkých laboratorních zvířatech(2,3,15-18). Námi dosahovaná viabilita izolovaných porcinních hepatocytů 85 % je velmi podobná: u většiny autorů dosahuje 83-91 %(2-5,13,18). Někteří autoři používají izolovaných hepatocytů zmražených metodou podle Maganta(19), které si po rozmražení ponechávají poměrně vysokou viabilitu dosahující 70-80 %. Ta však velmi rychle klesá pod 40 %(3). Ani množství použitých hepatocytů k náplni bioreaktoru není u různých autorů totožné a pohybuje se řádově od 109 po 1010 bez závislosti na váze experimentálního zvířete(2-5,13,18).
Ve většině experimentálních studií autoři prokazují snížení koncentrace amoniaku, bilirubinu a hodnot nitrolebního tlaku u skupiny léčených BAL(2,3,15-18). Cuervas-Mons se spoluautory uvádí v randomizované studii s 53 zvířaty signifikantně delší přežívání a snížení ICP při léčbě ASJ pomocí BAL ve srovnání s kontrolní skupinou(3). K experimentu však použili model s parciální resekcí jaterního parenchymu, který vede k 86% letalitě v průběhu prvních 4 dnů. Při léčbě bioreaktorem s použitím 0,6 · 109 hepatocytů došlo v některých časových bodech k signifikantnímu snížení sérových koncentrací bilirubinu a protrombinu, k signifikantnímu zvýšení glykémie a albuminu. Celkově však signifikantních rozdílů v sérových koncentracích AST, laktátdehydrogenázy, bilirubinu, albuminu, glukózy a protrombinu dosaženo nebylo. ICP byl u bioreaktorem léčené skupiny nižší. Po léčbě bioreaktorem byla letalita 56 % ve srovnání s kontrolní skupinou, kde dosáhla 88 %. Všechna zvířata exitovala v průběhu prvních 3 dnů.
Výrazně lepších výsledků dosáhl Sheil se spolupracovníky(4). Provedli obdobný experiment na skupině 5 miniprasat s použitím systému BALLS (bioartificial liver support) s hepatocyty v množství 2,5 · 1010 s viabilitou cca 30 hodin v kombinaci s dialýzou. Konstatovali snížení koncentrace amoniaku, aminových kyselin a ICP v léčené skupině.
Obdobného zlepšení laboratorních ukazatelů ASJ u prasat s ASJ dosáhli Sosef (16) a Naka(17), kteří pozorovali signifikantní prodloužení života a snížení koncentrace amoniaku. Zvýšené hodnoty bilirubinu vysvětlují důsledkem jeho extrahepatální konjugace. K experimentu však použili hepatektomovaná zvířata, kdy rozvoj, a především průběh ASJ není srovnatelný s průběhem ASJ u člověka.
Výsledky našeho měření jsme zpracovávali standardním srovnáváním dvou souborů nezávislých výběrů. A to oboustranným a jednostranným testem nulové hypotézy oproti hypotéze alternativní na obvyklé hladině významnosti 0,05.
V případě hodnot plazmatických AST, ALT a hodnot Quickova času není na dané hladině významnosti statisticky významný rozdíl mezi skupinou kontrolní a skupinou léčenou BAL, což odpovídá našim předpokladům před započetím experimentu.
Naproti tomu u hodnot plazmatického bilirubinu jednostranný test H0 proti alternativní hypotéze předpokládající, že hodnoty u léčeného prasete budou nižší než u kontrolní skupiny, vyvrací platnost nulové hypotézy, a tudíž potvrzuje platnost alternativní hypotézy - ovšem pouze u měření po 6 a 9 hodinach. Neboli nulovou hypotézu lze zamítnout a výsledek je statisticky významný pro rozdíl hodnot koncentrací bilirubinu u léčené a kontrolní skupiny, a to po šesti a devíti, nikoliv po dvanácti hodinách léčby.
V případě hodnot plazmatického amoniaku, oproti původnímu předpokladu, není na dané hladině významnosti statisticky významný rozdíl mezi léčenou a kontrolní skupinou. Tento výsledek je patrně ovlivněn nedostatkem údajů především u léčené, ale i kontrolní skupiny, obdobně lze chápat nesigifikantnost výsledků měření hodnot bilirubinu po dvanácti hodinách. Skutečnost, proč jsme v naší sestavě nedosáhli literárně uváděného signifikantního zlepšení většiny laboratorních ukazatelů ASJ a hodnot ICP, je možné vysvětlit řadou faktorů, které patrně ovlivnily získávané údaje jednotlivých hodnot ASJ: přežívání hepatocytů v bioreaktoru podle sledované konzumpce kyslíku nedosahovalo požadovaných 6 hodin, použité množství hepatocytů v suspenzi mohlo být vzhledem k váze experimentálního zvířete s ASJ nedostatečné, monitorace měla být prováděna po delší dobu.
I když není mezi autory doposud shody, množství viabilních hepatocytů v bioreaktoru považujeme za zásadní a námi použitých 80 g v suspenzi za nedostatečné(7,23). Z těchto důvodů považujeme, v souladu s názorem Sheila et al. (4), velikost použitého bioreaktoru za nevyhovující.
Na straně druhé jsme přesvědčeni, že námi použitý devaskularizační model ASJ(8) se, na rozdíl od modelů hepatektomovaných zvířat(16), velmi blíží klinickému průběhu ASJ s vyplavením vazoaktivních substancí a ostatních toxických látek z nekrotických částí jater do oběhu nemocného. Měření hodnot intrakraniálního tlaku považujeme za zásadní vzhledem ke skutečnosti, že především ovlivnění této hodnoty by mělo mít finálně vliv na hodnocení metody BAL jak v experimentu(13), tak i v klinice(24).
Naše výsledky jsou v souladu s výsledky provedené randomizované klinické studie léčby ASJ pomocí BAL, kdy koncentrace bilirubinu byly při léčbě BAL signifikantně nižší(6) .
ZÁVĚR
Provedená experimentální práce s léčbou akutního selhání jater u velkého laboratorního zvířete prokázala funkčnost zapojení eliminační metody - biologických »umělých jater« (BAL) - v perfúzi plazmy. Dosáhli jsme iniciální 85% viability čerstvých izolovaných prasečích hepatocytů a jejich prokázané přežívání po téměř celou dobu, kdy byl bioreaktor použit k léčbě. Vyjma koncentrace bilirubinu naše výsledky neprokázaly signifikantní změny hodnot laboratorních ukazatelů ASJ. Naměřené hodnoty nitrolebního tlaku se statisticky významně nelišily ve skupině s léčbou akutního selhání jater pomocí BAL a ve skupině s akutním selháním jater bez napojení na BAL. Získané zkušenosti umožňují v experimentální práci s BAL pokračovat. Provedený experiment považujeme za studii pilotní.
Literatura
- 1. Trey C, Davidson CS. The management of fulminant hepatic failure. Prog Liver Dis 1970; 3: 282-298.
- 2. Flendrig LM, Calise F, Di Florio E, et al. Significantly improved survival time in pigs with complete liver ischemia treated with a novel bioartificial liver. Int J Artif Organs 1999; 22: 701-708.
- 3. Cuervas-Mons V, Colás A, Rivera JA, et al. In vivo efficacy of a bioartificial liver improving spontaneous recovery from fulminant hepatic failure: a controlled study in pigs. Transplantation 2000; 69: 337-344.
- 4. Sheil AGR, Sun J, Wang L, et al. A biodialysis system for liver support tested in a porcine hepatic failure model. Aust N Z J Surg 2000; 70: 127-131.
- 5. Gerlach JC, Encke J, Hole O, et al. Bioreactor for a large scale hepatocyte in vitro perfusion. Transplantation 1994; 58: 984-988.
- 6. Demetriou AA, Brown RS, Busuttil RW, et al. Prospective, randomized, multicenter, controlled trial of a bioartificial liver in treating acute liver failure. Ann Surg 2004; 239: 660-670.
- 7. Hayes PC, Lee A. What progress with artificial livers ? Lancet 2001; 358: 1286-1287.
- 8. Ryska M, Kieslichová E, Pantoflíček T, et al. Devascularization surgical model of acute liver failure in minipigs. Eur Surg Res 2004; 36: 179-184.
- 9. Ryska M, Kieslichová E, Pantoflíček T, et al. Chirurgický model akutního selhání jater u laboratorního miniprasete. Čes Slov Gastroent Hepatol 2004; 58: 83-88.
- 10. Ryska M, Kieslichová E, Pantoflíček T, et al. Model akutního selhání jater u miniprasete z hlediska chirurga a anesteziologa. Rozhl Chir 2004; 83: 436-442.
- 11. Kieslichová E, Ryska M, Pantoflíček T, et al. Hemodynamic parameters in a surgical devascularization model of fulminant hepatic failure in the minipig. Phys Res 2005; 54: 485-490.
- 12. Selen PO. Preparation of isolated rat liver cells. Methods Cell Biol 1976; 13: 29-83.
- 13. Khalili TM, Navarro A, Ting P, et al. Bioartificial liver treatment prolongs survival and lowers intracranial pressure in pigs with fulminant hepatic failure. Artif Organs 2001; 25: 566-570.
- 14. Nagamori S, Hasumura S, Matsuura T, et al. Developments in bioartificial liver research: concepts, performance, and applications. J Gastroenterol 2000; 35: 493-503.
- 15. Borra M, Galavotti D, Bellini C, et al. Advanced technology for extracorporeal liver support systém devices. Int J Artif Organs 2002; 25: 939-949.
- 16. Sosef MN, Abrahamse LSL, Van de Kerkhove MP, et al. Assesment of the AMC - bioartificial liver in the anhepatic pig. Transplantation 2002; 73: 204-209.
- 17. Naka S, Takeshita K, Yamamoto T, et al. Bioartificial liver support systém using porcine hepatocytes entrapped in a three - dimensional hollow fiber module with collagen gel: an evaluation in the swine acute liver failure model. Artif Organs 1999; 23: 822-828.
- 18. Sheil AG, Sun J, Mears DC, et al. Positive biochemical effects of a bioartificial liver support system (BALSS) in a porcine fulminant hepatic failure (FHF) model. Int J Artif Organs 1998; 21: 43-48.
- 19. Maganto P, Cienfuegos JA, Santamaria L, et al. Cryopreservation and transplantation of hepatocytes: an approach for culture and clinical application. Cryobiology 1988; 25: 311-314.
- 20. Horslen SP, Hammel JM, Fristoe LW, et al. Extracorporeal liver perfusion using human and pig livers for acute liver failure. Extracorporeal liver perfusion using human and pig livers for acute liver failure. Transplantation 2000; 70: 1472-1478.
- 21. Levy MF, Crippin J, Sutton S, et al. Liver allotransplantation after extracorporeal hepatic support with transgenic (hCD55/hCD59) porcine livers. Clinical results and lack of pig-to-human transmission of the porcine endogenous retrovirus. Transplantation 2000; 69: 272-280.
- 22. Rozga J, Holzman MD, Ro MS, et al. Development of a hybrid bioarteficial liver. Artif Organs 1993; 21: 502-511.
- 23. Busse B, Smith MD, Gerlach JC. Treatment of acute liver failure: hybrid liver support. A critical overview. Langenbeck´s Arch Surg 1999; 384: 588-599.
- 24. O´Grady JG, Alexander GJ, Hayllar KM, et al. Early indicators of prognosis in fulminant hepatic failure. Gastroenterology 1989; 97: 439-445.
Poděkování
Studii by nebylo možné provést bez technické pomoci Jiřího Čápa, Miroslava Hmiráka a Zuzany Šimůnkové. Za statistické zhodnocení získaných dat děkujeme paní RNDr. Jeleně Skibové. V nácviku izolace hepatocytů jsme velmi ocenili pomoc paní doc. MUDr. Z. Červenkové, CSc., z LF UK v Hradci Králové. Poděkování za podporu projektu patří bývalému řediteli IKEM MUDr. Karlu Filipovi, CSc.
Práce byla uskutečněna s podporou výzkumného centra LN00A065 - Centrum buněčné terapie a tkáňových náhrad
To read this article in full, please register for free on this website.
Benefits for subscribers
Benefits for logged users