Výsledky transplantácií pečene u slovenských detí
Jana Kosnáčová1, Jarmila Hornová Orcid.org 2, Ľudmila Podracká1, Patrick Gerner3, Simone Kathemann3
+ Pracoviště
Souhrn
Autori retrospektívne sumarizujú krátkodobé aj dlhodobé výsledky transplantácií pečene u detí zo Slovenska za obdobie od januára 2002 do augusta 2015. Chirurgický výkon – transplantácia pečene u detských pacientov – sa vykonáva v zahraničných transplantačných centrách, pred- a potransplantačná starostlivosť sa zabezpečuje na I. detskej klinike LF UK a DFNsP v Bratislave. Drvivá väčšina pacientov sa transplantovala v pediatrickom centre v Essene, niekoľko väčších detí podstúpilo transplantáciu pečene v Prahe. Súčasťou predtransplantačného managementu je definitívna diagnostika primárneho ochorenia vrátane histológie a molekulovo-genetickej analýzy, špecializované zobrazovacie vyšetrenia, určenie PELD skóre a zaradenie na čakaciu listinu. V potransplantačnom managemente sa zameriavame na monitorovanie imunosupresie, prevenciu rejekcie a sledovanie dlhodobých infekčných a neinfekčných komplikácií. Výsledky: V období od januára 2002 do augusta 2015 sa vykonalo 38 transplantácií pečene u 32 detí. Najčastejšou indikáciou bola atrézia žlčových ciest. V súčasnosti je v našej dlhodobej starostlivosti 22 detí s transplantovanou pečeňou vo veku od deviatich mesiacov do 18 rokov. Jedna pacientka po dovŕšení 19 rokov bola odovzdaná do sledovania hepatológa pre dospelých, jeden chlapec žije s rodičmi dlhodobo v zahraničí a je v starostlivosti zahraničného transplantačného centra. Ročné prežívanie detí je 88,4 %, osem z 32 pacientov zomrelo (25 %). Záver: Každoročne na Slovensku registrujeme 2–4 nové prípady detí s potrebou transplantácie pečene. Krátkodobé a dlhodobé prežívanie štepov je aj v najnižších vekových skupinách výborné a umožňuje dieťaťu plnohodnotný návrat do života. Vďaka intenzívnej spolupráci so zahraničnými pracoviskami je transplantácia pečene dostupná aj pre deti zo Slovenska.
Klíčová slova
akutní selhání jater, atrézia žlčových ciest, chronické selhání jater, dítě, žijící dárceÚvod
Transplantácia pečene (LTx) je už štandardná liečebná metóda chronického a/alebo akútneho zlyhania pečene [1]. Počas zložitého chirurgického výkonu sa nahradí zlyhávajúci natívny orgán zdravou pečeňou od mŕtveho darcu alebo štepom pečene od žijúceho, resp. mŕtveho darcu (alogénna transplantácia) zvyčajne na pôvodné miesto (ortotopická transplantácia). Cieľom úspešnej LTx je nielen záchrana pacienta v terminálnom štádiu hepatálneho ochorenia, ale predĺženie a najmä zvýšenie kvality života chorého jedinca.
História
LTx u detských pacientov majú rovnako dlhú históriu ako u dospelých. Historicky prvú LTx vykonal prof. T. E. Starzl u trojmesačného dojčaťa s atréziou žlčových ciest v roku 1963 v Denveri, USA. Ako prvá úspešná LTx sa datuje transplantácia vykonaná v roku 1967 tiež u detského pacienta v USA, po ktorej príjemca prežíval niekoľko dní [2]. Vďaka pokrokom v operačných technikách sa postupne zaviedla metóda redukovaného štepu, split transplantácia či transplantácia štepu od žijúceho darcu [3–5]. K ďalším významným medzníkom patria roky 1983, kedy bola LTx deklarovaná za liečebnú metódu [1], a 1989, ktorý sa zapísal do histórie vykonaním prvej LTx od žijúceho darcu [5]. Transplantácia časti pečene – štepu – od žijúceho darcu sa považuje za vrchol hepatálnej chirurgie. Zásadný obrat v prognóze priniesli moderné imunosupresíva (cyklosporín bol zavedený v roku 1978, takrolimus v roku 1989) a účinná indukčná liečba [6,7]. Prežívanie pacientov a štepov tiež výrazne ovplyvnili inovatívne chirurgické techniky, zdokonalenie anesteziologického managementu, rozšírenie dostupnosti orgánov (najmä od žijúcich darcov) a skorá identifikácia či liečba pooperačných komplikácií. Hoci základným kritériom vhodnosti darcu je AB0 kompatibilita, prekonala sa už táto imunologická bariéra a v prísne indikovaných prípadoch sa vykonávajú aj LTx od inkompatibilného darcu v AB0 systéme [8].
Za uplynulých 50 rokov sa získali bohaté skúsenosti a vybudovali sa viaceré úspešné transplantačné centrá, ktoré rutinne vykonávajú LTx u dospelých aj detských pacientov. Kľúčovou organizáciou zastrešujúcou logistiku transplantácie orgánov na území Európy je Eurotransplant, ktorý združuje osem štátov: Rakúsko, Belgicko, Chorvátsko, Nemecko, Maďarsko, Luxembursko, Holandsko, Slovinsko a plošne obsiahne populáciu takmer 135 mil. obyvateľov. Eurotransplant koordinuje transplantačnú aktivitu v 72 centrách a zodpovedá za alokáciu darcovských orgánov v združených krajinách. Ročne si tieto štáty vymenia cca 20 % všetkých orgánov [9]. Slovensko nie je členom Eurotransplantu a nemá v súčasnosti ani vybudované funkčné pediatrické transplantačné centrum, preto sa slovenské deti odosielajú na LTx do zahraničia. Najdlhšia a najlepšia spolupráca je s pediatrickým transplantačným centrom v Essene. U starších detí sa v ostatných rokoch rozvinula aktívna spolupráca aj s IKEM, Praha. Vychádzajúc z demografických údajov je v našej krajine reálna potreba 2–4 detských LTx ročne.
Indikácie na transplantáciu pečene
LTx je indikovaná u pacientov s akútnym a/alebo chronickým zlyhaním pečene rôznej etiológie. Podľa transplantačných registrov až 32 % detských pacientov je indikovaných na LTx pre biliárnu atréziu, nasledujú metabolické a geneticky podmienené ochorenia (22 %), akútne zlyhanie pečene (11 %), cirhóza (9 %), nádory pečene (9 %), autoimunitné ochorenia (4 %) a iné ochorenia (13 %) [10]. Dieťa nie je „malý“ dospelý. Deti sa líšia od dospelých pacientov spektrom základných ochorení, klinickými prejavmi, fyziologickými a neurokognitívnymi reakciami či schopnosťou vnímania zdravia a choroby. Navyše v pediatrickej populácii sa často prekrývajú rôznorodé symptómy ochorení aj v rámci jednotlivých vekových období (novorodenci, dojčatá, deti a adolescenti). Rozdiely vyplývajú najmä z antropometrických a anatomických pomerov, obmedzeného priestoru v brušnej dutine, cievnych variácií či „miniatúrneho“ priemeru ciev alebo žlčových ciest u dojčiat a malých detí.
Načasovanie transplantácie pečene
Načasovanie transplantácie závisí od klinického a laboratórneho obrazu ochorenia, naliehavosti LTx, posúdenia prognózy i nepredvídateľného vývoja, ktorý môže skončiť smrťou alebo závažným neurologickým poškodením. U pacientov s akútnym zlyhaním (najčastejšie pre Wilsonovu chorobu, autoimunitnú hepatitídu a akútnu otravu) alebo s akútnou dekompenzáciou chronického ochorenia je potrebné neodkladne kontaktovať transplantačné centrum. U pacientov s chronickým ochorením pečene je obdobie pred transplantáciou určené na dôkladné vyšetrenie a prípravu pacienta na zložitý operačný výkon. Pacienti indikovaní na LTx sa zaraďujú na čakaciu listinu po schválení transplantačnou komisiou. Dôležitou súčasťou indikačného procesu je posúdenie rizikovosti kandidáta. Na predikciu prognózy slúžia skórovacie systémy. Najznámejšou je staršia Child-Pughova klasifikácia. Vychádzajúc z hodnotiaceho systému MELD (Model For End-Stage Liver Disease) a PELD (Pediatric End-stage Liver Disease) sa potenciálnemu kandidátovi priradí určitý počet bodov. MELD využíva matematický vzorec a pracuje s tromi základnými ukazovateľmi: hodnota kreatinínu pacienta, INR a hodnota bilirubínu [11]. PELD skóre zohľadňuje celkový bilirubín, INR a albumín adjustovaný na vek a hmotnosť dieťaťa [12].
Transplantáciu per se treba zvažovať včas, pri chronickom zlyhaní pečene v štádiu triedy Child-Pugh B alebo MELD/PELD skóre okolo 15 bo- dov [13]. Avšak bez ohľadu na číselné skóre treba indikáciu zvážiť pri klinických príznakoch dekompenzácie základného ochorenia pečene, hepatorenálnom syndróme alebo komplikáciách portálnej hypertenzie. Pri akútnom zlyhaní sa vykonáva urgentná transplantácia mimo poradia na čakacej listine. Na posúdenie prognózy akútneho zlyhania pečene sa využívajú iné prognostické modely, napr. tzv. King’s College criteria.
U detí sa uprednostňuje transplantácia štepu od žijúceho darcu. Prináša celý rad benefitov a je ideálna aj pre najmenších príjemcov, ktorí majú problém získať malý orgán. Pri výkone sa žijúcemu darcovi odoberie časť pečene (najčastejšie druhý a tretí segment) a transplantuje sa aj dojčatám s hmotnosťou pod 10 kg. Títo recipienti majú nulovú mortalitu na čakacej listine, no pred érou príbuzenských LTx často zomierali na waiting liste. Plánovaná transplantácia umožňuje optimálne načasovanie, dostatočný čas na vyšetrenie príjemcu a stabilizáciu stavu pacienta, ako aj na kompletné vyšetrenie a posúdenie vhodnosti darcu. Doba ischémie je minimálna a zistil sa aj imunologický benefit. Výhodou je tiež genetická príbuznosť medzi darcom a príjemcom, čo môže mať pozitívny vplyv na rodinu.
Špecifiká detských transplantácií pečene
Atrézia žlčových ciest patrí medzi fatálne diagnózy, na ktorú deti zomierajú už v rannom veku. Len 16 % detí bez LTx sa dožíva dvoch rokov života [10]. Včasná diagnostika atrézie žlčových ciest a biliárnej atrézii príbuzných ochorení v novorodeneckom a včasnom dojčenskom období a v indikovaných prípadoch vykonanie hepatoportoenteroanastomózy podľa Kasaia do 60. dňa života môže významne predĺžiť prípravu a čakanie na transplantáciu a posunúť LTx do neskoršieho obdobia. Dojčatá s nezvládnuteľnou vitamin K dependentnou koagulopatiou, hypoalbuminémiou, histologicky pokročilou cirhózou pečene, ascitom, portálnou hypertenziou a malnutríciou ešte pred hepatoportoenteroanastomózou majú horšiu prognózu [14]. Kasaiova operácia nie je definitívnym riešením, ale len dočasný paliatívny výkon pre niektoré cholestatické ochorenia. Preto v diferenciálnej diagnostike je potrebné už v dojčenskom veku diagnostikovať biliárnej atrézii príbuzné ochorenia, ako sú cysty duktu choledochu, Alagillov syndróm, Criglerov-Najjarov syndróm, primárnu familiárnu intrahepatálnu cholestázu, metabolické ochorenia a zvážiť Kasaiovu operáciu. Avšak aj po adekvátne vykonanej Kasaiovej operácii môže poškodenie pečene ďalej progredovať a ohrozovať pacienta závažnými komplikáciami ako cholestáza, recidivujúce cholangitídy, malnutrícia a nedostatok vitaminov, hepatopulmonálny syndróm, portopulmonálna hypertenzia, zriedkavo hepatocelulárny karcinóm [15]. Kasaiova operácia sa odporúča ako iniciálne operačné riešenie u dojčiat s biliárnou atréziou, ale pri rýchlo progredujúcej dekompenzácii ochorenia môže byť pacient odoslaný na LTx aj bez vykonania Kasaiovej operácie. U niektorých detí s Alagillovým syndrómom a progresívnou familiárnou intrahepatálnou cholestázou môže pruritus či nízky vzrast negatívne ovplyvniť kvalitu života aj pri zachovanej funkcii pečene. Pacientov s chronickým ochorením pečene, ktorí majú známky malnutrície, poruchu rastu, krvácanie z varixov, ascites, opakujúce cholangitídy alebo epizódy spontánnej bakteriálnej peritonitídy, pruritus, postupujúcu encefalopatiu a/alebo zhoršujúcu hemokoaguláciu sa odporúča zaradiť včas na čakaciu listinu. U detí s metabolickým ochorením sa môže zhoršovať neurologický stav v dôsledku opakovanej dekompenzácie základného ochorenia a častých metabolických kríz. Primárne a sekundárne nádory pečene sú v detskom veku zriedkavé, častejšie sa vyskytuje hepatoblastóm než hepatocelulárny karcinóm.
Súbor a výsledky transplantácií pečene u detí na Slovensku
Transplantačný hepatálny program na Slovensku začal písať svoju históriu v roku 2001, kedy vo FN akademika L. Dérera v Bratislave bolo vykonaných päť LTx u dospelých pacientov [16]. DFNsP na Kramároch v Bratislave pôvodne získala štatút transplantačného centra v roku 2002 a v roku 2003 sa vykonala transplantácia pečene od mŕtveho darcu u sedemročného dievčatka po Kasaiovej operácií pre atréziu extrahepatálnych žlčových ciest. Následne sa v roku 2004 pod odborným vedením nemeckého tímu vykonala aj transplantácia pečene od žijúceho darcu u dojčaťa s atréziou žlčových ciest. Avšak po tomto „záblesku“ už pediatrický LTx program na Slovensku nepokračoval a v súčasnosti sa transplantujú deti v zahraničných pediatrických centrách.
Incidencia LTx v slovenskej pediatrickej populácií je v priemere 2–4 prípady za rok. Potenciálni recipienti sa z celého územia Slovenska sústreďujú na 1. detskej klinike DFNsP v Bratislave, kde evidujeme národný register detí s LTx a poskytujeme komplexný predtransplantačný a potransplantačný management. Na čakacej listine sú toho času štyri deti (jeden pacient s Criglerov-Najjarovým syndrómom, dva pacienti s atréziou žlčových ciest po Kasaiovej operácii, jeden pacient s metabolickým ochorením).
Predtransplantačná starostlivosť
Starostlivosť o pacienta pred transplantáciou zahŕňa potvrdenie primárnej diagnózy vrátane biopsie pečene a molekulovo-genetickej analýzy, vyhodnotenie doterajšej liečby aj súvisiacich komorbidít, vylúčenie kontraindikácie LTx, zhodnotenie nutričného stavu s dôsledným nutričným managementom a riešenie celého spektra pridružených komplikácií ako ascites, pruritus, portálna hypertenzia, hypoalbuminémia, hypokoagulácia, nedostatok vitaminov, oneskorený rast a vývoj. Komplexný predtransplantačný management zahŕňa aj chirurgické výkony (gastrofibroskopia, kolonoskopia) a tiež obsiahlu sprievodnú agendu, ako je zváženie vhodnosti žijúceho darcu (poskytnutie dostatku informácií o výkone), možných komplikáciách, získanie písomného súhlasu rodičov, základné vyšetrenie darcu, komunikáciu s transplantačným centrom, spoluprácu s rodinou, psychologickú prípravu pacienta a rodiny, multidisciplinárne zhodnotenie výsledkov, komunikáciu s poisťovňou, finančné a logistické zabezpečenie.
Potransplantačná starostlivosť
Pacienti sa v priebehu 4–6 týždňov po transplantácii vracajú na I. detskú kliniku DFNsP, v prípade neočakávaných komplikácií až po ich zvládnutí. U nás pokračujeme v poskytovaní komplexnej starostlivosti, ktorá zahŕňa: potransplantačnú imunosupresiu, cielené laboratórne a zobrazovacie vyšetrenia, diagnostiku a liečbu akútnych/chronických rejekcií, infekcií a rôznych komplikácií, monitoring nežiaducich účinkov imunosupresív a interakcií, zabezpečenie individuálneho očkovania, dlhodobé sledovanie klinického stavu a vývoja dieťaťa a zaradenie pacienta do aktívneho života.
Výsledky transplantácií
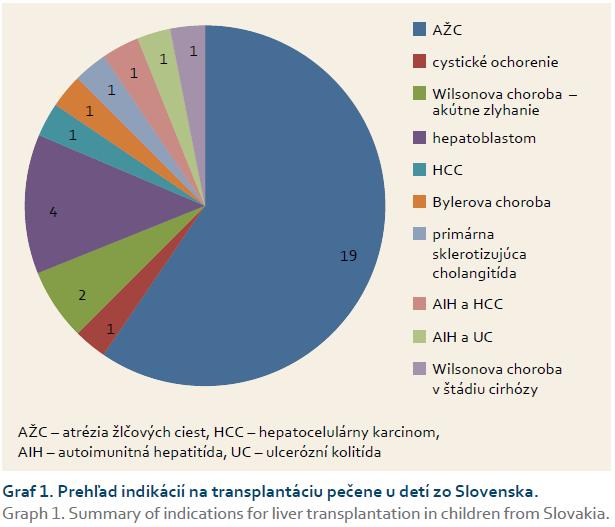
Od januára 2002 do augusta 2015 sa zrealizovalo 38 LTx u 32 detských príjemcov. LTx boli vykonané v rôznych transplantačných centrách, najčastejšie (28×) v Essene v Nemecku, 1× v Kieli v Nemecku, 6× v IKEM v Prahe v ČR, 3× v Bratislave. Z 38 vykonaných transplantácií bolo šesť retransplantácií. Najčastejšou príčinou pre indikáciu LTx v našom súbore bola atrézia žlčových ciest 19× (12 dievčat). Z ďalších príčin išlo o cystické ochorenie pečene (jeden pacient), 2× o akútne zlyhanie a akútnu dekompenzáciu Wilsonovej choroby, 4× hepatoblastóm, 1× hepatocelulárny karcinóm, 1× Bylerovu chorobu, 1× neonatálnu sklerotizujúcu cholangitídu, 1× Wilsonovu chorobu v štádiu cirhózy pečene, 1× autoimunitnú hepatitídu asociovanú s HCC, 1× autoimunitnú hepatitídu s ulceróznou kolitídou (graf 1).
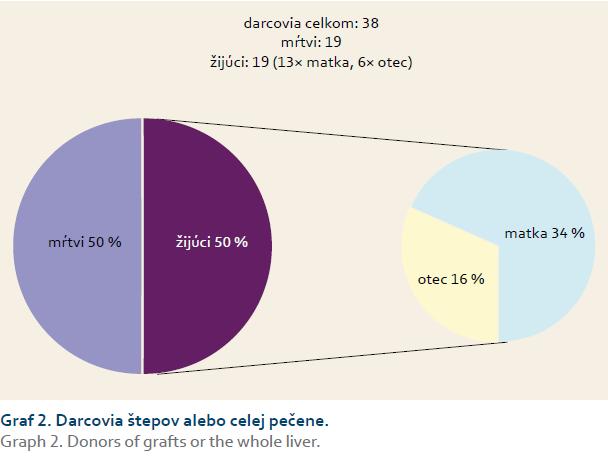
Celkom 19× sa transplantovala pečeň od žijúceho darcu. V 13 prípadoch bola donorom matka a 6× bol darcom otec. Jedno dieťa z nášho súboru podstúpilo transplantáciu štepu pečene od AB0 inkompatibilnej matky [8]. Celkom 19× pacienti dostali štep/pečeň od mŕtveho donora (vrátane retransplantácií) (graf 2). U žijúcich darcov sme nezaznamenali žiadne komplikácie v súvislosti s darovaním časti orgánu.
Atrézia žlčových ciest je aj u detí zo Slovenska najčastejšou indikáciou na LTx dostupnou aj v najnižšej vekovej a hmotnostnej skupine (obr. 1) – 19 detí s atréziou žlčových ciest sa odtransplantovalo v rozmedzí od 6. do 14. mesiaca života. Priemerný vek v čase LTx bol 9,2 ± 3,7 mesiaca a priemerná hmotnosť 6 150 ± 1 085 g. Najdlhšie žijúcou pacientkou s transplantovanou pečeňou pre atréziu žlčových ciest je 13,5-ročné dievča, u ktorého sa transplantoval štep od mŕtveho darcu v septembri 2002 v Essene. Pacientka je od transplantácie iba na monoterapii cyklosporínom, bez nutnosti zmeny či úpravy imunosupresívnej liečby a má plnohodnotný kvalitný život ako jej rovesníci.
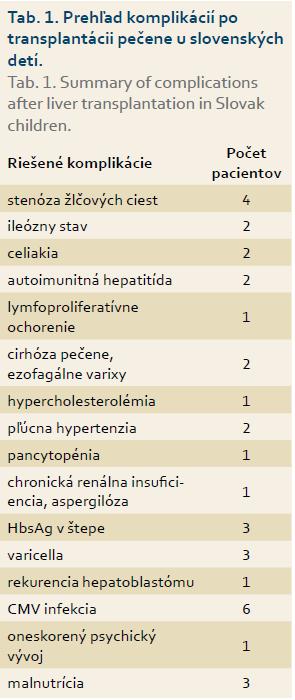
Prežívanie našich pacientov je porovnateľné s literárnymi údajmi ako aj s údajmi z transplantačných centier, v ktorých boli pacienti transplantovaní. Jednoročné prežívanie detí po LTx je 88,4 %. Počas dlhodobého sledovania sme sa stretli s rôznymi komplikáciami. Časté boli infekcie, u troch detí sa vyskytla pozitivita HBsAg v štepe pečene po transplantácii, šesť pacientov sme liečili pre pozitivitu cytomegalovírus, Epstein Barrovej vírus sme zachytili až u 70 % detí po transplantácii a klasickú formu varicelly prekonali tri deti. U jedného pacienta došlo k rekurencii hepatoblastómu v transplantovanom štepe a následnému úmrtiu. Vážnou komplikáciou po LTx bola životohrozujúca aspergilóza vyžadujúca agresívnu terapiu, ktorá viedla k ireverzibilnému poškodeniu obličiek s nutnosťou chronickej hemodialýzy. Chirurgickú revíziu pre stenózu žlčových ciest sme indikovali u štyroch pacientov, u dvoch detí sa vyskytol ileózny stav. U dvoch pacientov je potvrdená celiakia. Rozvoj autoimunitnej hepatitídy v transplantovanom štepe sme zistili u dvoch pacientov a jeden pacient bol liečený a je sledovaný pre posttransplantačné lymfoproliferatívne ochorenie. Z ďalších komplikácií sme zaznamenali hypercholesterolémiu 1×, oneskorený psychický vývoj 1×, pľúcnu hypertenziu 2×, cirhózu pečene a ezofagálne varixy 2× a pancytopéniu 1× (tab. 1).
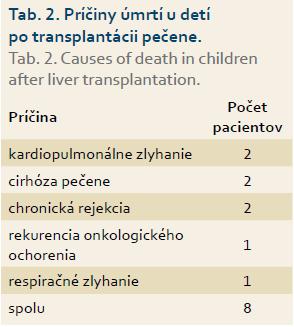
Z 32 transplantovaných detí v súčasnosti je v našej kontinuálnej starostlivosti 22 detí, jeden chlapec je v starostlivosti zahraničného pracoviska (rodina sa presťahovala do Nemecka), jedna pacientka je po dosiahnutí veku 19 rokov už v starostlivosti hepatológa pre dospelých. Za uplynulých 13 rokov zomrelo osem detí (tab. 2).
Záver
LTx je už štandardná metódau liečby hepatálneho zlyhania. Každoročne na Slovensku registrujeme 2–4 nové prípady detí, ktoré vyžadujú LTx. Najčastejšou indikáciou je atrézia žlčových ciest. Krátkodobé a dlhodobé prežívanie štepov je aj v najnižších vekových skupinách výborné a umožňuje dieťaťu plnohodnotný návrat do života.
Vďaka intenzívnej spolupráci so zahraničnými pracoviskami je LTx dostupná aj pre deti s fatálnymi chorobami zo Slovenska.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno/Submitted: 9. 11. 2015
Přijato/Accepted: 19. 11. 2015
MUDr. Jana Kosnáčová
I. detská klinika LF UK a DFNsP
Limbová 1
833 40 Bratislava
Slovenská republika
kosnacova@dfnsp.sk

Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. National Institutes of Health Consensus Development Conference Statement. Liver Transplantation. Hepatology 1984; 4 (Suppl 1): 107S–110S.
2.Starzl TE, Busuttil RW, Klintmalm GB. History of liver and other splanchnic organ transplantation. In: Busuttil RW, Klinmalm FG (eds). Transplantation of the Liver 1996. Philadephia, Saunders 1996: 903.
3. Bismuth H, Houssin D. Reduced-sized orthotopic liver graft in hepatic transplantation in children. Surgery 1984; 95 (3): 367–370.
4.Kim JS, Broering DC, Tustas RY et al. Split liver transplantation: past, present and future. Pediatr Transplant 2004; 8 (6): 644–648.
5. Broelsch CE, Whitington PF, Emond JC et al. Liver transplantation. in children from living related donors. Surgical techniques and results. Ann Surg 1991; 214 (4): 428–439.
6. Martínek V, Matoušovic K, Špatenka J. Objev a užití cyklosporinu v klinické praxi. Prakt Lék 2002; 82: 14–20.
7. Jain A, Reyes J, Kashyap R et al. What have we learned about primary liver transplantation under tacrolimus immunosuppression? Long-term follow-up of the first 1000 patients. Ann Surg 1999; 230 (3): 441–448.
8. Schukfeh N, Lenz V, Metzelder ML et al. First case studies of successful ABO-incompatible living-related liver transplantation in infants in Germany. Eur J Pediatr Surg 2015; 25 (1): 77–81. doi: 10.1055/ s-0034-1387936.
9. Eurotransplant. Cooperating within Eurotransplant. [online]. Dostupné z: www.eurotransplant.org/.
10. Squires RH, Hg V, Romero R et al. Evaluation of the pediatric patient for liver transplantation: 2014 practice guideline by the American Association for the Study of Liver Diseases, American Society of Transplantation and the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. Hepatology 2014; 60 (1): 362–398. doi: 10.1002/hep.27191.
11. Brown RS Jr, Lake JR. The survival impact of liver transplantation in the MELD era, and the future for organ allocation and distribution. Am J of Transplant 2005; 5 (2): 203–204.
12. Wiesner RH, McDiarmid SV, Kamath PS et al. MELD and PELD: application of survival models to liver allocation. Liver Transpl 2001; 7 (7): 567–580.
13. Freeman RB Jr, Wiesner RH, Roberts JP et al. Improving liver allocation: MELD and PELD. Am J Transplant 2004; 4 (Suppl 9): 114–131.
14. Davenport M, Puricelli V, Farrant P et al. The outcome of the older (> or = 100 days) infant with biliary atresia. J Pediatr Surg 2004; 39 (4): 575–581.
15. Shneider BL, Brown MB, Haber B et al. A multicenter study of the outcome of biliary atresia in the United States, 1997 to 2000. J Pediatr 2006; 148 (4): 467–474.
16. Kupčová V, Szántová M, Hrušovský Š et al. Spolupráca slovenských centier pri transplantácii pečene v IKEM. Folia Gastroenterol Hepatol 2005; 3 (Suppl 1): S62–S68.