Průkaz translokace bakterií ze střeva po transplantaci jater - první výsledky
Jana Juránková Orcid.org , Veronika Příbramská Orcid.org , Jan Lata1, Pavel Sauer Orcid.org , Taťána Štosová Orcid.org , Pavel Studeník Orcid.org , Helena Skácelová Orcid.org , Dagmar Koukalová Orcid.org , Vladimír Mejzlík Orcid.org 2
+ Pracoviště
Souhrn
Cíl. Pacienti po transplantaci jater jsou ohroženi infekcemi, jejichž původci vycházejí z GIT. Narušením střevní bariéry dochází k přestupu bakterií do krevního řečiště. Bakterie mohou být přeneseny do vzdálenějších systémů a způsobit infekci mimostřevních lokalizací. Sledováním hladiny endotoxinu (součásti stěny gramnegativních bakterií), kultivací střevní mikroflóry a infekčních agens z mimostřevních lokalizací a porovnáváním jejich fenotypu a genotypu jsme se snažili prokázat translokaci bakterií ze střeva do vzdálených orgánů.
Materiál a metodika. V pooperačním období bylo sledováno 14 nemocných. Byla prováděna kultivace perianálních stěrů, moče, stěrů z horních cest dýchacích a byla monitorována hladina endotoxinu v krvi. Kmeny byly srovnávány podle fenotypu a genotypu.
Výsledky. U osmi pacientů nebyla translokace prokázána. U šesti pacientů byly zjištěny zvýšené hladiny endotoxinu, které předcházely nálezu mimostřevní infekce se zdrojem v GIT.
Závěr. Detekce hladiny endotoxinu, jako markeru translokace gramnegativních bakterií, může být užitečným nástrojem časné diagnostiky infekčních komplikací.
Klíčová slova: bakteriální translokace, hladina endotoxinu, transplantace jater.
ÚVOD
Nozokomiální infekce u pacientů s chronickým onemocněním, po chirurgickém zákroku, stejně jako v intenzivní péči jsou časté a velmi závažné, komplikující základní onemocnění a pooperační průběh. Často jsou endogenního původu, způsobené fakultativně patogenními bakteriemi, které vycházejí z trávicího traktu, v němž jsou součástí přirozené mikroflóry. Rovněž se však může jednat o kolonizující nemocniční kmeny, nesoucí různé mechanismy rezistence k antimikrobním přípravkům.
Právě u těžce nemocných pacientů, obvykle s dysfunkční střevní bariérou, jsou běžně popisovány nozokomiální nákazy v mimostřevních lokalitách způsobené gramnegativními agens. Kromě jejich druhově specifických faktorů virulence k rozvoji infekce a jejímu průběhu velkou měrou přispívá endotoxin, lipid obsažený v povrchové lipopo-lysacharidové vrstvě stěny všech gramnegativních bakterií. Vykazuje biologickou aktivitu, odvislou od jeho množství ve vnitřním prostředí člověka, projevující se zvýšenou teplotou až šokovým stavem. Z jeho rostoucí hladiny v krvi pacientů pak lze usuzovat na přítomnost gramnegativních bakterií v krevním řečišti ještě před rozvojem klinických příznaků infekce.
Cílem práce bylo monitorovat hladiny endotoxinu v krvi nemocných po transplantaci jater a geneticky porovnávat případné fenotypově shodné perianální izoláty s agens zachyceným z infekční leze, jako důkaz translokace střevních bakterií do krevního řečiště.
MATERIÁL A METODIKA
Soubor pacientů
Do studie bylo zařazeno 14 pacientů v pooperačním období po transplantaci jater, 8 mužů v průměrném věku 49 roků (29-64 roků) a 6 žen průměrného věku 55 roků (43-64 roků). U 8 pacientů se jednalo o toxonutritivní cirhózu, 2 pacienti byli léčeni pro cirhózu při primární sklerózující cholangoitidě, 2 pacienti pro cirhózu při non-alkoholické steatohepatitidě a 1 pacient pro cirhózu při autoimunní hepatitíde. Pacienti byli zařazeni po schválení studie etickou komisí FN Brno a po podpisu informovaného souhlasu.
U všech bylo průběžně (2., 4., 6., 8., 10., 14., 18, 21. pooperační den, výjimečně i další dny) sledováno zastoupení bakterií v přirozeně osídlených lokalitách, dále jejich přítomnost v moči a drénech z operačních ran. Současně byla vyšetřována i hladina endotoxinu v krvi. Při nálezu fenotypově shodných izolátů v perianální oblasti a infekční lézi, bylo provedeno porovnání jejich genomu pomocí pulzní gelové elektroforézy (PFGE).
Kultivační vyšetření
Klinický materiál, tj. stery z perianálních řas, výtěry z horních cest dýchacích, vzorky moče a sekrety z drénů operačních ran, byl kultivován standardním způsobem na krevním (Merck) a McConkeyho agaru (Oxoid) za aerobních podmínek při teplotě 37 °C po dobu 24 hodin. Perianální stery a sekrety z operačních ran byly dále inokulovány na VL agar (OXOID) a inkubovány v anaerobním boxu při teplotě 37 °C po dobu 48 hodin. Druhová identifikace izolátů probíhala podle výsledků jejich růstových a biochemických aktivit pomocí komerčních diagnostických souprav (ENTEROtest 24 Lachema, BBL Crystal Orion Diagnostica, ANA II Systém Re-mel). Současně byl stanoven i jejich antibiogram difúzni diskovou metodou. K průkazu produkce širokospektrých P-laktamáz (ESBL) byl použit Double Disk Synergy Test. Izoláty perianální a z infekční leze od téhož pacienta, které vykazovaly naprostou shodu ve fenotypových vlastnostech včetně anti-biogramu, byly dále porovnávány PFGE.
Hladina endotoxinu v séru
Hladina endotoxinu v séru byla stanovována pomocí Limulus testu LAL (Pyrochrome). Limulus amebocytový lyzát je vodný roztok extraktu krevních buněk (amébocytů) ostrorepa Limuluspolyphemus. V přítomnosti endotoxinu dochází k aktivaci faktorů obsažených v LAL a zahájení kaskádového proteolytického procesu, jehož výsledkem je štěpení bezbarvého substrátu přítomného v LAL. Proteolytické štěpení substrátu uvolňuje žlutý p-nitroanilin, který absorbuje světlo s vlnovou délkou 405 nm. Test se provádí přidáním Pyrochromu ke vzorku a následnou inkubací reakční směsi při 37 °C. Hodnoty se odečítají metodou konečného bodu (endpoint), kdy je měřeno množství uvolněného pNA po fixní době inkubace. Citlivost metody je 0,005 EU/1 ml (1) .
PFGE
Získané izoláty Escherichia coli, Klebsiella pneumoniae a Enterobacter cloacae byly charakterizovány molekulárně-biologickou typizací za použití PFGE. Celková DNA byla vyizolována podle následujícího postupu: Kolonie obou druhů byly vykultivovány na krevním agaru (Trios) a po pomnožení v Mueller-Hintonově bujónu (Trios) zcentrifugovány (3000 otáček po dobu 10 min). Následovalo opakované promytí v pufru (10 mM Tris/HCl, 10 mM EDTA, 10 mM EGTA, 1M NaCl, pH = 7,5) a zakoncentrování centrifugací (3000 otáček/10 min). Poté byly vzorky izolátů znovu naředěny v 10 ml stejného pufru na OD600= 0,3 a zcentrifugovány (3000 otáček po dobu 10 min). Získaná peleta byla resuspendována ve 100 μl výše jmenovaného pufru a bylo přidáno 100 μl rozpuštěné 2% low-melting-point agarózy (Bio-Rad). Po zatuhnutí ve formě byly vzniklé bločky přeneseny do 1 ml lyzačního roztoku (6mM Tris/HCl, 100 mM EDTA, 1M NaCl, 0,2% Na-deoxycholát, 0,5% laurylsarkosin, pH = 7,6 s 500 ug lysozymu) a inkubovány přes noc při 37 °C. Lyzační roztok byl vyměněn za 1 ml deproteinizačního roztoku (25 mM EDTA, 20 mM EGTA, 1% laurylsarkosin, pH = 9,0 a 500 μg proteinázy K) a bločky znovu inkubovány při 55 °C 12 hod. Po této inkubaci byly bločky opakovaně promyty v 10 ml promývacího roztoku (10 mM EDTA, pH = 8,0). Restrikční štěpení připravených agarózových bločků s imobilizovanou DNA bylo provedeno s použitím reštrikční endonukleázy Xbal (Sigma Aldrich) v 80 μl pufru. Bločky byly inkubovány při 37 °C po dobu 12 hod. PFGE byla provedena v 1,2% agarózovém gelu (Bio-Rad) s použitím 1x TBE pufru (Bio-Rad) na přístroji CHEF-DR II (Bio-Rad). Parametry reakce byly nastaveny na 24 hod. při 6 V/cm, pulzní časy 2-35 s, teplotu 14 °C. Po ukončení PFGE byl gel obarven v ethidium bromidu (1 (xg/ml; Sigma Aldrich) a zdokumentován při UV. Získané restrikční mapy jednotlivých kmenů byly porovnány programem GelCompare II(2) .
VÝSLEDKY
V pooperačním období po transplantaci jater (0.-21. den) bylo sledováno 14 nemocných.
U 8 z nich nedošlo ke zvýšení endotoxinu v séru, jeho hladiny se držely na nízké úrovni s průměrnou hodnotou 0,061 EU/1 ml. U 3 z těchto nemocných se nevyskytly mimostřevní infekční komplikace vůbec, u 5 byly zachyceny z perianálních stěrů gramnegativní bakterie a z mimostřevních lokalizací gramnegativní bakterie odlišných rodů a druhů a grampozitivní bakterie, nebyla tak prokázána souvislost mezi střevními a mimostřevními izoláty.
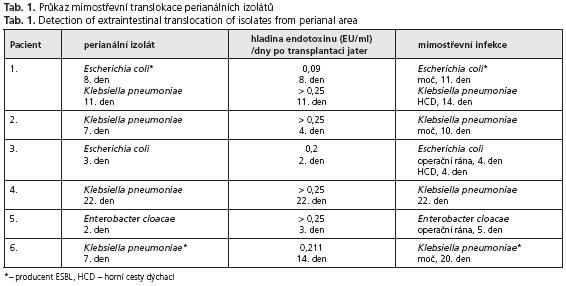
U 6 dalších pacientů byly zjištěny zvýšené hladiny endotoxinu, které předcházely nálezu mimostřevní infekce se zdrojem v gastrointestinálním traktu. Tento zdroj byl prokázán fenotypovou i genotypovou shodou vykultivovaných bakterií (tab. 1).
U 1. nemocného se v potransplantačním období nacházela fyziologická střevní mikroflóra, moč byla sterilní, výtěr z horních cest dýchacích rovněž obsahoval jen fyziologickou mikroflóru. Hladina endotoxinu v séru byla na nízké úrovni - 0,071 EU/1 ml. Osmý pooperační den se ve střevě objevila Escherichia coli s produkcí ESBL. Zároveň u pacienta došlo k vzestupu hladiny endotoxinu na hodnoty 0,09 EU/l ml. Jedenáctý den byl fenotypově stejný izolát zachycen i v moči. Metodou PFGE byl u obou izolátů Escherichia coli potvrzen shodný genotyp, jednalo se tedy o identický kmen. Ve stejné době byla ze stolice vypěstována Klebsiella pneumoniae, stejný kmen (fenotypová i genotypová shoda) byl po třech dnech nalezen i v horních cestách dýchacích. Hladina endotoxinu v této době zůstávala na vysokých hodnotách - více než 0,25 EU/1 ml.
Pacient 2 v potransplantačním období vykazoval fyziologické nálezy ve výtěrech perianálních i z horních cest dýchacích, moč byla sterilní. Hladiny endotoxinu v krvi se pohybovaly na nízkých hodnotách - 0,071 EU/1 ml, 0,051 EU/1 ml. Čtvrtý pooperační den došlo k vzestupu hladiny endotoxinu na hodnoty vyšší než 0,25 EU/1 ml a za 6 dní, tedy 10. den po operaci, se v moči objevila Klebsiella pneumoniae, identická s předcházejícím stejným izolátem ze stolice o tři dny dříve (opět fenotypová a genotypová shoda).
U 3. pacienta byla hned druhý pooperační den naměřena vysoká hladina endotoxinu (0,2 EU/1 ml), která další den stoupla na hodnotu vyšší než 0,25 EU/1 ml a zároveň byl nalezena Escherichia coli v perianálním steru. Následující den byl stejný izolát vykultivován z operační rány. Oba izoláty byly opět identické, jednalo se o jeden kmen, který navíc byl současně vypěstován i ze steru z horních cest dýchacích. K jeho translokaci ze střeva došlo pravděpodobně již v průběhu operace. Hladina endotoxinu v krvi se udržovala po celou dobu na uvedených vysokých hodnotách.
Nemocný 4 měl v potransplantačním období jen fyziologickou mikroflóru ve vzorcích z vyšetřovaných sliznic, nebyla zjištěna ani močová infekce. Až 22. pooperační den došlo k vzestupu do té doby nízké hladiny endotoxinu (0,092 EU/1 ml) až na hodnoty vyšší než 0,25 EU/1 ml séra a zároveň se objevila v moči Klebsiella pneumoniae, identická s izolátem ze stolice.
U 5. pacienta byl již od druhého pooperačního dne izolován ze stolice Enterobacter cloacae, moč byla sterilní a ve výtěru z horních cest dýchacích byla nalezena jen fyziologická mikroflóra. Hladina endotoxinu byla nízká, pohybovala se kolem 0,05 EU/1 ml. Třetí den došlo k jejímu vzestupu na hodnotu vyšší než 0,25 EU/1 ml, pátý den se objevil v sekretu z operační rány Enterobacter cloacae se stejným fenotypem a genotypem, jako byl zjištěn u dřívějšího izolátu ze stolice. Sedmý den po operaci již sekret z rány byl sterilní a současně hladina endotoxinu poklesla na hodnoty 0,16 EU/1 ml až nulové.
Pacient 6 měl v potransplantačním období fyziologické nálezy ve stolici i horních cestách dýchacích, moč byla sterilní. Hladiny endotoxinu byly nízké (0,06 EU/1 ml). Sedmý den se ve stolici objevila Klebsiella pneumoniae s produkcí ESBL. Kmen ve stolici přetrvával, aniž by došlo ke klinickým projevům infekce. Za sedm dní, tedy 14. den po transplantaci, došlo ke zvýšení hladiny endotoxinu na hodnoty 0,211 EU/1 ml až více než 0,25 EU/1 ml a 20. den po operaci, tzn. pět dní po vzestupu endotoxinu, se tentýž kmen objevil v moči, hladina endotoxinu zůstávala na vysoké hodnotě.
U všech popsaných klinických případů tak lze konstatovat translokaci agens z gastrointestinálního traktu do primárně sterilních lokalit transplantovaných za vzniku infekční komplikace a současně praktickou užitečnost prováděného monitoringu.
DISKUSE
Pacienti s chronickým jaterním onemocněním a v pooperačním období jsou zvýšeně ohroženi infekcemi, jejichž původci jsou zástupci přirozené mikroflóry člověka, zejména gastrointestinálního traktu(3). Je známo, že bakteriální infekce je u nemocných s jaterní cirhózou častá, v literatuře je uváděn až 40% výskyt (4) . Tyto infekční komplikace jsou nejčastěji způsobeny gramnegativními střevními tyčinkami. Z literatury je zřejmé, že až u 50 až 70 % takto nemocných dochází k bakteriální kolonizaci tenkého střeva až do jeho proximální části postupným šířením ze střeva tlustého. Opakovaně bylo prokázáno jejich přerůstání ve střevě a následná zvýšená translokace v důsledku dysfunkce střevní slizniční bariéry, roli hraje také narušená motilita tenkého střeva a změny ve složení střevní mikroflóry ve prospěch fakultativně anaerobních bakterií čeledi Enterobacteriaceae na úkor rodů Lactobacillus a Bifidobacterium (5). U těžce nemocných pacientů, kterými nemocní s jaterní cirhózou a po transplantaci jaterní bezesporu jsou, je narušena motilita tenkého střeva, vedoucí k bakteriálnímu přerůstání a s tím související bakteriální translokaci, způsobenou dysfunkcí střevní slizniční bariéry. Rovněž principy intenzivní péče, jako jsou umělá plieni ventilace, aplikace morfinu a další, dysfunkčnost zánětem alterované motility ještě potencují. Studie také ukazují, že ileus se může vyskytnout u více než 40 % kriticky nemocných pacientů. U pacientů s jaterní cirhózou se na zvýšené střevní propustnosti, a tedy zhoršené funkčnosti střevní bariéry, podílí zejména portální hypertenze (6) . U pacientů s jaterní cirhózou a portální hypertenzí klesá cévní rezistence a stoupá splanchnický průtok. Tyto změny působí hypoperfuzi střevní sliznice a hypoxii, která dále poškozuje střevní stěnu. V důsledku poškození pak snadno dochází k translokaci střevních bakterií (7,8) .
Pojem bakteriální translokace byl poprvé použit v roce 1979(9). Bakteriální translokace je definována jako aktivní či pasivní penetrace živých mikroorganismů a jejich toxinů extraluminálně - skrze epiteliální vrstvu sliznice do lamina propria mucosae. Odtud bakterie migrují do mezenteriálních lymfatických uzlin a/nebo do extraintestinálních lokalizací(9) . Za normálních podmínek jde o malé množství endogenních bakterií, které jsou pohotově ničeny imunitním systémem v lamina propria, což je umožněno jednak malým množstvím bakterií, jednak indukcí specifické imunitní odpovědi v Peyerských placích. Translokace je možná teprve při vysokém množství bakterií ve střevě (v literatuře je uváděno až 108 bakterií v 1 gramu stolice) (10-12) .
Bakterie, které uniknou fagocytům a destrukci komplementem, mohou proniknout až do krve. Enterobakterie, stafylokoky a enterokoky mají schopnost translokovat, tedy živě přecházet, přes střevní epitel do mezenteriálních lymfatických uzlin, krve a ostatních orgánů, zatímco většina anaerobních mikroorganismů tuto vlastnost postrádá. Bakteriální translokace je prokazatelná pozitivitou kultivace z mezenteriálních lymfatických uzlin. Hlavními mechanismy vedoucími k translokaci jsou deficit lokální slizniční imunitní odpovědi, pokles fagocytární aktivity makrofágů i neutrofilů, zvýšená propustnost střevní bariéry a zmíněné intestinální bakteriální přerůstání(10,13) .
Faktory, které ovlivňují bakteriální translokaci, lze rozdělit do tří skupin. Jednak je to faktor bakteriální, představující povahu translokujícího agens a stav okolní fyziologické mikroflóry, jednak faktor střevní stěny, tedy její morfologický a funkční stav, v neposlední řadě tzv. defenzivní faktory, lokální a systémové antibakteriální aktivity organismu (fagocytóza apod.) (11-14) . Přítomnost komenzální bakteriální mikroflóry je důležitá pro všechny obranné systémy (15) . Biologický tlak střevních mikrobů je nezbytný pro udržení slizniční bariérové funkce (16) . Porušení normální mikrobiální rovnováhy (např. u akutní pankreatitidy jaterní cirhózy vlivem aplikace morfinu) vyús»uje v dysfunkci slizniční bariéry způsobuje vzestup bakteriální translokace a mimo střevo se tak dostávají potenciálně patogenní bakterie. Současné a/nebo neadekvátní podávání antibiotik může vést k selekci rezistentních kmenů, jak se stalo i u našich pacientů, kdy producenti širokospektrých betalaktamáz ze střeva se stali původci infekcí v extraintestinálních lokalizacích. Neadekvátní podávání antibiotik tak může způsobit bakteriální selekci a potenciální zhoršení stavu (17). Pokud ale obligátní anaerobní střevní bakterie převyšují svým množstvím více než 100x aerobní druhy, pak k translokaci dochází jen výjimečně (18).
Je známé, že místní zánětlivé změny způsobují gastrointestinální hypomotilitu až ileus (19) . Zhoršení průchodu střevem je pak spojeno s přerůstáním bakterií do tenkého střeva. Bakteriální přerůstání do tenkého střeva je nejčastějším mechanismem vedoucím k bakteriální translokaci do extraintestinálních systémů. Fulminantní translokace může vyústit v bakteriémii. Koncept bakteriální translokace jako predisponujícího faktoru vzniku infekce je dále podpořen daty ukazujícími, že bakterie izolované z mezenteriálních lymfatických uzlin jsou geneticky identické s kmeny způsobujícími spontánní bakteriální peritonitidu u stejných zvířat (20) . Také u našich pacientů byla shoda v genotypu u bakterií, které byly vykultivovány z gastrointestinálního traktu s bakteriemi, které jsme izolovali ze sekundárních infekčních ložisek.
Zvýšení hladiny endotoxinu jako součásti stěny gramnegativních bakterií je fenomén považovaný za důkaz translokace bakterií ze střeva do krevního oběhu. Bývá pozitivní u cirhotických pacientů bez zjevné infekce, a předchází tak možnému pozdějšímu rozvoji těžké bakteriální infekce (21) .
Pro detekci poruchy permeability má měření hladiny endotoxinu významnou výpovědní hodnotu. Endotoxémie je u cirhotiků častým nálezem a hraje důležitou roli i při stimulaci cytokinů, které mohou ovlivnit tvorbu a degradaci extracelulární matrix, což je důležité při rozvoji jaterní fibrózy i cirhotické přestavby (22-24) . Systémová endotoxémie bez nálezu gramnegativní bakteriémie je častá u lidí s onemocněním jater. Pravděpodobně je způsobena jednak zhoršením jaterní clearance endotoxinu absorbovaného z gastrointestinálního traktu, jednak zvýšenou permeabilitou střevní slizniční bariéry. Hladiny endotoxinu lze vyšetřovat pomocí Limulus testu, který odhaluje jejich zvýšení především u pacientů po chirurgických zákrocích, i když ještě nejsou patrné klinické známky endotoxémie (25) . Rovněž u našich pacientů předcházel vzestup krevní hladiny endotoxinu mimostřevní infekční komplikace, způsobené stejným kmenem již dříve izolovaným z perianální oblasti. Patogenní uplatnění translokovaných kmenů u našich nemocných bylo zaznamenáno v močových cestách a operačních ranách, další byl zachycen jako kolonizující agens dýchacích cest s následnou možností rozvoje bronchopneumonie. Detekce zvýšené hladiny endotoxinu jako markeru translokace gramnegativních bakterií tak může být užitečným nástrojem časné diagnostiky infekčních komplikací, zejména u nemocných po transplantaci jater.
Práce byla podpořena výzkumným záměrem MŠMT MSM 6198959223 a grantem Interní grantové agentury MZ ČR č. NR 9116-3.
LITERATURA
- 1. Lindsay GK, Roslansky PF, Novitsky TJ. Single-step, chromogenic Limulus amebocyte lysáte assay for en-dotoxin. J Clin Microbiol 1989; 27: 947-951.
- 2. Ernjaes K, Sandvag D, Lundgren B, et al. Pulsed field gel electroforesis Typing of Escherichia coli Strains from samples collected before and after Pivmecillinam or placebo treatment of uncomplicated community-acquired urinary tract infection in women. Journal of Clinical Microbiology 2006; 39: 1776-1781.
- 3. Overhaus M, Togel S, Pezzone M, Bauer AJ. Mechanisms of polymicrobial sepsis-induced ileus. Am J Physiol Gastrointest Liver Physiol 2004; 287: 685-694.
- 4. Campillo B. Nosocomial spontaneous bacterial peritonitis and bacteremia in cirrhotic patients. Clin Infect Dis 2002; 35: 1-9.
- 5. Floch MH, Katz J, Conn H. Qualitative and quantitative relationships of the fecal flora in cirrhotic patients with portal systemic encephalopathy and following potrocaval anastomosis. Gastroenterology, 1970; 59: 70-75.
- 6. Ersôz G, Aydin A, Erdem S, et al. Intestinal permeability in liver cirrhosis. Europian J Gastroent Hepatol 1999; 11: 409.
- 7. Goulis J, Patch D, Burrougs AK. Bacterial infection in the patogenesis of variceal bleeding. Lancet 1999; 353: 139.
- 8. Lata J, Vaňásek T. Kritické stavy v hepatologii. 1. vydání. Praha: Grada Publishing 2005; 168.
- 9. Berg R, Garlington A. Translocation of certain indigenous bacteria from the gastrointestinal tract to the mesenteric lymph nodes and other organs in a gnoto-biotic mouse model. Infect Immun 1979; 23: 403-411.
- 10. Guarner C, Runyon BR, Young S, et al. Intestinal bacterial overgrowth and bacterial translocation in cirrhotic rats with ascites. J Hepatology 1997; 26: 1372-1378.
- 11. Zbořil V. Mikroflóra trávicího traktu - klinické souvislosti. Praha: Grada Publishing 2005; 23-33.
- 12. Hanson LA, Yolken RH. Probiotics, other nutritional factors and intestinal microflora. Philadelphia: Lippincot-Raven 1999; 18-67.
- 13. Ramachandran A, Balasubramanian K. Intestinal dysfunction in liver cirrhosis. Its role in spontaneous bacterial peritonitis. J Gastroenterol Hepatol 2001; 16: 607-612.
- 14. Thalheimer U, Triantos CK, Samonakis DN. Infection, coagulation and variceal bleeding in cirrhosis. Gut 2005; 54: 556-563.
- 15. Guarner F, Malagelada J. Gut flora in health and disease. Lancet 2003; 361: 512-519.
- 16. Hooper L, Gordon J. Commensal host-bacterial relationships in the gut. Science 2001; 292: 1115-1118.
- 17. Kolář M. Antibiotická léčba nozokomiálních infekcí. Praha: Triton 2000.
- 18. Steffen EK, Berg RD, Deitch EA. Comparison of translocation rates of various indigenous bacteria from tha gastrointestinal tract to the mesenteric lymph node. J Infect Dis 1988; 157: 1032-1037.
- 19. Berg RD. Bacterial translocation from the gastrointestinal tract. Trends Microbiol 1995; 3: 149-154.
- 20. Llovat JM, Bartoli R, March F, Planas R. Translocated intestinal bacteria cause spontaneous bacterial peritonitis in cirrhotic rats: molecular epidemiologie evidence. J Hepatol 1998; 28: 307-313.
- 21. Albillos A, de-la Herra A, Alvarez-Mon M. Serum lipopolysaccharide-binding protein prediction of severe bacterial infection in cirrhotic patiens with ascites. Lancet 2004; 363: 1608-1610.
- 22. Wu CD, Li MZ, Chen CL. Endotoxin-induced liver injury and plasma tumor necrosis factor alfa, inter-leukin 6 level changes in rabbits. Chin J Dig Dis 1995; 15: 256-258.
- 23. Hai YZ, Hui JW, Zhi L. Intestinal microflora in patients with liver cirrhosis. Chin J Dig Dis 2004; 5: 64-72.
- 24. Lata J. Portální hypertenze při jaterní cirhóze a její důsledky. Plzeň, PA: GAAN CZ 2000
- 25. Kimura Y, Nakao A, Tamura H, Tanaka S. Clinical and experimental studies of the limulus test after digestive surgery. Surg Today 1995; 25: 790-794.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené