Kolitida vyvolaná Clostridium difficile - rizikové faktory, hypervirulentní kmen a nové terapeutické možnosti
Lenka Vojtilová Orcid.org 1, Petr Husa1, Radek Svoboda Orcid.org
+ Pracoviště
Souhrn
Postantibiotické průjmy jsou v medicíně známy již desítky let. S érou moderní medicíny, rozsáhlým používáním širokospektrých antibiotik a rostoucí řadou polymorbidních a imunokompromitovaných pacientů roste počet onemocnění vyvolaných C. difficile (Clostridium difficile - associated diarrhea - CDAD). V posledních letech stoupá nejen incidence, ale i závažnost onemocnění, mortalita a počet léčebných selhání. Od roku 2003 jsou z vyspělých zemí Ameriky, Evropy a Asie hlášeny epidemie CDAD a v nemocnicích jsou identifikovány tzv. epidemické kmeny C. difficile, nejčastěji kmen NAP1/027. Článek přináší přehled rizikových faktorů pro vznik onemocnění, možnosti ovlivnění vzniku a šíření onemocnění a náhled na nové aspekty terapie.
Klíčová slova: Clostridium difficile - hypervirulentní kmen - pseudomembranózní kolitida.
ÚVOD
Historie postantibiotických průjmů se datuje již do začátku éry antibiotik. První zmínka o Clostridium difficile jako původci pseudomembranózní kolitidy pochází z roku 1978, toxiny A a B byly popsány o tři roky později. Ne všechny postantibiotické průjmy jsou spojené s infekcí C. difficile (jen asi jedna třetina případů). Další příčinou může být přemnožení Staphylococcus aureus, Clostridium perfringens nebo nejčastěji kvasinek na úkor střevní mikroflóry. V 70. letech minulého století byl ze vzniku postantibiotických průjmů nejvíce obviňován klindamycin, v 80. letech pak cefalosporiny vzhledem k rozšíření jejich užívání. V posledních letech se zdá, že nejdůležitější roli v patogenezi postantibiotického průjmu spojeného s C. difficile (Clostridium difficile - associated diarrhea - CDAD) hrají fluorochinolony(1,2).
CLOSTRIDIUM DIFFICILE A JEHO FAKTORY VIRULENCE
Klostridia jsou grampozitivní anaerobní tyčky (obr. 1), které se vyskytují ve vegetativní nebo klidové formě (spory). V přírodě jsou rozšířeny v půdě, v bahně, v prachu, na rostlinách. U živočichů a člověka jsou některé druhy komenzály tlustého střeva, druhy produkující exotoxiny se mohou uplatnit jako patogeny - např. C. difficile, C. perfringens.
Genom C. difficile byl již kompletně zmapován. Vegetativní forma bakterie produkuje dva termolabilní proteinové toxiny: A (enterotoxin) a B (cytotoxin). Toxin A způsobuje cytokiny zprostředkovanou hypersekreci tekutin a hemoragicko-zánětlivý proces na sliznici střeva. Toxin B odpovídá za apoptózu ovlivněním aktinového cytoskeletu buňky. Produkce toxinů A a B je řízena principem down-regulace dvěma regulačními geny (tcdC a tcdD). Nově byl popsán ještě binární toxin(3,4).
EPIDEMIOLOGIE CLOSTRIDIUM DIFFICILE A HYPERVIRULENTNÍ KMEN NAP1/027
Od roku 2002 je ve vyspělých zemích Severní Ameriky, Evropy a Asie hlášena vyšší incidence CDAD s mnohem těžším průběhem onemocnění, vyšší letalitou, tendencí k relapsům, delší dobou hospitalizace a zvýšenými náklady na léčbu. Zprávy uvádějí onemocnění CDAD i ve skupině lidí, která byla dříve považována za minimálně ohroženou, např. mladší pacienti, těhotné ženy a ženy po porodu, ambulantní pacienti, pacienti bez anamnézy užívání antibiotik(2,5). Tyto epidemie jsou převážně spojeny s infekcí kmenem C. difficile, v literatuře uváděným jako NAP1 (North American pulsed-field type 1) podle specifického sledu linií při pulzní gelové elektroforéze (PFGE). Poprvé byl kmen NAP1 izolován v Kanadě, vzápětí i v USA a v Evropě. Na základě PCR (polymerase chain reaction) ribotypizace je NAP1 označen jako ribotyp 027(2,5,6).
Kmen NAP1/027 je hypertoxigenní, má schopnost epidemického šíření vzhledem k větší odolnosti jeho spor a vysoké rezistenci vůči různým antibiotikům. Epidemický kmen má deleci na 117. místě regulačního tcdC genu, který ochromením down-regulace produkce toxinů A a B vede k 16- až 23násobnému vzestupu jejich produkce. Dále produkuje binární toxin, obdobný iota toxinu C. perfringens. Role binárního toxinu na průběh onemocnění není zatím zcela vyjasněna, kmeny produkující tento toxin jsou sice provázeny těžším průběhem onemocnění, ale kmeny s negativním toxinem A a B a pozitivním binárním toxinem se jeví jako nepatogenní. Kmeny s delecí tcdC genu a produkcí binárního toxinu byly před rokem 2000 vzácné. Dále je popisováno rozšíření rezistence na nové fluorochinolony, které se pokládá za hlavní příčinu širokého rozšíření NAP1/027. Kmen má navíc ve srovnání s neepidemickými kmeny tendenci k hypersporulaci, která umožňuje dlouhodobé přežívání v zevním prostředí a gastrointestinálním traktu. Vzhledem k rezistenci spor k běžným dezinfekčním prostředkům je tímto umožněno přežívání bakterií a šíření infekce v nemocničním prostředí(2,4,6,7).
RIZIKOVÉ FAKTORY VZNIKU CDAD
Užívání antibiotik je považováno za nejzávažnější rizikový faktor pro kolonizaci C. difficile. Všechna antibiotika porušují normální střevní mikroflóru včetně antibiotik, která se používají k terapii CDAD. Nejrizikovější skupinou antibiotik je klindamycin, cefalosporiny a nově i fluorochinolony. Dalším aspektem je délka podávání antibiotika a míra jeho preskripce. Kmeny klostridií rezistentní na podávaná antibiotika mají větší potenciál ke kolonizaci a k rozvoji klinického onemocnění. Epidemické kmeny NAP1 mají geneticky podmíněnou rezistenci na fluorochinolony, makrolidy a klindamycin. Za relativně bezpečnou skupinu antibiotik se považují aminoglykosidy, kotrimoxazol, základní peniciliny, karbapenemy a tetracykliny(2,5,7).
Riziko infekce C. difficile se u hospitalizovaného pacienta zvyšuje díky možnosti přežívání spor v nemocničním prostředí (až 5 měsíců) a jejich rezistenci vůči běžným alkoholovým dezinfekčním prostředkům. Klostridia se mohou šířit rukama zdravotnických pracovníků při nedodržování hygienických opatření, společnými toaletami a sprchami pacientů, rizikové jsou i pomůcky pro enterální výživu. Při péči o pacienty s CDAD je nutná jejich izolace a bariérová opatření. K odstranění spor C. difficile je mnohem účinnější mechanické mytí rukou mýdlem a vodou a dezinfekce povrchů sporicidními prostředky s chlórovým základem(2). Snížená kyselost žaludečního sekretu predisponuje ke zvýšené náchylnosti k řadě infekcí. Byla provedena řada studií s pacienty užívajícími antagonisty H2 receptorů nebo inhibitory protonové pumpy, jednoznačně zvýšené riziko vzniku CDAD však nebylo prokázáno(8).
Důležitou roli ze strany hostitele hraje při infekci C. difficile jeho imunita a komorbidity. Nejrizikovější skupinou ke vzniku CDAD jsou pacienti trpící onkologickým onemocněním, ulcerózní kolitidou, malnutriční pacienti, hemodialyzovaní, pacienti s utlumenou střevní motilitou. Stárnutí imunitního systému s věkem pacienta, častější a delší hospitalizace, mnohočetné komorbidity a častější užívání antibiotik jsou pravděpodobnou příčinou většího procenta nemocných CDAD ve vyšším věku (nad 65 let).
Hostitelé, kteří nevytvoří během kolonizace C. difficile dostatečnou hladinu sérových IgG protilátek proti toxinu A, jsou 48násobně náchylnější k rozvoji manifestního CDAD. Snížení počtu slizničních buněk produkujících slizniční IgA a makrofágů vede zase ke zvýšenému počtu rekurencií CDAD(2).
KLINICKÁ CHARAKTERISTIKA CDAD A LABORATORNÍ NÁLEZY
Hlavními příznaky CDAD jsou průjmy, horečka a bolesti břicha. Průjem je kašovitý až vodnatý, často s příměsí hlenu, makroskopická příměs krve není konstantní. Stolice je vyměšovaná jen v malých porcích, u starších a nespolupracujících pacientů může být průjem zaměněn za inkontinenci. Břicho je často meteoristické a difuzně bolestivé. Zvracení není typickým příznakem. Stav se může komplikovat vznikem subileu až ileu, rozvojem toxického megakolon s možnou perforací střeva a peritonitidou. Rozvoj komplikací, zejména u starých a imunokompromitovaných pacientů, může být nečekaně rychlý. Laboratorně je přítomna elevace zánětlivých parametrů, typicky leukocytóza přes 20 × 109/l, s neutrofilií a posunem doleva. Hodnota C-reaktivního proteinu (CRP) je zvýšena, ale často málo výrazně, což kontrastuje s výraznou leukocytózou. Onemocnění může probíhat i fulminantně (asi 3 % případů CDAD) s vysokou letalitou, velmi výraznou leukocytózou (nad 50 × 109/l) a vysokou hladinou laktátu v krvi (nad 5,0 mmol/l)(9,10).
Na nativním snímku břicha v pokročilých fázích onemocnění lze pozorovat vymizení plynu v tračníku a s tím související obraz ileu v kličkách tenkého střeva(9). Při abdominální sonografii obdobně jako při CT vyšetření břicha je v těžších případech patrné ztluštění stěny tračníku a volná tekutina v dutině břišní. Nález není pro diagnózu CDAD patognomický, pomáhá však posoudit závažnost stavu.
ETIOLOGICKÁ DIAGNOSTIKA
Vzhledem k časté kolonizaci střeva netoxigenními kmeny C. difficile je diagnostika CDAD postavena na průkazu produkce toxinu A nebo B. Vyšetřovaným materiálem je vzorek stolice pacienta. V České republice jako referenční a poradní pracoviště pro mikrobiologickou diagnostiku CDAD působí Ústav klinické mikrobiologie ve Fakultní nemocnici Motol v Praze.
V praxi se nejčastěji používají rychlé diagnostické testy na principu enzymové imunoeseje ELISA (Enzyme Linked Immunosorbent Assay) nebo imunofluorescenční eseje ELFA (Enzyme Linked Fluorescent Assay). Metoda ELISA je dostatečně senzitivní, je možnost vyšetření jen toxinu A, nebo obou toxinů A a B. Současným stanovením obou toxinů se zvyšuje senzitivita vyšetření až na 88 až 93 %, specificita je prakticky 100%. Metoda ELFA je po stránce senzitivity i specificity srovnatelná s metodou ELISA, zatím jsou však k dispozici jen soupravy umožňující pouze detekci toxinu A. Další možností je test na principu imunochromatografie, nevýhodou je však nižší citlivost oproti imunoeseji a vysoké procento falešné pozitivity výsledků(9,10).
Průkaz toxinu C. difficile ve stolici při klinickém obrazu onemocnění je směrodatný pro diagnózu CDAD. Při negativním výsledku a trvajícím klinickém podezření na CDAD je doporučeno opakovat vyšetření stolice do 48 hodin, eventuálně vyšetřit i třetí vzorek stolice(10).
Selektivní kultivační vyšetření C. difficile je časově náročnější, není vhodné k rychlé diagnostice a běžně se neprovádí. U vykultivovaného kmene je možné následně ověřit produkci toxinu imunoesejí, nebo provést test citlivosti k antibiotikům u klinicky suspektní rezistence. Při podezření na nozoko miální epidemický kmen je doporučována typizace izolovaného kmene. Nově je zaváděna PCR detekce genu pro toxin u vykultivovaného kmene. Může odhalit toxigenní kmeny, které byly metodou ELISA určeny jako toxin negativní(5,10).
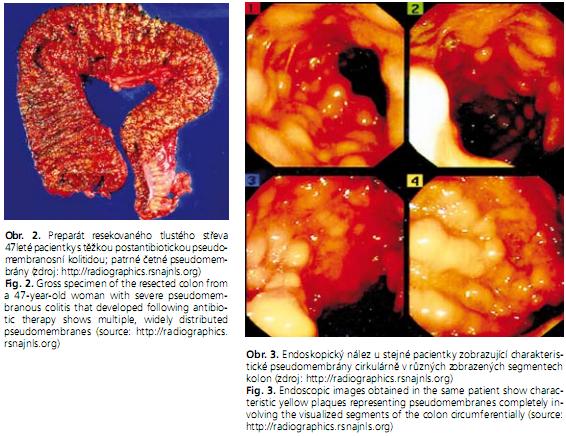
Endoskopie není vzhledem k invazivní povaze vyšetření doporučována jako metoda první volby, někdy je uváděna u CDAD za relativně kontraindikovanou. Při respektování všech kontraindikací je metodou s téměř 100% senzitivitou a specificitou ve fázi pseudomembranózní kolitidy. Makroskopicky je pro CDAD charakteristická hyperemická edematózní sliznice pokryta pablánami (žlutobílými povlaky o velikosti kolem 5 mm), které mohou splývat (obr. 2, 3). Většinou se vyskytují na vrcholu řas a po jejich stržení je na spodině patrný vřed. Sliznice mezi pablánami může vypadat makroskopicky zcela normálně. Není-li onemocnění ve fázi tvorby pablán, je nález necharakteristický, jen s okrsky zánětlivě změněné sliznice ve smyslu edému a zarudnutí, což senzitivitu vyšetření výrazně snižuje. Vhodný je odběr bioptického vzorku, eventuálně vzorku k vyšetření toxinu. Maximum patologických změn sliznice střeva se nachází v sigmatu, proto je pro určení diagnózy někdy postačující sigmoideoskopie po rychlé přípravě klyzmatem(9).
Při histologickém vyšetření bioptického vzorku sliznice střeva jsou nacházeny v místě pablány nekrózy epitelu se zánětlivou infiltrací polymorfonukleárů. Pablány jsou tvořeny fibrinem, mucinem, leukocyty a buněčným detritem. Sliznice v okolí pablán může mít normální nález, nebo jsou přítomny jen edematózní změny. Mikroskopický obraz pseudomembranózní kolitidy při CDAD je někdy obtížně odlišitelný od ulcerózní kolitidy(9).
REKURENCE CDAD
Po zvládnutí akutního stavu trvá ještě několik týdnů střevní dysmikrobie a je zvýšené nebezpečí reinfekce a zejména nového pomnožení toxigenních kmenů ze spór přežívajících ve střevě (relaps). V klinické praxi je někdy nemožné rozlišit tyto dvě různé příčiny opakování CDAD, proto je terminologie v odborné literatuře v tomto ohledu nejednotná.
Opakované onemocnění se projevuje stejnými klinickými symptomy jako první epizoda. Nejčastěji se symptomy vracejí po 2-10 dnech po ukončení antibiotické terapie CDAD, jsou ale popisovány i opožděné rekurence po 2 týdnech až 2 měsících. Diagnóza rekurence je možná po úplném vymizení příznaků první infekce a po vyloučení jiné příčiny aktuálních symptomů. Pro potvrzení diagnózy je opět nutný průkaz toxinu ze stolice. Různé zdroje uvádějí procento rekurence po léčené první epizodě CDAD u 15-30 % pacientů. Po iniciální terapii metronidazolem byl oproti terapii vankomycinem popsán lehce vyšší počet rekurencí, proto se pro další následnou terapii doporučuje vankomycin (viz dále). Rekurencí nejvíce ohroženou skupinou pacientů jsou pacienti vyššího věku, polymorbidní, imunokompromitovaní, dlouhodobě a opakovaně hospitalizovaní a opětovně léčení antibiotiky(2,4).
TERAPIE A NOVÉ TERAPEUTICKÉ ASPEKTY
Metronidazol nebo vankomycin
Prvním terapeutickým opatřením u rozvinuté CDAD je vysazení vyvolávajícího antibiotika. Lehké formy CDAD se doporučuje léčit jen dostatečnou hydratací a dietními opatřeními. U středně těžkých a těžkých forem je možné použít metronidazol nebo vankomycin. Asi 3 % kmenů C. difficile jsou rezistentní vůči metronidazolu(10). Rutinní testování citlivosti C. difficile na antibiotika se zatím neprovádí. Terapie metronidazolem je výrazně levnější a není tak riziková vzhledem k šíření antibiotické rezistence jako terapie vankomycinem.
Metronidazol je doporučován jako lék první volby u první nebo druhé epizody středně těžké formy onemocnění v dávce 500 mg a 8 hodin perorálně, terapie by měla trvat 10-14 dní. Selhání léčby je možno posuzovat po 4-6 dnech terapie při nelepšících nebo zhoršujících se symptomech. Po vyloučení jiných komplikací je indikován vankomycin 125 mg a 6 hodin perorálně.
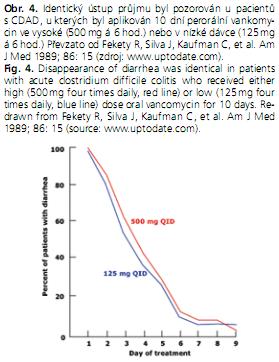
Vankomycin jako lék první volby je indikován u těžkých stavů, u třetí a další epizody CDAD a při intoleranci metronidazolu(2). Co se týče účinku, je jednotlivá dávka 125 mg vankomycinu ekvivalentní dávce 500 mg, je však výrazně ekonomicky výhodnější, a proto se jí dává přednost (obr. 4). U mírnějších forem CDAD bylo procento pacientů vyléčených metronidazolem a vankomycinem stejné, u těžkých forem byl vankomycin účinnější (92 % vyléčených vs. 77 %) (10).
U pacientů s ileem nebo toxickým megakolon se podává kombinace metronidazolu (500 mg a 6-8 hodin intravenózně) a vankomycinu (500 mg a 6 hodin ve formě vysokého klyzmatu). Vankomycin se instiluje do rekta pomocí Foleyova katétru, po utěsnění v rektu balonkem se podá 500 mg vankomycinu v 100 ml fyziologickém roztoku a ponechá se po dobu 30-60 minut. Při neúspěchu konzervativní terapie je u toxického megakolon možnost provedení Turnbullovy dekompresní operace s možností aplikace antibiotik cestou cékostomie(9). U rozvinutého toxického megakolon nebo při perforaci střevní stěny je ke zvážení provedení kolektomie jako poslední terapeutické možnosti. Kolektomie může být přínosem pro pacienty ve věku ≥ 75 let, u osob s APACHE II skórem ≥ 28 a s leukocytózou 20-50 × 109/l. Naopak u pacientů s leukocytózou > 50 000 × 109/l a hladinou laktátu v séru > 5 mmol/l již operace nevedla ke zlepšení mortality(2,5).
Terapie rekurencí CDAD
U druhé a další rekurence CDAD se podává standardní dávka vankomycinu perorálně 2-3 týdny. Vyšší dávka 500 mg a 6 hodin p.o. nemá vliv na snížení rekurencí(2). Doporučuje se následná pulzní terapie nebo terapie ve snižujících se dávkách. Tento postup je však rizikový z hlediska rozvoje rezistence enterokoků. Z dalších terapeutických postupů při relabujícím CDAD se zkouší kombinace vankomycinu a rifampicinu, vankomycinu s následným podáváním rifaximinu, podání lidského intravenózního imunoglobulinu nebo transplantace stolice.
Léčiva, u kterých byl jejich efekt přehodnocen
Efekt probiotik je v poslední době zpochybňován. Nejsou k dispozici validní studie prokazující jejich efekt v léčbě rozvinutého CDAD, naproti tomu je evidentní možnost poškození pacienta při bakteriémii (Lactobacillus spp.) nebo fungémii (Saccharomyces boulardii). Navíc při použití živých laktobacilů zároveň s kauzální antibiotickou terapií (vankomycin) budou bakterie probiotika zahubeny. Prokázán je zatím jen nepatrný efekt S. boulardii v prevenci recidivy CDAD(2,5,8,9).
Dříve užívaná střevní adsorbencia cholestyramin a kolestipol, která měla teoreticky vázat toxiny C. difficile, již rovněž nejsou doporučována. U kolestipolu nebyl prokázán ve srovnání s placebem žádný efekt, adsorbencia ale mohou zároveň vázat podávaná účinná léčiva, proto mají pro pacienta potenciálně škodlivý účinek(2,5).
Další perspektivní možnosti terapie CDAD
Tolevamer, tekutý polystyrenový preparát vázající toxin A a B, je ve studiích s léčbou lehké a středně těžké formy CDAD srovnatelný s terapeutickým efektem vankomycinu, má ale nižší výskyt relapsů onemocnění. Neovlivňuje střevní mikroflóru, je dobře tolerován a způsobuje hypokalémii(2,10).
Rifaximin je nevstřebatelný derivát rifamycinu, je zkoušen zejména v terapii relapsů CDAD. Existují však zprávy o in vitro rezistenci kmenů C. difficile v asi 3 % případů. Zatím není rifaximin doporučován v konvenční terapii CDAD, dokud nebude jeho efekt potvrzen větší studií. Při delším podávání rifaximinu hrozí rychlý rozvoj rezistence. Zkouší se i kombinace rifampicinu s vankomycinem. Řada nových antibiotik je ve 3. fázi klinických studií. Nejslibnější výsledky má difimicin, nevstřebatelné úzkospektré baktericidní antibiotikum s nízkou aktivitou vůči střevní mikroflóře a vysokou aktivitou na C. difficile(2,10).
Efekt transplantace stolice od zdravých příbuzenských dárců v prevenci recidiv CDAD byl prokázán zatím jen u malého počtu pacientů. Vzhledem k možnému riziku přenosu jiných infekčních agens a etickým aspektům této metody zatím není paušálně doporučována. U pacientů refrakterních na konvenční léčbu je jako adjuvantní terapie zkoušeno podávání lidského intravenózního imunoglobulinu, zatím je prokázán jen efekt u pacientů s hypogamaglobulinemií. Jsou zkoušeny lidské monoklonální protilátky proti toxinu A a B, perorální hyperimunní bovinní sérum a toxoidová vakcína(2,6,10).
ZÁVĚR
Výskyt hypervirulentního kmene C. difficile v kombinaci se současnou vysokou spotřebou antibiotik může vyvolat ještě rozsáhlejší a těžší epidemie v mnoha zemích, než je tomu v současnosti. V anglické literatuře je tato hrozba označovaná jako "perfect storm". Prevence a kontrola infekcí vyvolaných C. difficile spočívá na dvou základních principech - omezení vzniku a omezení šíření infekce. Vznik CDAD je úzce vázán na široké užívání širokospektrých antibiotik, proto je racionální antibiotická politika základem ke snížení výskytu infekcí. Fluorochinolony se zdají být pro soustavné užívání v nemocnicích nevhodné. Rozvracejí přirozenou mikroflóru a podporují kolonizaci a infekci multirezistentními a nozokomiálními kmeny (kromě C. difficile i meticilin rezistentní stafylokoky a multirezistentní gramnegativní tyčinky). Rychlá diagnóza již vzniklého onemocnění a omezení šíření infekce zabrání vzniku rozsáhlých nemocničních epidemií. Základem je izolace pacienta (nejlépe na infekčním oddělení), bariérová ochrana a jednorázové pomůcky, hygiena rukou personálu spočívající v mytí rukou mýdlem a vodou a dezinfekce povrchů sporicidními prostředky. Vzhledem k riziku zamoření prostředí spórami klostridií, měla by se aktivní surveillance provádět na každém oddělení, kde se CDAD vyskytlo, přinejmenším po dobu několika měsíců.
LITERATURA
- 1. Bartlett JG, Perl TM. The new Clostridium difficile - what does it mean? N Engl J Med 2005; 353: 2503- 2505.
- 2. Owens RC. Clostridium difficile - associated disease. Changing epidemiology and implications for management. Drugs 2007; 67: 487-503.
- 3. Loo VG, Poirier L, Miller MA, et al. A predominant clonal multi-institutional outbreak of Clostridium difficile - associated diarrhea with high morbidity and mortality. N Engl J Med 2005; 353: 2442-2449.
- 4. Razavi B, Apisarnthanarak A, Mundy LM. Clostridium difficile: emergence of hypervirulence and fluoroquinolone resistance. Infection 2007; 35: 300-307.
- 5. Beneš J, Sýkorová B. Kolitida vyvolaná Clostridium difficile. Zpráva z kongresu ICAAC 2006. Klin mikrobiol inf lek 2006; 12: 247-251.
- 6. Kuijper EJ, van Dissel JT, Wilcox MH. Clostridium difficile: changing epidemiology and new treatment options. Volume 2007; 20: 376-383.
- 7. Hubert B, Loo VG, Bourgault AM, et al. A portrait of the geographic dissemination of the Clostridium difficile North American pulsed-field type 1 strain and the epidemiology of C. difficile - associated disease in Québec. CID 2007; 44: 238-244.
- 8. Cloud J, Kelly CP. Update on Clostridium difficile associated disease. Volume 2007; 23: 4-7.
- 9. Bergmann D, Koten J, Beneš Z, Kohout P, Chlumská A. Pseudomembranózní kolitida. Vnitř Lék 2007; 53: 1100-1107.
- 10. Džupová O, Beneš J. Clostridium difficile a klostridiová kolitida: co je nového. Klin mikrobiol inf lek 2008; 14: 115-117.
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené