Dysfagie jako projev nežádoucího účinku antikoagulační terapie
Renata Kolářová1
+ Pracoviště
Souhrn
Kazuistika prezentuje méně častý nežádoucí účinek dabigatranu, který zejména u predisponovaných jedinců může vést k polékovému postižení sliznice jícnu, tzv. dabigatranem indukované ezofagitidě, projevující se dysfagickými potížemi a typickým endoskopickým nálezem. Po vysazení léku dochází k rychlému ústupu klinických potíží i endoskopického nálezu.
Klíčová slova
dabigatran, dysfagie, ezofagitidaÚvod
Dysfagie neboli porucha polykání je hlavním příznakem organických i funkčních onemocnění jícnu. Podle fáze, která je při polykání narušena, rozdělujeme dysfagii na orofaryngeální, kdy vázne posun sousta z úst do jícnu, a ezofageální, která se projevuje tím, že nemocný polkne sousto, to ale nepostupuje do žaludku a tlačí za hrudní kostí. Příčinami ezofageální dysfagie jsou poruchy motility jícnu, obstrukce jícnu překážkou nebo zevní útlak jícnu. Odynofagie neboli bolest při polykání je charakteristická pro poruchy průchodnosti způsobené spasmem, zánětem nebo vředem [1].
Kazuistika
Ke gastroskopickému vyšetření byla odeslána 74letá polymorbidní pacientka pro dysfagii trvající asi 2 roky, s výrazným zhoršením potíží a váhovým úbytkem 2 kg v posledních 2 měsících. Nemocná udávala váznutí soust, bolesti za hrudní kostí a pálení žáhy navzdory léčbě nasazené praktickým lékařem (omeprazol 1 × 20 mg, itoprid 3 × 50 mg). Internistou je sledována pro hypotyreózu, středně těžkou chronickou renální insuficienci a chronické srdeční selhávání. V roce 2011 podstoupila plastiku mitrální a trikuspidální chlopně, je po opakovaných neúspěšných elektrických kardioverzích pro fibrilaci síní a v roce 2017 jí byl implantován kardiostimulátor pro sick sinus syndrom. V roce 2015 prodělala ischemickou cévní mozkovou příhodu na podkladě stenózy arteria carotis interna vpravo, podstoupila mikroendarterektomii a nadále je v péči neurologa. Kromě jiného užívá kombinaci antiagregační a antikoagulační terapie (kyselina acetylsalicylová 1 × 100 mg, dabigatran 2 × 150 mg).
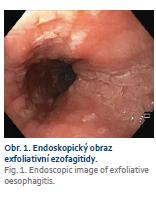
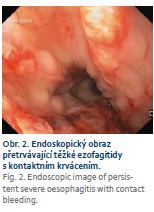
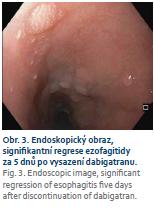
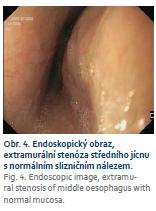
Dominujícím nálezem při gastroskopickém vyšetření byla rozsáhlá exfoliativní ezofagitida (obr. 1) v délce 27–36 cm od řezáků s patrnou poruchou motility jícnu. Byla provedena endobiopsie, navýšena dávka omeprazolu k dosažení plné inhibice kyselé žaludeční sekrece a doporučena kašovitá strava. Histologický nález odpovídal těžké ezofagitidě, k jejíž etiologii se nebylo možné blíže vyjádřit. Ve vzorku nebyly prokázány mykotické elementy, virové inkluze, dysplastické změny ani maligní nádorové struktury. Byl doplněn odběr krve ke stanovení autoprotilátek k vyloučení systémového onemocnění pojiva. Potíže nemocné přetrvávaly. Po měsíci bylo provedeno kontrolní gastroskopické vyšetření s plánem rebiop-sie. Vzhledem k nálezu těžkého zánětu s kontaktním krvácením (obr. 2) byl před plánovou rebiopsií u pacientky se současnou antiagregační a antikoagulační terapií doporučen převod z dabigatranu na nízkomolekulární heparin a pacientka byla pozvána k výkonu o 5 dní později. V tomto krátkém časovém odstupu po změně antikoagulační terapie došlo k signifikantní regresi makroskopického nálezu (obr. 3) a vymizení zánětlivých změn v histologickém obraze. Při léčbě nízkomolekulárním heparinem byla pacientka nadále bez výraznější dysfagie. Po návratu k původní antikoagulační terapii dabigatranem se však potíže nemocné během následujícího měsíce vrátily. Taktéž další gastroskopické vyšetření prokázalo makroskopickou i mikroskopickou recidivu ezofagitidy středního jícnu s naznačenou extramurální stenózou v této lokalizaci. Bylo doplněno CT hrudníku, které potvrdilo zúžení ve střední části jícnu způsobené útlakem mezi hrudní páteří a dilatovaným srdcem. Vzhledem k předchozímu dobrému efektu změny antikoagulační terapie byla nemocná znovu převedena na nízkomolekulární heparin s opětovným ústupem klinických potíží. Z toho důvodu bylo spádovému internistovi doporučeno zvážit úpravu chronické antikoagulační terapie. Po 3 měsících pacientka přichází ke kontrole. Poslední měsíc je antikoagulována apixabanem a žádné výraznější dysfagické potíže neudává. Kontrolní gastroskopické vyšetření prokazuje známou extramurální stenózu středního jícnu, pro endoskop volně prostupnou, s normálním slizničním nálezem (obr. 4).
Diskuze
U naší pacientky byla jako příčina chronických dysfagických potíží zjištěna zevní stenóza středního jícnu, která však při dodržování režimových opatření (dobře mechanicky rozmělněná strava, dostatečné zapíjení soust) nemocné nečinila významnější potíže. Počátek zhoršení příznaků bylo možné vysledovat do doby zahájení terapie dabigatranem, přičemž po vysazení léku opakovaně došlo k rychlému ústupu klinických potíží a regresi endoskopického nálezu. V zahraniční literatuře jsou popsány podobné případy tzv. dabigatranem indukované ezofagitidy [2–7]. Přepokládá se, že její příčinou je váznutí tobolky léčiva v jícnu (např. v místě stenózy). Při retenci kapsle dochází k porušení obalu tobolky a uvolnění pelet, které kromě dabigatranu obsahují také kyselinu vinnou za účelem optimalizace absorpce účinné látky. Prolongované lokální působení kyseliny vinné vede k poškození sliznice jícnu (ezofagitida, ulcerace) [2,5–7].
Dabigatran je kompetitivní, reverzibilní, přímý inhibitor trombinu, patřící do skupiny tzv. nových perorálních antikoagulancií (NOAK). Je indikován v primární prevenci žilních trombembolických příhod u pacientů po náhradě kyčelního nebo kolenního kloubu, v prevenci cévní mozkové příhody a systémové embolie u pacientů s nevalvulární fibrilací síní a k léčbě hluboké žilní trombózy a plicní embolie [8]. K nejčastějším nežádoucím účinkům léčby dabigatranem patří krvácení a dyspepsie. Postižení horního gastrointestinálního traktu (ezofagitida, gastritida, ulcerace, reflux atd.) bývá méně časté [8], i když některé retrospektivní analýzy uvádějí, že endoskopické známky ezofagitidy má 20–26 % pacientů léčených dabigatranem [9,10]. Toto riziko závisí na dávce dabigatranu (220 mg/den vs. 300 mg/den), naopak není ovlivněno současným užíváním inhibitorů protonové pumpy [9,10].
Polékové postižení jícnu může být obecně způsobeno několika mechanizmy, a to iniciací kyselého refluxu, přímým kaustickým účinkem, tedy tvorbou kyselého, zásaditého či hyperosmolárního roztoku, nebo přímou toxicitou na sliznici [11]. Faktory predisponujícími pro vznik polékové ezofagitidy jsou anatomické a funkční odchylky jícnu (stenózy, divertikly, poruchy motility), určité lékové formy (kapsle, tablety s pomalým uvolňováním) nebo nesprávné užívání léku (nedostatečné zapití léku, ulehnutí bezprostředně po užití léku), což vede k prolongované expozici jícnové sliznice léčivému přípravku [6,11].
Závěr
Poléková ezofagitida je možným nežádoucím účinkem antikoagulační terapie dabigatranem. Je třeba zdůraznit, že tento nežádoucí účinek je méně častý, vyskytuje se převážně u predisponovaných jedinců a pravděpodobně je způsoben pomocnou látkou obsaženou v léčivém přípravku, nikoli vlastní účinnou látkou. Termín „dabigatran-induced esophagitis“, užívaný v zahraniční literatuře, může být proto poněkud zavádějící. V prevenci vzniku ezofagitidy se doporučuje tobolku užít vcelku bez porušení obalu, zapít ji dostatečným množstvím vody a po požití tobolky zůstat alespoň 30 min ve vzpřímené poloze [2,5–8]. Pokud nejsou režimová opatření účinná, je namístě změna antikoagulační terapie, protože u žádného jiného léku ze skupiny NOAK není poléková ezofagitida popisována [5].
Doručeno/Submitted: 3. 6. 2019
Přijato/Accepted: 23. 7. 2019
MUDr. Renata Kolářová
Endoskopické centrum
Oblastní nemocnice Náchod a. s.
Purkyňova 446
547 01 Náchod
kolarova.renata@nemocnicenachod.cz
Pro přístup k článku se, prosím, registrujte.
Výhody pro předplatitele
Výhody pro přihlášené
Literatura
1. Duda M, Hildebrand T. Jícen a kardie. In: Mařatka Z et al. Gastroenterologie. 1. vyd. Praha: Karolinum 1999: 53–54.
2. Ootani A, Hayashi Y, Miyagi Y. Dabigatran-induced esophagitis. Clin Gastroenterol Hepatol 2014; 12 (7): e55–e56. doi: 10.1016/j.cgh.2013.09.010.
3. Matsuura H, Suto K, Yasuhara H et al. Longitudinal sloughing mucosal casts: dabigatran-induced oesophagitis. Eur Heart J 2018; 39 (36): 3400. doi: 10.1093/eurheartj/ehy538.
4. Singh S, Savage L, Klein M et al. Severe necrotic oesophageal and gastric ulceration associated with dabigatran. BMJ Case Rep 2013. bcr2013009139. doi: 10.1136/bcr-2013-009139.
5. Wood M, Shaw P. Pradaxa-induced esophageal ulcer. BMJ Case Rep 2015. bcr2015211371. doi: 10.1136/bcr-2015-211371.
6. Kajihara Y. Dabigatran-induced esophagitis. Cleve Clin J Med 2019; 86 (5): 303–304. doi: 10.3949/ccjm.86a.18117.
7. Kajihara Y. Exfoliative esophagitis. Eur J Intern Med 2018; 53: e1. doi: 10.1016/j.ejim.2017.12. 013.
8. European Medicine Agency. SPC Pradaxa. [online]. Dostupné na: https: //www.ema.europa.eu/en/documents/product-information/pradaxa-epar-product-information_cs.pdf.
9. Nyuzuki S, Yamakawa R, Kawauchi K et al. Clinical study of esophagitis induced by dabigatran. [online]. Available from: https: //cdn.ueg.eu/uegfolga-web/uegf-ep-mat088/P1039.pdf.
10. Toya Y, Nakamura S, Tomita K et al. Dabigatran-induced esophagitis: the prevalence and endoscopic characteristics. J Gastroenterol Hepatol 2016; 31 (3): 610–614. doi: 10.1111/jgh.13 024.
11. Katzka DA. Esophageal disorders caused by medications, trauma, and infection. In: Feldman M, Friedman LS, Brandt LJ (eds). Sleisenger and Fordtran’s gastrointestinal and liver disease. 9th ed. Philadelphia: Saunders/Elsevier 2010: 735–737.